2021-11-10 理化学研究所,京都大学
理化学研究所(理研)生命医科学研究センター粘膜免疫研究チームのシドニア・ファガラサンチームリーダー(京都大学大学院医学研究科附属がん免疫総合研究センター教授)、章白浩基礎科学特別研究員らの共同研究グループは、B細胞由来の「ガンマ-アミノ酪酸(GABA)」を標的とする抗腫瘍免疫[1]機構を発見しました。
免疫細胞由来代謝産物の生理的な活性を発見した本研究成果は、新たな抗腫瘍免疫療法や自己免疫疾患[2]治療法の開発に貢献すると期待できます。
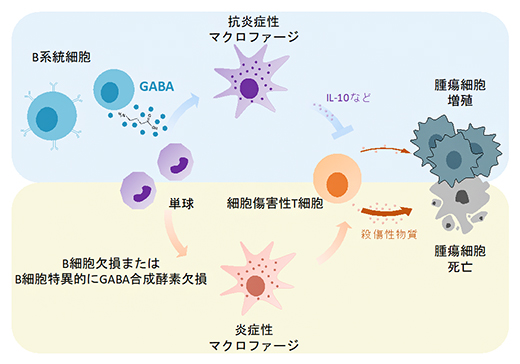
今回、共同研究グループは、神経伝達物質[3]として知られているGABAが末梢の活性化B系統細胞[4]により、合成および分泌されることを発見しました。B細胞由来のGABAは、単球から抗炎症性マクロファージへの分化を促進し、インターロイキン-10(IL-10)[5]の産生を増強することで、細胞傷害性T細胞[6]の機能を阻害することが明らかになりました。また、マウスモデルでは、B細胞欠損またはB細胞特異的にGABA合成酵素GAD67[7]を欠損すると、抗腫瘍免疫反応が増強されました。
本研究は、科学雑誌『Nature』オンライン版(11月3日付)に掲載されました。
B細胞由来GABAを標的とする抗腫瘍免疫機構
背景
生命を維持するには、エネルギーの獲得や生体成分の合成または分解に関わる代謝が必要です。代謝経路のバランスは組織や細胞の正常な機能を保つために重要であり、その異常が原因となって糖尿病や腫瘍などの病気が生じます。
免疫細胞は、自然免疫細胞(単球やマクロファージなど)[8]と獲得免疫細胞[9](T細胞とB細胞)に分けられますが、それぞれの代謝経路の特徴はまだはっきりと解明されていません。近年、代謝経路における代謝産物は、単なる化学反応に使われる中間体というだけでなく、特異的な生理活性を持ち、細胞の機能を制御することが明らかになってきました。しかし、その分子メカニズムにはまだ不明な点が多く残されています。
本研究では、代謝産物を介した免疫細胞間の機能制御に着目し、免疫細胞における代謝経路の特徴が抗腫瘍免疫反応に及ぼす影響について検討しました。
研究手法と成果
共同研究グループはまず、免疫細胞における代謝経路の特徴を見いだすため、フットパッド接種モデル[10]を導入し、野生型マウス、T細胞欠損マウス、B細胞欠損マウス、成熟T細胞と成熟B細胞両方の欠損マウスについて、接種リンパ節と非接種リンパ節のメタボローム解析[11]を行いました。その結果、野生型マウスの接種リンパ節では、非接種と比較してアラニン、アスパラギン酸、グルタミンの代謝経路における代謝産物の濃度が大きく変化し、グルタミン代謝経路に関与する「ガンマ-アミノ酪酸(GABA)」が明らかに増大することが分かりました(図1a)。
また、接種後の野生型マウスと免疫細胞欠損マウスを比較したところ、B細胞が欠損するとGABAが著しく減少することが分かりました(図1a)。さらに、関節リウマチ患者の血漿中GABA濃度が疾患活動性評価スコア[12]および血漿自己抗体(抗環状シトルリン化ペプチド)濃度と正の相関を持つことから、B細胞の活性化により末梢でGABA合成が促進されることが分かりました(図1b)。
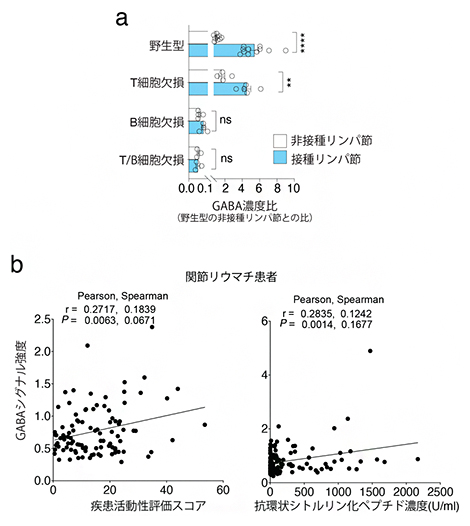
図1 B細胞活性化依存的なGABA合成の促進
a)フットパッド接種モデルにおける各種マウスの接種、非接種リンパ節のGABA濃度比。B細胞欠損によりGABA濃度が減少した。
b)関節リウマチ患者の血漿中のGABA濃度は、疾患活動性評価スコアおよび抗環状シトルリン化ペプチド(自己抗体)濃度とそれぞれ正の相関を持っていた。
次に、異なる組織から単離したT細胞およびB細胞のGABA濃度を測定したところ、B細胞系統、特に小腸のIgA陽性形質細胞(抗体の一種である免疫グロブリンAを産生する細胞集団)に高濃度のGABAが含まれることが分かりました(図2a)。また、B細胞におけるGABA合成機構を解明するために、グルタミン同位体(13C-グルタミン)トレーサー法[13]を用いて、培養プレート内で刺激した生体T細胞およびB細胞の培養液の上澄みを解析しました(図2b)。その結果、ヒトおよびマウスのB細胞がグルタミンからGABAを細胞内で合成し、細胞外に分泌することが分かりました(図2c, d)。
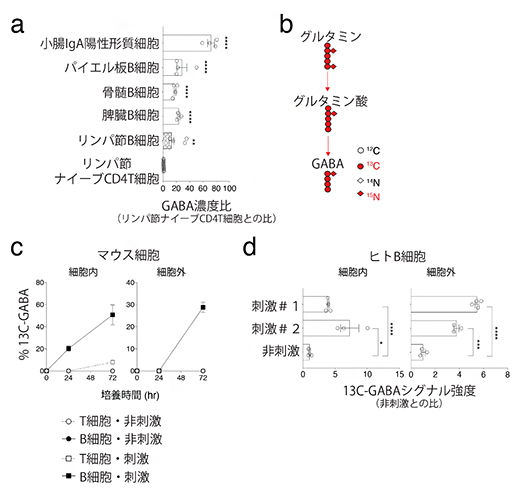
図2 B細胞はグルタミンからGABAを合成し細胞外へ分泌
a)各臓器のB細胞におけるGABA濃度比。小腸のIgA陽性形質細胞は高いGABA濃度を示した。
b)グルタミン同位体(13C-グルタミン)トレーサー法の概略。
c)マウスのB細胞は活性化刺激により、細胞内外のGABA濃度が増加した。
d)ヒトのB細胞は、2種類の活性化刺激#1、刺激#2により、細胞内外のGABA濃度が増加した。
また、これまでにB細胞欠損マウスが強い抗腫瘍免疫反応を示すことが分かっていたことから、GABAがどのように関与するかを検証しました。B細胞欠損マウスにGABAを徐々に放出できるペレットを投与し、マウス大腸がんMC38の成長進度や、腫瘍内浸潤CD8陽性T細胞(TICD8)[14]、腫瘍関連マクロファージ(TAM)[15]をそれぞれ解析しました。その結果、B細胞欠損マウスではGABAの投与により、腫瘍組織の増大、TICD8の殺傷機能力の減少、TAMの抗炎症表現型[16]への分化が認められました(図3)。
また、腫瘍を移植した野生型マウスにGABA-A受容体拮抗薬(ピクロトキシン)[17]を投与すると、腫瘍増殖が一部抑制され、TICD8とTAMが抗炎症性の表現型を示したことから、GABAは抗腫瘍免疫反応を抑制し、その一部はGABA-A受容体を介すると考えられます。
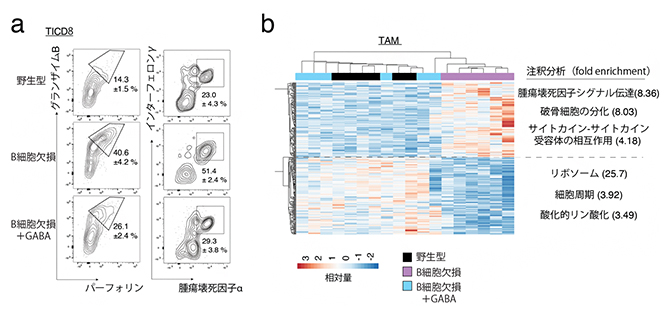
図3 GABAによる抗腫瘍免疫反応の抑制
a)腫瘍を移植したB細胞欠損マウスでは、腫瘍浸潤CD8陽性細胞(TICD8)はGABAペレットの投与により殺傷性物質(グランザイムB、パーフォリン)また炎症促進物質(インターフェロンγ、腫瘍壊死因子α)の産生が抑制された。各種細胞の割合や特徴を解析できるフローサイトメトリーという手法で解析を行った。
b)腫瘍を移植したB細胞欠損マウスでは、腫瘍関連マクロファージ(TAM)はGABAペレットの投与により抗炎症表現型に変わった。各種細胞の遺伝子発現レベルを調べ、相対的な遺伝子の発現強度をヒートマップグラフとして表示した。
次に、TAMは主に単球から分化するマクロファージであることから、単球からマクロファージへの分化過程において、GABAが直接影響を与えるかどうかを検証しました。試験管内で単離したヒトまたはマウスの単球をGABA存在下にてマクロファージへ分化させると、細胞の増殖力および生存率が上がり、抗炎症性マーカーである葉酸受容体β[18]の発現が増強されることが分かりました(図4a)。また、インターロイキン-10(IL-10)で刺激すると、マクロファージの抗炎症表現型がGABAにより増強されました。このマクロファージをCD8陽性T細胞と共培養したところ、T細胞の殺傷能力および機能が抑制されました。
最後に、B細胞由来のGABAが抗腫瘍免疫反応に及ぼす影響を調べるために、B細胞特異的にGABA合成酵素GAD67を欠損したマウスを作製し、腫瘍接種実験を行いました。その結果、GAD67欠損マウスでは、腫瘍サイズが著しく抑制され、TICD8の腫瘍殺傷能力が増強されることが明らかになりました(図4b, c)。
以上の結果から、B細胞由来のGABAは単球から抗炎症性マクロファージへの分化を誘導することで、抗腫瘍免疫反応を抑制することが示されました。
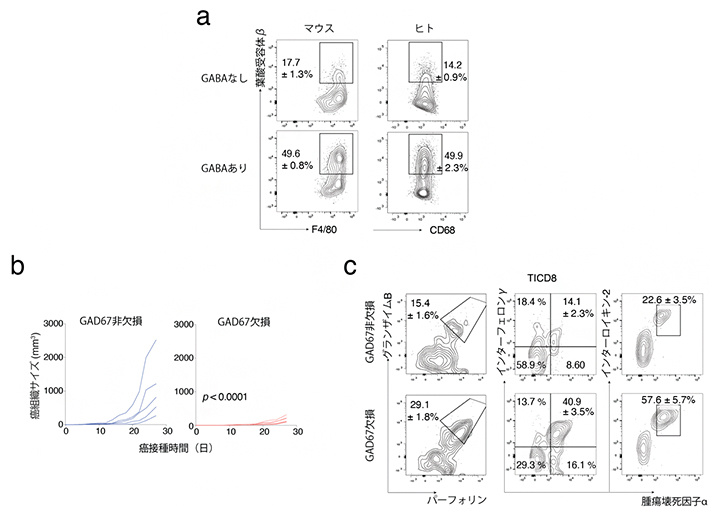
図4 B細胞由来GABA合成の欠損による抗腫瘍免疫反応の促進
a)マウスまたはヒトの単球をマクロファージへ分化させる際にGABAを投与すると、葉酸受容体βの発現が上がることがフローサイトメトリー解析により示された。F4/80とCD68はそれぞれマウスおよびヒトのマクロファージの表面マーカーである。
b)マウスに腫瘍を移植し、そのサイズを経時的に測定したところ、B細胞特異的にGABA合成酵素GAD67を欠損したマウスではコントロールマウスと比較して腫瘍サイズが小さくなった。
c)フローサイトメトリー解析により、B細胞特異的にGABA合成酵素GAD67を欠損したマウスにおいて、その腫瘍浸潤CD8陽性細胞(TICD8)は殺傷性物質(グランザイムB、パーフォリン)や炎症促進物質(インターフェロンγ、インターフェロン-2、腫瘍壊死因子α)の産生が増強されることが示された。
今後の期待
本研究により、低分子代謝産物を中心とした抗腫瘍免疫のメカニズムの一端を明らかにしました。今後、GABAまたは類似の代謝産物を制御し、腫瘍、自己免疫疾患や感染症時の免疫応答制御を可能にする医薬品の開発を目指します。
補足説明
1.抗腫瘍免疫
腫瘍が生体内で異物として認識され、それを排除するように免疫細胞が反応すること。
2.自己免疫疾患
免疫が自身の正常な細胞や組織を構成する要素に反応し、誘発する炎症疾患。関節リウマチなどがある。
3.神経伝達物質
神経細胞間の情報交換を媒介する物質。
4.B細胞系統
免疫細胞の一種であるBリンパ球に関わる発生や分化により産生される全ての細胞。Bリンパ球は主に抗体を産生する機能を持つ。
5.インターロイキン-10(IL-10)
免疫反応を沈静化する抑制性物質の一種。マクロファージの抗炎症表現型を促進し、T細胞のエフェクター活性を抑制できる。
6.細胞傷害性T細胞
免疫細胞の一種であるTリンパ球は、生体内の異物に対し免疫反応を起こす。異物(腫瘍細胞など)あるいは異物に感染した細胞(ウイルスに感染した細胞など)を殺傷し、排除できるTリンパ球の集団を細胞傷害性T細胞(キラー細胞)と呼ぶ。
7.GABA合成酵素GAD67
グルタミン酸デカルボキシラーゼ67(GAD67)はグルタミン酸を脱炭酸する酵素の一種。
8.自然免疫細胞(単球やマクロファージなど)
生体内に侵入した病原体や組織損傷を感知し、すぐに駆けつけてその異常を排除する免疫細胞集団。単球やマクロファージも自然免疫細胞であり、病変箇所に単球が遊走し、分化因子の刺激により異物を貪食して情報を提示できるマクロファージへと分化する。
9.獲得免疫細胞
病原体や非自己物質を認識して記憶し、過去に出会った抗原に対して効果的な免疫応答ができる免疫細胞集団。
10.フットパッド接種モデル
マウスの片方の足裏に非自己物質を接種することにより、免疫反応を活性化させる手法。接種側に近い流入領域リンパ節は、接種リンパ節として免疫反応が亢進される。一方、反対側の足裏に近いリンパ節は、非接種リンパ節として正常な状態に保たれる。
11.メタボローム解析
生命活動における代謝経路で産生される低分子化合物を同定または定量する手法。
12.疾患活動性評価スコア
患者の圧痛や腫脹関節の数、血液検査で検出される炎症関連物質などに基づいて計算されるスコア。
13.グルタミン同位体(13C-グルタミン)トレーサー法
グルタミンを構成する炭素は通常原子量が12である。それを原子量13の炭素(13C)に置換すると、13C-グルタミンを材料として合成される代謝産物の炭素も原子量13となる。13Cでラベルされた代謝産物を追跡してグルタミン代謝経路を明らかにする手法。
14.腫瘍浸潤CD8陽性T細胞(TICD8)
腫瘍に浸潤するT細胞の一種。細胞表面にCD8というマーカータンパク質を発現する。
15.腫瘍関連マクロファージ(TAM)
腫瘍組織に集積しているマクロファージ。単球から分化することが多い。
16.抗炎症表現型
炎症を抑える活性物質を産生するような特徴や形質を表す。
17.GABA-A受容体拮抗薬(ピクロトキシン)
GABAに応答する細胞表面にある受容体の一種はGABA-A受容体であり、ピクロトキシンはその作用を阻害する機能を持つ。
18.葉酸受容体β
葉酸を細胞内に輸送する機構の一種。
共同研究グループ
理化学研究所
生命医科学研究センター
粘膜免疫研究チーム
チームリーダー シドニア・ファガラサン(Sidonia Fagarasan)
(京都大学大学院 医学研究科附属 がん免疫総合研究センター 高次統御システム間制御部門 教授)
基礎科学特別研究員 章 白浩(しょう ひゃくこう)
基礎科学特別研究員(研究当時) アレクシス・フォーゲルザンク(Alexis Vogelzang)
上級研究員 宮島 倫生(みやじま みちお)
上級研究員(研究当時) 鈴木 敬一朗(すずき けいいちろう)
上級研究員 成島 聖子(なるしま せいこ)
技師 丸谷 美香子(まるや みかこ)
テクニカルスタッフⅡ 小林 若菜(こばやし わかな)
テクニカルスタッフⅠ 筒井 裕美(つつい ゆみ)
テクニカルスタッフⅡ 山本 幸子(やまもと さちこ)
融合領域リーダー育成プログラム
上級研究員 ウー・イボ(Wu Yibo)
生命機能科学研究センター 細胞システム動態予測研究チーム
チームリーダー 城口 克之(しろぐち かつゆき)
基礎科学特別研究員 北條 望(ほうじょう のぞみ)
研究員(研究当時) 小川 泰策(おがわ たいさく)
京都大学大学院 医学研究科
免疫ゲノム医学講座
特別教授 本庶 佑(ほんじょ たすく)
特定准教授 茶本 健司(ちゃもと けんじ)
研究員(研究当時) 波多江 龍亮(はたえ りゅうすけ)
博士課程学生(研究当時) ローズマリー・メンジーズ(Rosemary J. Menzies)
研究員 平野 智子(ひらの ともこ)
疾患ゲノム疫学
教授 松田 文彦(まつだ ふみひこ)
民間等共同研究員 園村 和弘(そのむら かずひろ)
免疫・膠原病内科
特定准教授 村上 孝作 (むらかみ こうさく)
特定講師(研究当時) 橋本 求(はしもと もとむ)
免疫細胞生物学
教授 上野 英樹(うえの ひでき)
泌尿器科学教室
准教授 小林 恭(こばやし たかし)
博士課程学生 伊藤 克弘(いとう かつひろ)
慶應義塾大学 医学部 医化学教室
教授 末松 誠(すえまつ まこと)
専任講師 杉浦 悠毅(すぎうら ゆうき)
日本大学 生物資源科学部 獣医学科 獣医生化学研究室
教授(研究当時) 杉谷 博士(すぎや ひろし)
研究員(研究当時) 中野 令(なかの れい)
研究支援
本研究は、理化学研究所 組織横断連携プロジェクト(Aging Project)「ライフサイエンスの横断的取組による超高齢社会課題解決への貢献」、同基礎科学特別研究員制度、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域(研究開発総括:清水孝雄)における研究開発課題「腸内細菌叢制御による代謝・免疫・脳異常惹起メカニズムの解明と治療応用(研究開発代表者:シドニア・ファガラサン)」、同革新的先端研究開発支援事業ステップタイプ(AMED-FORCE)「自己免疫疾患関連精神症状に関与する代謝産物の解析(研究開発代表者:シドニア・ファガラサン)」、同革新的先端研究開発支援事業(AMED-PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域(研究開発総括:西田栄介)における研究開発課題「腸管エコシステムの恒常性の変容に起因する、社会性行動を制御する脳機能低下メカニズムの解明(研究開発代表者:宮島倫生)」、日本学術振興会(JSPS)科学研究費補助金挑戦的研究(萌芽)「がんの抗PD-1抗体療法耐性メカニズム解明に向けた実験基盤構築(研究代表者:宮島倫生)」および京都大学基金「柳井基金」による支援を受けて行われました。
原論文情報
Baihao Zhang, Alexis Vogelzang, Michio Miyajima, Yuki Sugiura, Yibo Wu, Kenji Chamoto, Rei Nakano, Ryusuke Hatae, Rosemary J. Menzies, Kazuhiro Sonomura, Nozomi Hojo, Taisaku Ogawa, Wakana Kobayashi, Yumi Tsutsui, Sachiko Yamamoto, Mikako Maruya, Seiko Narushima, Keiichiro Suzuki, Hiroshi Sugiya, Kosaku Murakami, Motomu Hashimoto, Hideki Ueno, Takashi Kobayashi, Katsuhiro Ito, Tomoko Hirano, Katsuyuki Shiroguchi, Fumihiko Matsuda, Makoto Suematsu, Tasuku Honjo, Sidonia Fagarasan, “B cell-derived GABA elicits IL-10+ macrophages to limit anti-tumour immunity”, Nature, 10.1038/s41586-021-04082-1
発表者
理化学研究所
生命医科学研究センター 粘膜免疫研究チーム
チームリーダー シドニア・ファガラサン(Sidonia Fagarasan)
(京都大学大学院医学研究科附属がん免疫総合研究センター教授)
基礎科学特別研究員 章 白浩(しょう ひゃくこう)
報道担当
理化学研究所 広報室 報道担当
京都大学 総務部広報課国際広報室