2022-02-05 東京大学
植松 沙織(大学院新領域創成科学研究科 博士課程3年生)
大野 聡(遺伝子実験施設 助教)
黒田 真也(生物科学専攻 教授)
発表のポイント
- 同位体標識実験(注1) を用いずにマルチオミクスデータ(注2) から代謝変化とその制御を解析する数理モデルOMELETを開発しました。
- OMELETを用いて肥満モデルマウスにおける肝臓グルコース代謝変化とその変化を引き起こしている制御を定量的に解析しました。
- OMELETは生物種や代謝経路を問わず適用可能であるため、肥満だけでなく様々な代謝疾患の病態の解明に貢献することが期待されます。
発表概要
東京大学大学院新領域創成科学研究科の植松沙織博士課程学生と東京大学大学院理学系研究科の大野聡助教・黒田真也教授は、九州大学生体防御医学研究所の中山敬一教授・久保田浩行教授、新潟大学大学院医歯学総合研究科の松本雅記教授・幡野敦助教、東京大学大学院新領域創成科学研究科の鈴木穣教授、慶應義塾大学先端生命科学研究所の曽我朋義教授・平山明由特任准教授らとの共同研究により、独自に開発した数理モデルOMELETを用いて肥満における肝臓グルコース代謝変化とその制御を定量的に解析しました。
肝臓は、全身のグルコース恒常性維持のための中心的な役割を果たしており、肥満や糖尿病では肝臓グルコース代謝異常が見られます。これまでは、同位体標識実験により代謝反応の反応速度(代謝フラックス)の異常が計測されてきましたが、これにはコストと時間がかかっていました。また各代謝反応は酵素や代謝物など様々な分子により制御されていますが、どの分子がどの程度代謝異常に影響するのかはよく分かっていませんでした。
今回研究グループは、マルチオミクスデータから代謝フラックスを推定する数理モデルOMELETを独自に開発し、同位体標識実験を用いずにマウス肝臓の代謝フラックスとその制御の両方を解析することで、肥満モデルマウスにおける肝臓グルコース代謝変化とその原因を定量的に明らかにしました。肥満において糖新生とその律速反応であるホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)(注3)反応のいずれの代謝フラックスも増加していましたが、糖新生では主に転写物で代謝フラックスの増加が引き起こされているのに対し、PEPCKでは基質代謝物により代謝フラックスの増加が引き起こされていました。
研究グループが開発したOMELETは生物種や代謝経路を問わず適用可能であるため、肥満だけでなく様々な代謝疾患の病態の解明に貢献することが期待されます。
発表内容
研究の背景
グルコース(ブドウ糖)は生体にとって最も重要な栄養源の1つであり、人体には血糖値(血中グルコース濃度)を一定に保つ恒常性維持機構が備わっています。中でも肝臓は、グルコース恒常性維持のための主要な臓器であり、空腹時には糖新生やグリコーゲン分解を介してグルコースを産生し血中へ放出することで血糖値の維持に寄与しています。しかし、肥満や糖尿病では慢性的に血糖値が高く、グルコース恒常性維持機構が破綻しています。したがって、肝臓グルコース代謝を調べることは肥満や糖尿病の病態解明のために重要です。
肥満における代謝異常を理解するためには、代謝がどのように変化しているか、その変化に対して酵素や代謝物など複数の制御因子が、それぞれどの程度寄与しているかという定量的情報が必要です。代謝の変化を直接的に知るためには、代謝反応の反応速度(代謝フラックス)を計測することが必要です。一般に代謝フラックスは同位体標識実験により計測されますが、特に生体内の特定の臓器における代謝フラックスの計測にはコストと時間がかかっていました。例えば、投与する同位体標識代謝物の用量やサンプリング時間などの実験条件の最適化が必要で、標的臓器以外での代謝も考慮した解析が必要でした。また、代謝フラックス変化に関わる制御因子については、近年の計測機器の発展により大規模に計測可能になりましたが、それぞれの制御因子が代謝変化にどの程度影響しているかは分かっていませんでした。
そこで本研究グループは、同位体標識実験を行わずにマルチオミクスデータを用いて代謝フラックスとその制御を解析する数理モデルを開発し、これを用いて肥満における肝臓グルコース代謝異常を定量的に理解することを目的としました。
研究内容
本研究グループは、マルチオミクスデータから代謝フラックスとその制御の両方を推定する手法Omics-Based Metabolic Flux Estimation without Labeling for Extended Trans-omic Analysis (OMELET)を開発しました(図1)。OMELETはベイズ推定(注4) に基づいており、代謝物・酵素タンパク質・転写物量のマルチオミクスデータと標的代謝経路の情報を入力として、代謝フラックスと反応速度パラメータを推定します。反応速度パラメータは、条件間の代謝フラックスの差に対する制御因子の寄与率を計算するのに用います。
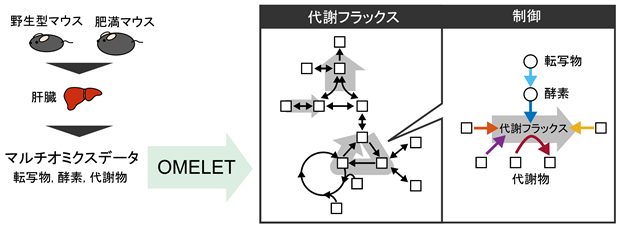
図1:マルチオミクスデータから代謝変化とその制御を定量的に解析する数理モデルOMELETにより、肥満における肝臓グルコース代謝異常を解析した。
肝臓のグルコース代謝の代謝フラックスの推定
研究グループは空腹時の野生型と肥満および糖尿病モデルマウスであるob/obマウス肝臓から、代謝物・酵素タンパク質・転写物のマルチオミクスデータを取得しました。肥満ではグルコース代謝に属する多くの代謝物・酵素タンパク質・転写物が増加していました。しかし、マルチオミクスデータのみからでは肥満において代謝フラックスがどのように変化しているのか分かりませんでした。そこで、まずこれらのマルチオミクスデータに対してOMELETを適用し、肝臓の糖代謝の代謝フラックスを推定し、肥満に伴う代謝フラックス変化を定量しました。OMELETで推定した代謝フラックスは、先行研究における同位体標識実験で得られた代謝フラックスとよく一致しており、OMELETは同位体標識実験なしでも十分に正確な代謝フラックスを推定できることを確かめました。また、OMELETにより、肥満マウスでは糖新生やピルビン酸サイクルの代謝フラックスが大きく増加することが分かりました(図2)。
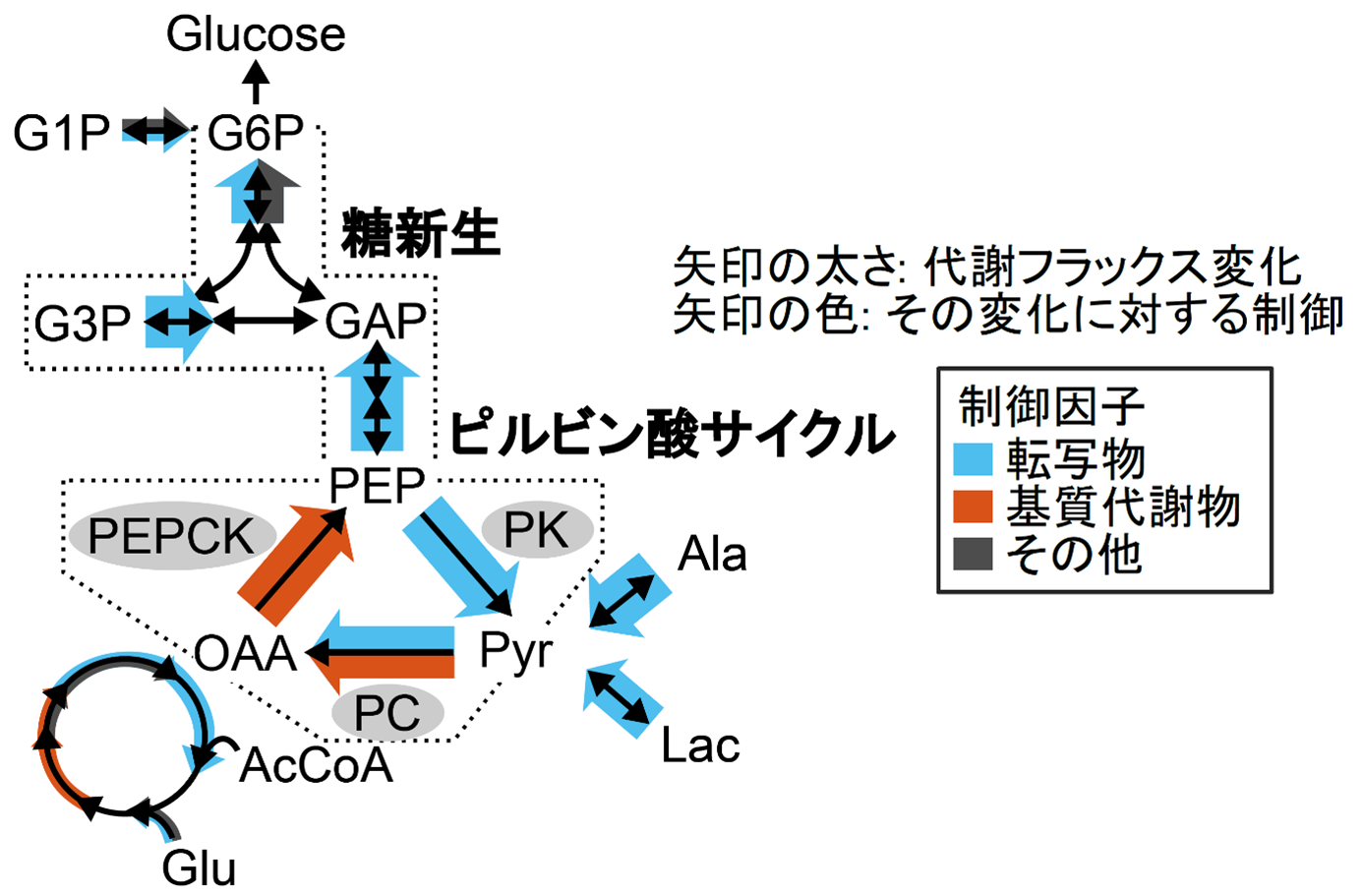
図2:肥満における肝臓グルコース代謝変化とその変化に対する主な制御。肥満マウスにおける糖新生の代謝フラックスの増加は代謝物ではなく主に転写物の増加で引き起こされていた。一方でピルビン酸サイクルでの代謝フラックス増加は、まずPKの転写物の増加によりPKフラックス増加が起こり、それが下流のPC・PEPCKの基質代謝物の増加をもたらし、最終的に基質代謝物の増加に駆動されてPEPCKフラックス増加が起こった。
肥満における代謝フラックス変化に対する寄与率
肥満による代謝フラックス変化に対して、酵素や代謝物など各制御因子がどの程度影響を及ぼしているかを調べるため、マルチオミクスデータとOMELETから推定された反応速度パラメータから、肥満に伴う代謝フラックス変化に対する各制御因子の寄与率を算出しました。その結果、肥満マウスにおける糖新生の代謝フラックスの増加は代謝物ではなく、主に転写物の増加が酵素発現を介して引き起こしていることが分かりました(図2)。一方でピルビン酸サイクルのフラックス増加の機序は反応によって異なっており、ピルビン酸キナーゼ (PK)(注5) は主に転写物量、ピルビン酸カルボキシラーゼ(PC)(注6)は転写物と基質代謝物の両方、ホスホエノールピルビン酸カルボキシラーゼ(PEPCK)は主に基質代謝物の増加で引き起こされていることが明らかになりました。このことから、ピルビン酸サイクルの代謝フラックス増加は、まずPKの転写物増加によりPKフラックス増加が起こり、それが下流のPC・PEPCKの基質代謝物の増加をもたらし、最終的に基質代謝物の増加に駆動されてPEPCKフラックス増加が起こったという機序が示唆されました。
以上より、マルチオミクスデータ・OMELET を用いて推定された代謝フラックス・代謝フラックスに対する制御因子の寄与率を統合することで、定量的なトランスオミクスネットワーク(注7)として、肥満による肝臓グルコース代謝の変化とそれを引き起こす制御の一端が明らかになりました。
社会的意義・今後の予定
近年、オミクス計測技術の発展により様々な生物種においてマルチオミクスデータが蓄積されています。一方でマルチオミクスデータを統合し有益な生物学的知見を導き出す事が現在の課題となっており、新たな解析技術開発の必要性が増しています。本研究グループが開発したOMELETはマルチオミクスデータが取得できていれば生物種や代謝経路を問わず適用可能であるため、同位体標識実験が困難なマウスやヒトにおける様々な代謝疾患の病態の解明に貢献することが期待されます。
本研究は、日本学術振興会における科学研究費助成事業の新学術領域研究(研究領域提案型)「2型糖尿病の代謝アダプテーション」(課題番号:JP17H06299, JP17H06300 研究代表者:黒田真也)、科学技術振興機構における戦略的創造研究推進事業「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」研究領域 研究課題名「時空間トランスオミクスを用いた多細胞・臓器連関代謝制御の解明」(課題番号:JPMJCR2123 研究代表者:黒田真也)の一環として得られました。
発表雑誌
- 雑誌名
iScience論文タイトル
Multi omics based label free metabolic flux inference reveals obesity associated dysregulatory mechanisms in liver glucose metabolism著者
Saori Uematsu, Satoshi Ohno*, Kaori Y. Tanaka, Atsushi Hatano, Toshiya Kokaji, Yuki Ito, Hiroyuki Kubota, Ken-ichi Hironaka, Yutaka Suzuki, Masaki Matsumoto, Keiichi I. Nakayama, Akiyoshi Hirayama, Tomoyoshi Soga, Shinya Kuroda*DOI番号
Redirecting
用語解説
注1 同位体標識実験
安定同位体で標識された代謝物を細胞内もしくは個体内に取り込ませ、その拡散や変化を追跡することで代謝状態を推定する実験手法。
注2 マルチオミクスデータ
代謝物・酵素タンパク質・転写物など異なる種類の複数のオミクスデータ。
注3 ホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)
ピルビン酸サイクルに属し、オキサロ酢酸をホスホエノールピルビン酸に変換する反応。糖新生経路の律速反応の一つでもある。
注4 ベイズ推定
観測データを生成する確率を最大にする値ではなく、観測データやパラメータ自身のばらつき性を反映した分布としてパラメータを推定する統計手法。
注5 ピルビン酸キナーゼ (PK)
ピルビン酸サイクルに属し、ホスホエノールピルビン酸をピルビン酸に変換する反応。解糖系の律速反応の一つ。
注6 ピルビン酸カルボキシラーゼ(PC)
ピルビン酸サイクルに属し、ピルビン酸をオキサロ酢酸に変換する反応。クエン酸回路への補充経路の一つ。
注7 トランスオミクスネットワーク
転写物、タンパク質、代謝物などの複数オミクス階層にまたがる大規模な代謝制御ネットワーク。