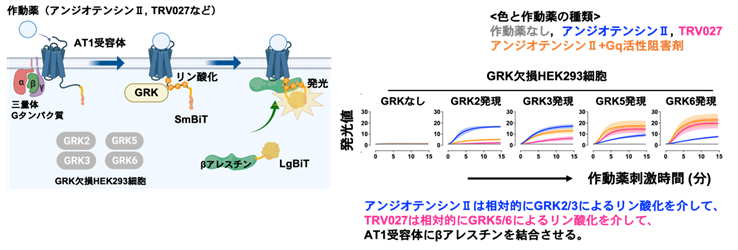
2022-02-21 藤田医科大学,日本医療研究開発機構
ポイント
- マウス脳の側坐核において、忌避刺激が電位依存性カリウムチャネルKCNQ2のリン酸化レベルを亢進させることを明らかにしました。
- 忌避刺激によるKCNQ2リン酸化は、ムスカリンM1受容体(英語名:muscarinic M1 receptor, M1R)[注1]やPKCの活性化を必要とすることが分かりました。
- 側坐核でのKCNQ2欠損は忌避学習[注2]を促進させることが明らかになりました。
- アルツハイマー型認知症の治療薬ドネペジル(商品名:アリセプト®)をマウスへ全身投与するとKCNQ2リン酸化が著しく亢進することから、KCNQ2チャネルは当該認知症に対する新たな創薬標的として期待が持たれます。
研究の概要
日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム・革新的技術による脳機能ネットワークの全容解明プロジェクト事業において、藤田医科大学総合医科学研究所の貝淵弘三所長、坪井大輔講師、名古屋大学大学院のMd. Omar Faruk研究員らの研究グループは、不快情動のひとつである忌避学習に関わる分子メカニズムを明らかにしました。
従前研究において神経伝達物質アセチルコリン(英語名:Acetylcholine, Ach)[注3]は忌避行動とその学習機構に関与していることが知られていましたが、その細胞内シグナル伝達機構は理解されていませんでした。上述の研究グループは、マウスの忌避学習過程においてアセチルコリン刺激が電位依存性カリウムチャネルKCNQ2のリン酸化を亢進させることを明らかにしました。忌避刺激(足裏への電気ショック)により側坐核へ放出されたアセチルコリンは、ムスカリンM1受容体を介してプロテインキナーゼC(PKC)を活性化させます。活性化されたPKCがKCNQ2を直接リン酸化することでカリウムチャンネル活性を抑制し、神経細胞の興奮性[注4]を高めると考えられます。また、KCNQ2リン酸化がアルツハイマー型認知症治療薬ドネペジルの全身投与で著しく亢進することから、当該シグナル伝達経路は認知症病態に関わっている可能性があり、KCNQ2チャネルの機能調節薬は新たな治療標的となることが期待されます。この研究成果は、国際神経化学誌“Journal of Neurochemistry(ジャーナル・オブ・ニューロケミストリー)”に2021年12月19日にオンライン版で発表されました。
研究の背景
脳深部領域に位置する側坐核(Nucleus Accumbens, NAc)は、忌避学習などの情動行動において重要な役割を担っています。側坐核の95%を構成する細胞は中型有棘神経細胞(Medium spiny neuron, MSN)で、ドパミンD1受容体(D1R)やドパミンD2受容体(D2R)を発現しており、中脳からのドパミン作動性神経により強固な神経支配を受けています。一方で、側坐核を構成する神経細胞の1-2 %はアセチルコリン(Ach)を放出するコリン作動性神経として働いています。アセチルコリンは線条体や側坐核に豊富に存在し、忌避刺激(例:足裏への電気ショック、尾部への圧刺激)が側坐核でのアセチルコリン放出の増加を促します。電気生理学的解析からアセチルコリンは電位依存性のカリウムチャンネルKCNQ2の活性を抑制し、その結果、中型有棘神経細胞の興奮性を促進すると考えられています。しかしながら、アセチルコリンが関わる神経細胞の興奮性と忌避学習のメカニズムは十分に理解されていませんでした。
研究成果
KCNQ2のプロテオミクス解析からKCNQ2-Thr217 (KCNQ2の細胞内ドメインに位置する217番目のスレオニン残基)を含む幾つかのリン酸化候補部位が同定されていましたが、その生理学的意義は分かっていませんでした。本研究によりPKCがKCNQ2-Thr217を直接、リン酸化すること、Thr217リン酸化はM1RやPKCの活性化を必要とすることが明らかになりました。そして、忌避刺激(足裏刺激)がM1Rを介してKCNQ2-Thr217のリン酸化レベルを上昇させることを見いだしました。これらの結果は、忌避刺激がM1R-PKCシグナル伝達経路を活性化させることを示唆するものです。次に忌避刺激が側坐核でのアセチルコリン放出を促進させることから、アセチルコリン刺激によるKCNQ2-Thr217リン酸化について生体マウスにおいて検証しました。アセチルコリンエステラーゼ阻害作用を持つアルツハイマー型認知症の治療薬ドネペジルをマウスに全身投与することで脳内アセチルコリン濃度を上昇させた場合、側坐核においてKCNQ2-Thr217のリン酸化が著しく亢進していることを見いだしました。これらの結果は、KCNQ2が忌避学習において抑制的に働いていることを意味しています。以上の研究成果から、研究グループは忌避学習における細胞内シグナル伝達機構について以下のように提唱しました(図1)。忌避刺激で興奮が惹起されたコリン作動性神経がアセチルコリンを放出し、これがM1R-PKCシグナル伝達経路を活性化します。活性されたPKCがKCNQ2をリン酸化することによりカリウムチャネル活性を抑制します。その結果、神経細胞の興奮性が上昇し、忌避学習・行動が促進されます。
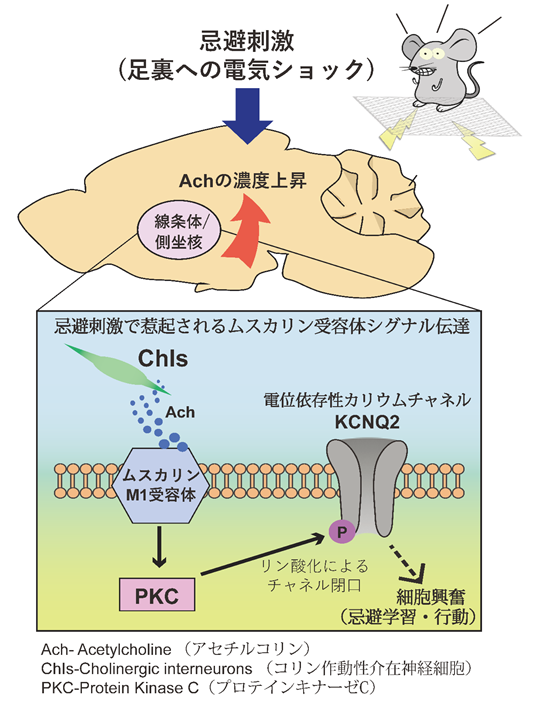
図1線条体/側坐核では忌避刺激によリ惹起されたコリン性作動性介在神経がアセチルコリンを放出する。アセチルコリンはムスカリンMl受容体を通じてプロテインキナーゼC(PKC)を活性化させることで、電位依存性カリウムチャネルKCNQ2のリン酸化レペルを冗進させる。リン酸化したKCNQ2チャネルはカリウムイオンを阪外へ流出させ難くすることで神経細胞の輿密性を上げるものと思われる。
今後の展望
アルツハイマー型認知症は、病態の進行に伴い脳の神経細胞が徐々に死んで減少することで、脳全体が萎縮してしまう神経疾患です。特に記憶に重要な“海馬”という部位が障害されるため、患者の多くは特徴的な症状として記憶障害を呈します。KCNQ2チャネルやM1Rは線条体/側坐核だけでなく海馬において高発現していることが分かっています。これは、海馬においても神経伝達物質アセチルコリンがKCNQ2を介して神経の膜興奮の制御機構を制御している可能性を示しています。今日のアルツハイマー型認知症に対する治療においては、神経細胞死によるアセチルコリン減少を補うためアセチルコリン分解消失を抑える薬剤(ドネペジル等)が治療薬として処方されています。KCNQ2リン酸化がアルツハイマー型認知症治療薬ドネペジルの全身投与で著しく亢進することから、M1R/PKC/KCNQ2シグナル伝達経路が認知症の病態形成や維持に関わっている可能性が考えられます。KCNQチャネルの機能調節薬はアルツハイマー型認知症の新たな治療標的となることが期待されます。
研究支援
本研究は、以下の支援を受けて実施されました。
国立研究開発法人日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(脳科学研究戦略推進プログラム)・(革新的技術による脳機能ネットワークの全容解明プロジェクト)」
研究開発代表者:貝淵弘三
用語解説
- [注1]ムスカリンM1受容体
- 三量体G蛋白質に共役した代謝型アセチルコリン受容体であり、M1~M5の5種類のサブタイプが存在する。側坐核のMSNではM1やM4ムスカリン受容体が発現している。
- [注2]忌避学習
- 忌避刺激に遭遇して不快な経験を習得すると、忌避刺激を予告する条件刺激や予測させる文脈刺激に対して忌避刺激に遭遇せずにすむように行動をとることを学ぶ過程を忌避学習という。
- [注3]アセチルコリン
- アセチルコリン(英語名:Acetylcholine, Ach)はコリン系神経伝達物質であり、骨格筋や神経系に広範囲に発現しており、神経筋または神経間のシナプス伝達を調節している。アセチルコリン受容体には、イオンチャネル型のニコチン受容体と代謝型受容体であるムスカリン受容体があり、線条体/側坐核のMSNにはムスカリン性の代謝型受容体が発現している。
- [注4]神経細胞の興奮性
- 細胞膜の内外には電解質が不均衡に分布しており、神経細胞の細胞膜は刺激に応じて細胞内外の電解質が大きく変化することで多様な膜電位をとることをいう。膜電位が閾値を超えると活動電位が発生する。
掲載論文
- タイトル
- Muscarinic signaling regulates voltage-gated potassium channel KCNQ2 phosphorylation in the nucleus accumbens via protein kinase C for aversive learning
- 著者・所属
- Md. Omar Faruk1, Daisuke Tsuboi2, Yukie Yamahashi2, Yasuhiro Funahashi2, You-Hsin Lin1, Rijwan Uddin Ahammad1, Emran Hossen1, Mutsuki Amano1, Tomoki Nishioka2, Anastasios V Tzingounis3, | Kiyofumi Yamada4, Taku Nagai5, Kozo Kaibuchi1,2
- Department of Cell Pharmacology, Nagoya University Graduate School of Medicine, Nagoya, Aichi, Japan
- Research Project for Neural and Tumor Signaling, Institute for Comprehensive Medical Science, Fujita Health University, Toyoake, Aichi, Japan
- Department of Physiology and Neurobiology, University of Connecticut, Storrs, Connecticut, USA
- Department of Neuropsychopharmacology and Hospital Pharmacy, Graduate School of Medicine, Nagoya University, Nagoya, Aichi, Japan
- Division of Behavioral Neuropharmacology, International Center for Brain Science (ICBS), Fujita Health University, Toyoake, Aichi, Japan
- 掲載誌
- Journal of Neurochemistry
- DOI
- 10.1111/jnc.15555
お問い合わせ先
研究に関するお問い合わせ先
貝淵 弘三(かいぶち こうぞう)
藤田医科大学 総合医科学研究所 所長(教授)
報道に対するお問い合わせ先
河村 孝司(かわむら たかし)
藤田医科大学 広報部 副部長
AMED事業に関するお問い合わせ先
日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課
「脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)」担当