体作りに重要な細胞分裂の仕組みの理解促進に期待
2018-07-09 名古屋大学,国立遺伝学研究所
Dynein-Dynactin-NuMA clusters generate cortical spindle-pulling forces as a multi-arm ensemble
Masako Okumura, Toyoaki Natsume, Masato T Kanemaki, Tomomi Kiyomitsu
eLife Research Article May 31, 2018 DOI:10.7554/eLife.36559
このたび、名古屋大学大学院理学研究科の 清光 智美 助教の研究グループは、情報・システム研究機構国立遺伝学研究所の 鐘巻 将人 教授、夏目 豊彰 助教との共同研究で、光を用いてヒトの内在性タンパク質の局在を自在に操作する技術を開発し、細胞分裂装置(紡錘体1))の配置を光で操作することに世界で初めて成功しました。紡錘体の配置は細胞分裂の方向や娘細胞のサイズを決めるため、母細胞が2つの同じ娘細胞に分裂するのか、それとも2つの異なる娘細胞に分裂するのかを決める重要な役割を担います。従って、紡錘体を適切に配置する仕組みは、私たちの体を作る基礎となりますが、どのようにして紡錘体を動かす力が生み出されるのかは、理解されていませんでした。私たちは、今回新たに開発した技術を用いて複数の候補因子の局在を操作したところ、紡錘体牽引力の生成に十分なヒト遺伝子を同定することに成功しました。この発見は、細胞分裂の対称性・非対称性制御の仕組みを理解する上で極めて重要な手がかりとなり、細胞分裂が私たちの体作りに果たす役割や、その破綻と疾患との関連について理解が進むことが期待されます。
この研究成果は、平成30年5月31日(日本時間)に英国科学雑誌「eLife」オンライン版に掲載されました。
なお、この研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)、文部科学省科学研究費助成事業等の支援のもとで行われたものです。
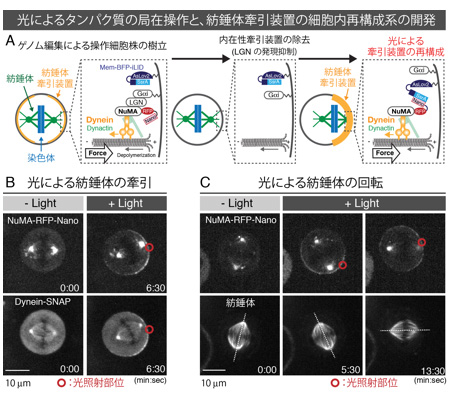
図1: 光によるタンパク質の局在操作と紡錘体配置の光操作
(A) 光によるヒト内在性タンパク質の局在操作の模式図。まず膜局在型のiLID(Mem-BFP-iLID)、RFP-Nanoを融合したNuMA(NuMA-RFP-Nano)の2つを発現する細胞株を樹立した。RNA干渉法(RNAi)7)をもちいてNuMAの上流因子LGNを発現抑制した後、赤丸領域を光照射することによって、NuMA-RFP-Nanoを細胞膜へと局在操作した。光照射によってiLIDは構造を変え、Nanoと結合するため、NuMA-RFP-Nanoを膜上へと局在化できる。(B) 光による紡錘体の牽引の様子。上段;NuMA-RFP-Nano像。下段; SNAPタグを融合したDynein-SNAP像。赤丸で記した領域に光を照射すると、NuMAおよびダイニンはその領域近くの細胞膜に局在化し、その後、その方向に紡錘体が引き寄せられていく。(C) 光による紡錘体の回転操作の様子。光照射部位を回転させると、NuMA局在の回転に伴い、紡錘体が回転する様子が観察された。上段:NuMA-RFP-Nano像。下段:紡錘体像。点線は紡錘体の長軸を表す。
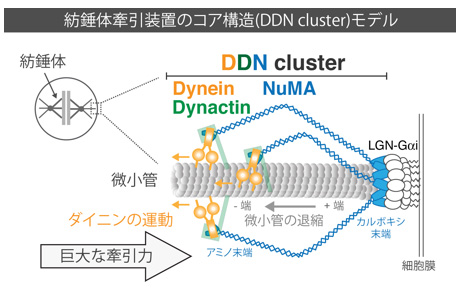
図2:紡錘体牽引装置の構造モデル
NuMAは尾部(カルボキシル末端)の自己集合ドメインを介して環状構造を形成し、かつ微小管結合ドメインを用いて、微小管の先端に結合することで、微小管の退縮エネルギーを牽引力に変換する。またNuMAの頭部(アミノ末端)領域によって局在化された複数のダイニン、ダイナクチン分子は微小管の側面に結合し、ダイニンのマイナス端への運動エネルギー用いて大きな微小管牽引力を生み出す。このようにダイニン, ダイナクチン, NuMAがcluster構造(Dynein-Dynactin-NuMA (DDN) clusterと命名)をとることによって、まるで人の手のような形をつくり、より効率的に微小管を捕らえ、紡錘体牽引力を生成できると考えられる。