2022-08-29 量子科学技術研究開発機構
発表のポイント
- アルツハイマー病1)などの認知症で脳内に蓄積する異常なタウ2)タンパク質(以下、タウ病変)の陽電子断層撮影(PET)3)画像をAI4)(人工知能)で解析し、タウ病変の蓄積パターンを自動で評価。
- タウ病変の蓄積パターンから、代表的認知症である「アルツハイマー病らしさ」と、運動障害を伴う認知症である「進行性核上性麻痺5)らしさ」の判別に役立つスコア6)を算出できるようにAIを訓練。
- AIが算出するスコア(各疾患のらしさを示すタウ病理指標)によって、アルツハイマー病、進行性核上性麻痺、健常加齢の3者を高い精度で識別できるだけでなく、スコアの高さは疾患の重症度の尺度としても有用。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」という)量子生命・医学部門 量子医科学研究所 脳機能イメージング研究部の樋口真人部長、遠藤浩信研究員は、脳内に蓄積する異常タンパク質「タウ」病変のPET画像を人工知能(AI)で解析することにより、アルツハイマー病や前頭側頭葉変性症7)など、多様な神経変性型の認知症に生じる特徴的な脳内の病態を自動的に認識し、認知症の診断と鑑別に役立つスコアを算出することに成功しました。
認知症の大半を占めるのは、脳の中に異常なタンパク質が蓄積する神経変性型の認知症で、これはアルツハイマー病、前頭側頭葉変性症、レビー小体型認知症8)の3大認知症からなります。前頭側頭葉変性症には進行性核上性麻痺という、体の動きの障害を伴う認知症が含まれます。これらの認知症を正確に診断・鑑別することはこれまで困難でしたが、量研によって脳内に蓄積するタウ病変をPETで画像化する技術が開発され、タウ蓄積の有無や、蓄積する場所の違いから、タウ病理を特徴としないレビー小体型認知症を除く、各種認知症が識別できるようになりました。しかしながら、PET画像から診断に役立つ情報を得るためには、熟練を要する読影技術や画像解析技術が必要でした。
そこで量研ではAIを用いて読影と画像解析を自動化する技術を開発しました。臨床情報に基づいて識別されたアルツハイマー病患者、進行性核上性麻痺患者、健常高齢者のタウ病変PET画像情報をAIに学習させて、それぞれの病態に特徴的なタウ蓄積パターンと量を自動で認識し、「アルツハイマー病らしさ」を表す「アルツハイマー病タウスコア」と「進行性核上性麻痺らしさ」を表す「進行性核上性麻痺タウスコア」をPET画像からそれぞれ算出できるようにAIを訓練しました。
その結果、AIが算出するスコアによって、アルツハイマー病患者、進行性核上性麻痺患者、健常高齢者の3者を95%以上の正確さで識別することが可能になりました。また、スコアの高さと疾患の重症度はよく相関し、病期がどれだけ進行しているかをスコアから客観的に評価できることが分かりました。
各画像解析は自動的に行われるため、複雑な操作を要しません。AIにより熟練の読影や画像解析のスキルが再現され、認知症の全自動診断に向けた基幹技術がもたらされました。現在、様々な研究機関や製薬企業によって、タウ病変を減らす新たな認知症の治療薬開発が進められていますが、今回開発された技術を応用することにより、こうした治療薬の薬効評価を自動化することも可能になると見込まれます。
本研究は、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)『神経変性疾患のタンパク凝集・伝播病態と回路傷害の分子イメージング研究』」「脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)『シヌクレイノパチーを全身病として捉えた病態解明と疾患修飾療法の開発』」、「認知症研究開発事業『神経過興奮とタウ放出・伝播の悪循環を標的とする認知症の病態解明と治療法開発』」、国立研究開発法人科学技術振興機構(JST)ムーンショット型研究開発事業「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて」、厚生労働科学研究費補助金長寿・障害総合研究事業18DK0207026H0003、MEXT/JSPS科研費JP16H05324、JP18K07543、JP21K15705、CREST戦略的創造研究推進事業「記憶構造を解明する新しい光操作・画像法の開発」などの支援による研究成果である基盤技術を活用して実施された成果で、神経科学分野においてインパクトの大きい論文が数多く発表されている科学誌「Movement Disorders」のオンライン版に2022年8月29日(月)午前0時(日本時間)に掲載されます。
補足説明資料
【研究開発の背景と目的】
認知症は年齢が増すほど増加し、日本では2012年に約460万人が、高齢化が進む2040年には800万人以上が発症すると推計されています。根本的な治療法が開発されていないため、進行を止めることができず、ご本人だけでなく、介護者、ご家族、社会全体に身体的、心理的、社会的、経済的影響を及ぼします。
認知症の大半を占めるのは、脳の中に異常なタンパク質が蓄積する神経変性型の認知症で、これはアルツハイマー病、前頭側頭葉変性症、レビー小体型認知症の3大認知症からなります。前二者には、アミロイドβ(Aβ)9)やタウを主とする異常タンパク質が脳内に蓄積し、これらの異常タンパク質の蓄積に伴い神経細胞が死ぬことで、物忘れ、運動障害、精神症状などの多彩な症状が出現します。この異常タンパク質の蓄積を抑えることが根本的な治療に不可欠と考えられます。
認知症の症状は症例ごとに多様である一方、異なる疾患でも同様の症状を呈することがあるため、症状のみで早期診断することはできません。そのため、認知症の早期診断には、異常タンパク質の蓄積を可視化するイメージング技術が極めて効果的と言えます。こうした状況を踏まえ、我々は、アルツハイマー病や進行性核上性麻痺などの異常なタウ蓄積を高いコントラストで捉えることのできるPET薬剤である[18F]PM-PBB3 (一般名:florzolotau)を開発しました(2020年10月30日プレスリリースhttps://www.qst.go.jp/site/press/45206.html)。その一方で、PET画像から診断に役立つ情報を得るためには、熟練を要する読影技術や画像解析技術が必要でした。
そこでAIを用いることで読影と画像解析を自動化できれば、診断に役立つだけでなく、様々な研究機関や製薬企業によって開発が進められている、タウ病変を減らす新たな認知症の治療薬の薬効評価を自動化することも可能になると見込まれます。しかし、自動化には主に次の2つの課題がありました。
1)各認知症のタウPET画像上において、どの脳領域が診断に最も役立ち、疾患の重症度や治療効果の評価に有用であるのか、十分には明らかになっていない。
2)正確にタウPET画像を自動で評価する方法がない。
これらの課題を解決すべく、AIを用いて読影と画像解析を自動化し、PET画像の「アルツハイマー病らしさ」を表す「アルツハイマー病タウスコア」と「進行性核上性麻痺らしさ」を表す「進行性核上性麻痺タウスコア」をそれぞれ算出できるように、認知症の全自動診断に向けた基幹技術の開発を目指しました。
【研究の手法と成果】
タウPET画像を診断、あるいは治療効果の評価に用いるためには、疾患に特徴的なタウ蓄積パターン特定と、正確な定量が不可欠です。画像からPET薬剤の集積を定量化する際、現在の最も信頼できる基準は、関心領域10)を手動で定義して測定することですが、臨床試験における大規模なデータセットを解析するためには多大な労力を必要とします。また、一般的に用いられている定性的な評価(例えば画像の色が白い[PET薬剤の集積が高い]、黒い[PET薬剤の集積が低い]など判断)では、評価の恣意性や再現性に問題が残ります。そこで、コンピュータプログラムを用いた自動定量法が用いられるようになり、自動で全脳の関心領域を同定する方法も開発されています。
ヒトの脳は大きさや形状に個人差があります。このため、関心領域を自動で同定するためには、被検者の脳画像を標準脳に合わせて解析する必要があります。ところが、各被検者データをひとつの標準脳マップ(シングルアトラス)へ合わせて解析を行う場合(シングルアトラス法)には、個人差に加えて病気による脳萎縮もあり、将来的な臨床試験で求められる精度を維持して脳病態の客観的評価指標を確立することは難しい状況でした。そこで今回は、関心領域を自動で同定する方法として、あらかじめ脳画像の構造を正確に同定した複数人の個人脳マップ(マルチアトラス)を教師データとして用い、AIにより各被験者の脳画像の構造を自動で同定するマルチアトラス法11)をPET画像に適用し、臨床試験で求められる精度と解析の簡便性を担保しました。さらに、タウ蓄積パターンの評価においては、臨床診断に関連する重要な情報を抽出し、検証ステップを含むAIが必要となります。今回は、エラスティックネット線形分類解析12)という、AIの手法の一つを用いました。この手法は、多数の脳領域のタウPETの値から疾患を特定するために有効な領域を選択し、重要度の重み付けを行うだけでなく、診断に貢献度の低い領域については削減し、疾患ごとのタウ蓄積パターンを探し出すことができます。また、少数のタウPETデータセットであっても堅牢なパターン認識13)モデルを作成することができ、高い解釈性・説明性を実現することが可能となります。
本研究では、アルツハイマー型認知症患者(Aβ陽性の軽度認知機能障害患者含む)37名、進行性核上性麻痺患者46名、健常高齢者50名を対象に、 [18F]PM-PBB3というPET薬剤を投与して撮影した画像にマルチアトラス法を適用し、脳内114カ所の関心領域におけるPET薬剤集積値を解析しました。
そして、AIを用いてアルツハイマー型認知症と進行性核上性麻痺を区別するために最適化された線形関数14)を求め、解析で得られたPET薬剤集積値を線形結合15)することで、各被検者の「アルツハイマー病らしさ」を表す「アルツハイマー病タウスコア」と「進行性核上性麻痺らしさ」を表す「進行性核上性麻痺タウスコア」を算出しました(図1)。
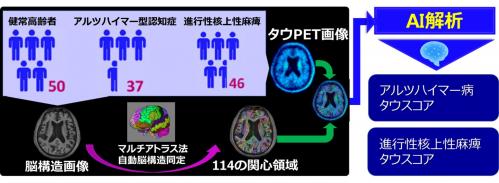
図1 本研究の方法概要
健常高齢者、アルツハイマー型認知症患者、進行性核上性麻痺患者において、高精度に同定した114の脳構造領域についてタウPET集積値を定量し、それらの値を有効な学習用データとして用いることで、疾患に特徴的な領域のタウPET集積値を個人ごとにタウスコアとして算出。
学習用データ 対 検証用のテストデータにランダムに10回分わけ、繰り返し検討して最適な線形モデル16)関数を作成し、テスト用データで評価した結果、アルツハイマー病タイプのタウスコアの疾患分類における正解率は98.6±0.02% (平均±標準偏差)、進行性核上性麻痺タイプのタウスコアの正解率は95.0±0.02% (平均±標準偏差)でした。
タウスコアの高いアルツハイマー型認知症患者と進行性核上性麻痺患者のそれぞれのタウ蓄積パターンを平均化してみると、図2のとおりとなります。前頭葉など一部に重なりがみられるところがあることがわかりますが(黄色矢頭)、タウスコアを決定するためのAIモデルにおいて、アルツハイマー病タイプでは扁桃体17)など内側側頭葉をはじめとする白矢頭で示した大脳領域で、進行性核上性麻痺タイプでは淡蒼球(緑矢頭)18)や中脳(オレンジ矢頭)19)などで示した深部脳領域でタウ蓄積が認められました。このことからアルツハイマー病タウスコアでは内側側頭葉などの大脳領域が、進行性核上性麻痺タウスコアでは深部脳領域が、それぞれ疾患分類に重要であることが確かめられました。
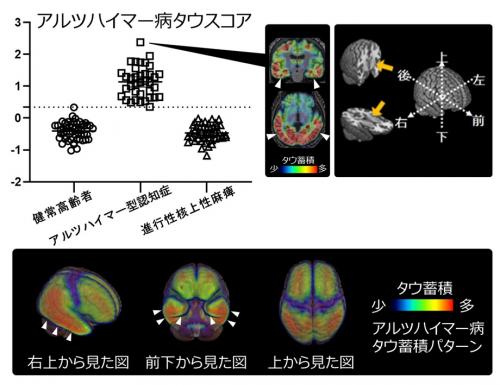
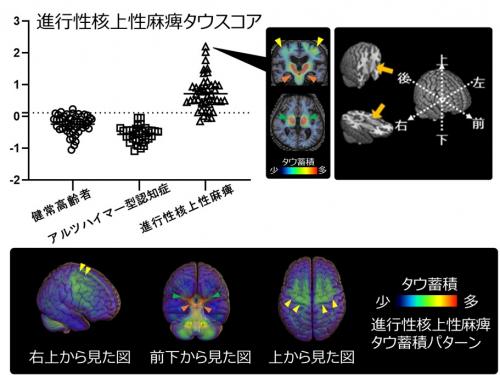
図2 タウオパチーのタイプごとのタウスコア
2つの異なる認知症におけるタウ病変を疾患スコアにするため、検証ステップ(学習データとテストデータに繰り返し分けて最適化する)を含むAIによる分類モデルを作成し、学習用データと検証用のテストデータに分ける前の全データに対して、作成した線形モデル関数を用いてアルツハイマー型認知症患者、進行性核上性麻痺患者において疾患に特徴的な領域のタウPET集積値から個人ごとにタウスコアとして算出(プロット図)。それぞれ上のアルツハイマー病タウスコアのプロット図では0.34(点線)を境にすると100%の正解率となり、下の進行性核上性麻痺タウスコアのプロット図では0.11(点線)を境にすると96%の正解率であった。タウスコアの高かった方のタウPET画像を平均化することで、生体内での全脳のアルツハイマー病タイプのタウ蓄積パターンと進行性核上性麻痺タイプのタウ蓄積パターンを可視化することが可能となった。白矢頭は側頭葉、黄矢頭は前頭葉の一部、緑矢頭は淡蒼球付近、オレンジ矢頭は中脳を示す。
次にそれぞれのタウスコアと臨床症状との関連をみたところ、アルツハイマー病患者と認知テストで失点があった健常高齢者のアルツハイマー病タウスコアが高いほど認知機能の障害が重度であり(図3)、進行性核上性麻痺患者の同タウスコアが高いほど運動障害が重度でした(図4)。
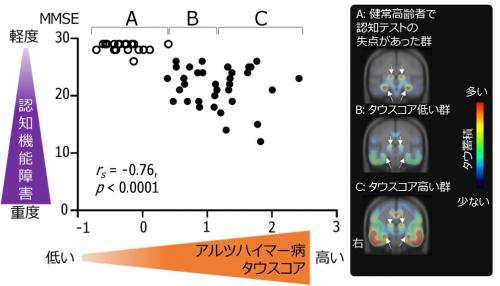
図3 タウスコアと認知機能の障害の関連
アルツハイマー型認知症患者(黒丸)と認知テストで失点があった健常高齢者(白丸)においてアルツハイマー病タイプのタウスコアが高いほど認知機能の障害が重度となり(左)、タウスコアで3群(A、 B、 C)にわけるとタウ蓄積する領域が大脳で広がっている(右)。縦軸のMMSE(ミニメンタルステート検査)は全般的な認知機能を評価する代表的な検査。rsはスピアマンの順位相関係数を示し、-1から1の間で0に近いほど相関がなくなり、-1や1に近づくほど相関が強いことを示す。(※白矢印は脈絡叢の非特異的集積)
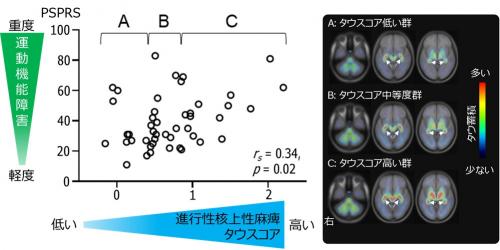
図4 脳内タウ蓄積と運動および認知機能の障害の関連
進行性核上性麻痺患者(白丸)において進行性核上性麻痺タイプのタウスコアが高いほど運動機能の障害が重度となり(左)、タウスコアで3群(A、 B、 C)にわけるとタウ蓄積する領域が深部脳領域で広がっている(右)。縦軸のPSPRS(進行性核上性麻痺評価尺度)は運動機能をはじめとして病気の重症度を測定するための尺度。rsはスピアマンの順位相関係数を示し、-1から1の間で0に近いほど相関がなくなり、-1や1に近づくほど相関が強いことを示す。本来病気を区別するためにAIで計算したタウスコアが病気の重症度と有意な相関を示したことから、タウ病変の重要性が病気の診断にも症状にも関連している可能性が示された。(※白矢印は脈絡叢の非特異的集積)
今回PET検査を行った症例とは異なる、すでに亡くなっている患者脳切片に対して、PM-PBB3の結合を検討すると、PET検査の結果と同様、淡蒼球や扁桃体には多量の脳内タウ蓄積を認め、PM-PBB3が結合していることが確認されました(図5)。
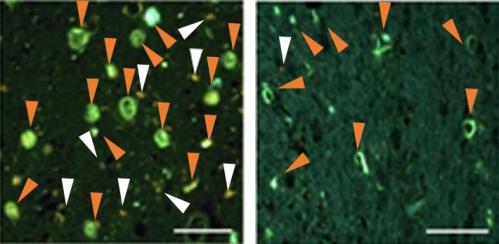
図5 死後脳におけるタウ蓄積とPM-PBB3集積
アルツハイマー病の扁桃体では脳内タウ蓄積が多数存在し、PM-PBB3が結合している(オレンジ矢頭)(左)。進行性核上性麻痺の淡蒼球でも脳内タウ蓄積が多数存在し、PM-PBB3が結合している(オレンジ矢頭)(右)。(※白矢頭は自家蛍光を示す)
【今後の展開】
本研究でそれぞれアルツハイマー病らしさと進行性核上性麻痺らしさのタウ蓄積の脳内分布を生体内で高性能に区別できるタウスコアをAIモデルで作成しました。熟練を要する読影や画像解析のスキルが再現され、認知症の全自動診断に向けた基幹技術がもたらされました。この基幹技術は、さらに症例数を増やすことでモデルを改良していくことが可能であり、他のタウ病理を特徴とする認知症の画像を組み込んで学習させることで、その病気らしさを区別するタウスコアを計算できることが期待されます。
現在、APRINOIA社との共同で米国、台湾、日本などにおいて[18F]PM-PBB3の診断薬としての承認を得るための第1相および第2相臨床試験が進められています。タウ病変に対する抗体を含む治療薬候補が世界各地で開発されているため、今後、ますます[18F]PM-PBB3の需要は高まるものと考えられ、さらに本研究によるAI解析技術を応用することにより、タウスコアによる診断が確実な方の治験へのリクルートのみならず、こうした治療薬の薬効評価を自動化することも可能になると見込まれます。
このプレスリリースは『Movement Disorders』のオンライン版に掲載される「Endo H、 et al. A machine learning-based approach to discrimination of tauopathies using [18F]PM-PBB3 PET images (邦題:機械学習に基づく[18F]PM-PBB3 PET画像を用いたタウオパチー分類の試み」に基づいて作成されています。
【用語解説】
1)アルツハイマー病/アルツハイマー型認知症
認知症の原因として最も患者数の多い病気です。脳内に異常タウタンパク質「タウ」病変やアミロイド病変が蓄積して、物忘れなどが目立つ進行性の認知機能障害が出現します。
2) タウ
神経系細胞の骨格を形成する微小管に結合するタンパク質です。細胞内の骨格形成と物質輸送に関与しています。アルツハイマー型認知症をはじめとする様々な精神神経疾患において、タウが異常にリン酸化して細胞内に蓄積することが知られており、これらタウ病変が脳内に蓄積する疾患をまとめてタウオパチーと呼びます。タウオパチーの診断にはタウ病変の分布と蓄積(タウ病理)を正確に定量することが求められています。
3)陽電子断層撮影(PET)
PETは、Positron Emission Tomographyの略称で、身体の中の生体分子の動きを外から見ることができる技術の一種です。特定の放射性同位元素で標識したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量などを三次元的に測定できます。
4)AI
人工知能(Artificial Intelligence)の略称で、人間のような知的作業をする機械を工学的に実現する科学や技術です。データから規則性や判断基準などの特徴を学習し、それに基づき未知のものを予測、判断する技術が機械学習法と言われ、本検討で使用したものになります。
5)進行性核上性麻痺
眼球運動障害、左右対称性の運動障害、前頭葉機能障害がみられます。転倒を繰り返すパーキンソン病類縁疾患。神経難病の一つで、発症の初期はパーキンソン病との区別が困難なこともありますが、パーキンソン病ではよく効く薬もほとんど効果を示さず症状進行も急速で、確立した治療法はありません。
6) スコア
得点、指標のことで、今回の場合はそれぞれ、アルツハイマー病らしさを示す指標、進行性核上性麻痺らしさを示す指標を示しており、高いほどその病気らしさが高くなります。
7) 前頭側頭葉変性症
大脳の前頭葉や側頭葉を中心に萎縮をきたす認知症・神経難病の総称で、進行性核上性麻痺をはじめとして、様々な神経難病・認知症がこれに含まれます。人格変化や感情障害、言語障害、運動障害などの多彩な症状を呈します。
8)レビー小体型認知症
物忘れのみならず、幻視、体の動きがぎこちなくなるなどのパーキンソン症状を伴う認知症です。
9) アミロイドβ(Aβ)
脳内で作られるタンパク質の一種で、アルツハイマー病患者の脳に多く沈着しており、アルツハイマー病の発症に大きく関わっていると考えられています。
10) 関心領域
一般には画像上でフィルターの適用や何らかの方法での操作の対象として選択する領域のことです。今回の場合は扁桃体15)など注目したい特定の脳構造を指します。
11) マルチアトラス法
複数人の脳の磁気共鳴画像(MRI)において脳の領域ごとに構造をあらかじめ決定した脳マップ(アトラス)の正解を示す教師となるデータとして、AIを用いて各被験者の脳MRIの脳構造を自動で同定する手法です。
12) エラスティックネット線形分類解析
AIモデルの課題である過学習(学習精度がある一定の精度まで向上すると、以降は未知のデータへの対応力を失ってしまう現象)を防止し、汎化性能(未知のデータへの対応能力)を高めるためのAI解析方法の一つです。モデルに「正則化項」という過学習対策の手法を組み合わせることでモデルの形が複雑になりすぎないように調整することができます。
13) パターン認識
パターン認識とは、画像や音声など膨大なデータから一定の特徴や規則性のパターンを識別して取り出す処理のことです。
14) 線形関数
ある1つの値が決まると、もう一つの値が決まる関係を関数といい、線形関数は、値を示す変数と変数の関係が直線的ということを意味します。
15)線形結合
線形代数の概念の一つで、ベクトル(大きさ、向きをもつ量)を定数倍して足し合わせたものです。
16)線形モデル
目的変数(因果関係の結果となる変数:今回の場合はアルツハイマー型認知症であるのかどうか、進行性核上性麻痺であるのかどうか)と説明変数(因果関係の原因となる変数:今回の場合は114の脳領域のタウPET値)の間にある線形の関係を説明する数理モデルです。
17)扁桃体
扁桃体は側頭葉の内側の構造であり、大脳辺縁系とよばれる情動に関連する回路の主要な構成要素の一つです。
18)淡蒼球
大脳基底核の主要な構成要素の一つで、運動機能や、動機付け、意欲、欲求が満たされる感覚に関与するとされます。
19)中脳
間脳と橋の間に位置する脳構造です。視覚や聴覚、眼球運動や体の運動制御などに関与する中枢があります。
【論文情報】
タイトル:
A machine learning-based approach to discrimination of tauopathies using [18F]PM-PBB3 PET images
著者:
Hironobu Endo1), M.D., Ph.D., Kenji Tagai1), M.D., Ph.D., Maiko Ono1), Ph.D., Yoko Ikoma1), Ph.D., Asaka Oyama1), M.S., Kiwamu Matsuoka1), M.D., Ph.D., Naomi Kokubo1), Ph.D., Kosei Hirata1), M.D., Ph.D., Yasunori Sano1), M.D., Masaki Oya1), M.D., Hideki Matsumoto1), 2), D.D.S., Shin Kurose1), M.D., Chie Seki1), Ph.D., Hiroshi Shimizu3), M.D., Ph.D., Akiyoshi Kakita3), M.D., Ph.D., Keisuke Takahata1), M.D., Ph.D., Hitoshi Shinotoh4), M.D., Ph.D., Hitoshi Shimada5), M.D., Ph.D., Takahiko Tokuda1), M.D., Ph.D., Kazunori Kawamura1), Ph.D., Ming-Rong Zhang1), Ph.D., Kenichi Oishi6), M.D., Ph.D., Susumu Mori6), Ph.D., Yuhei Takado1), M.D., Ph.D., Makoto Higuchi1), M.D., Ph.D.
所属:
1) Institute for Quantum Medical Science, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan
2) Department of Oral and Maxillofacial Radiology, Tokyo Dental College, Tokyo 101-0061, Japan
3) Department of Pathology, Brain Research Institute, Niigata University, Niigata 951-8585, Japan
4) Neurology Clinic Chiba, Chiba 260-0045, Japan
5) Department of Functional Neurology & Neurosurgery, Center for Integrated Human Brain Science, Brain Research Institute, Niigata University, Niigata 951-8585, Japan
6) The Russell H. Morgan Department of Radiology and Radiological Science, Johns Hopkins University School of Medicine
DOI:10.1002/mds.29173