2022-08-31 量子科学技術研究開発機構
発表のポイント
- 運動機能や自律神経機能に障害を引き起こす難病である多系統萎縮症1)において、原因と考えられるタンパク質「αシヌクレイン2)」病変を、生体脳で明瞭に画像化することに成功し、世界で初めて学術誌に報告。
- 産学共同体制「量子イメージング創薬アライアンス・脳とこころ3)」の下、製薬企業3社との同時連携によってαシヌクレイン病変を捉える放射性薬剤を開発し、陽電子断層撮影法(PET)4)による高感度の可視化を実現。
- αシヌクレイン病変はパーキンソン病5)やレビー小体型認知症6)でも中心的な病変となることから、本技術は多様な神経難病の発症機構解明や、診断治療に大きく寄与することが期待。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」という)量子生命・医学部門 量子医科学研究所 脳機能イメージング研究部 樋口真人部長、松岡究研究員は、エーザイ株式会社、小野薬品工業株式会社、武田薬品工業株式会社との共同研究において、運動機能や自律神経機能に障害を引き起こす難病である多系統萎縮症の生体脳で、病気の原因と考えられる異常タンパク質「αシヌクレイン」病変を明瞭に画像化することに成功し、世界に先駆けて学術誌に報告しました。
アルツハイマー病などに代表される難治性の脳の病気は神経変性疾患とも呼ばれ、様々な異常タンパク質が脳内に蓄積して症状を引き起こすと考えられています。αシヌクレイン病変は多系統萎縮症のみならず、神経変性疾患のなかでアルツハイマー病に次いで多いパーキンソン病やレビー小体型認知症においても、中心となる病変を形成することが知られています。しかしながら、αシヌクレイン病変を生体脳で可視化する技術はこれまで未確立で、患者が亡くなった後で病理検査により病変を調べない限り、確定診断は行えませんでした。
量研では、これまで異常タンパク質の蓄積を生体脳で可視化する技術の開発に取り組んできました。代表的な成果として、アルツハイマー病の原因となりうるタウタンパク質 7)の病変を世界に先駆けて画像化することに成功しました。こうした異常タンパク質病変の画像化に関するノウハウを活用し、量研が主宰する産学共同の研究開発体制「量子イメージング創薬アライアンス・脳とこころ」の部会において量研とエーザイ株式会社、小野薬品工業株式会社、武田薬品工業株式会社が連携し、タウ病変よりもさらに量が少なく画像化が難しいとされてきたαシヌクレイン病変の生体脳での検出に挑み、αシヌクレイン病変をPETで検出するための放射性薬剤として、18F-SPAL-T-068)を開発しました。この薬剤の臨床評価を行い、多系統萎縮症の病型に応じたαシヌクレイン病変の分布を、高いコントラストで画像化することに成功しました。さらに、多系統萎縮症患者由来の脳標本でも、18F-SPAL-T-06がαシヌクレイン病変に強く結合することを実証しました。
本技術は多系統萎縮症の診断技術の確立、ひいてはαシヌクレイン病変を標的とした根本的治療薬の開発に大きく貢献すると期待されます。さらにαシヌクレインの脳内蓄積を特徴とするパーキンソン病やレビー小体型認知症でも同様の有用性が見込めることから、これらの疾患の患者を対象とした臨床研究が進行中です。
本研究は、上述のアライアンス事業に加え、日本医療研究開発機構(AMED)による、革新的技術による脳機能ネットワークの全容解明プロジェクト「神経変性疾患のたんぱく凝集・伝播病態と回路傷害の分子イメージング研究」、精神・神経疾患メカニズム解明プロジェクト「シヌクレイノパチーを全身病として捉えた病態解明と疾患修飾療法の開発」、JSPS科研費18K07777、国立研究開発法人科学技術振興機構(JST)によるムーンショット型研究開発事業「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて(JPMJMS2024)」などの支援による研究成果である基盤技術を活用して実施された共同研究による成果で、神経科学分野においてインパクトの大きい論文が数多く発表されている科学誌「Movement Disorders」のオンライン版に2022年8月31日(水)午前1時(日本時間)に掲載されます。
補足説明資料
【研究開発の背景と目的】
多くの神経変性疾患では、様々な異常タンパク質の脳内蓄積により、神経細胞やグリア細胞9)が死に至り、運動症状、精神症状、認知機能低下などの症状を引き起こすことが知られています。これらの神経変性疾患のなかで、パーキンソン病はアルツハイマー病に次いで2番目に多い疾患であり、1000人に1~1.5人が罹患すると推定されています。パーキンソン病では、αシヌクレインという異常タンパク質が脳内に集積・沈着し、手足の震えや体のこわばりが出現します。また、多系統萎縮症においても、パーキンソン病と同様に、αシヌクレインが脳内に蓄積しますが、手足の震えや体のこわばり以外に、ふらつきや排尿障害などの様々な症状が出現します。
パーキンソン病や多系統萎縮症以外にも類似した症状が出現する疾患があるため、症状のみからでは診断が困難な場合があります。そのため、αシヌクレインをPETで可視化することができれば、αシヌクレイン病変の分布に基づいた診断が可能になると期待されます。また、これらの疾患において、αシヌクレインを対象とした根本的な治療薬の開発が試みられていますが、いまだに実用化に至っていません。αシヌクレイン病変の画像化によって治療薬の効果を検証することができれば、根本的な治療薬の開発につながると期待されます。しかし、αシヌクレインを生体脳で可視化する技術はいまだ確立していません。
量研では、これまで異常タンパク質の蓄積を可視化するイメージング技術の開発を行ってきました。2013年には放射線医学総合研究所(当時、現量研)において、アルツハイマー病の原因となるタウ病変の可視化を世界に先駆けて実現しました。同薬剤を用いたPET検査により、研究グループはこれまでにアルツハイマー病(2018年6月8日プレスリリース: https://www.qst.go.jp/site/press/1191.html)、特定地域で多発する認知症(2018年12月8日プレスリリース)、家族性の前頭側頭葉変性症(2019年2月18日プレスリリース:https://www.qst.go.jp/site/press/20699.html)などを対象に成果をあげてきました。さらに同技術を改良し、アルツハイマー病や前頭側頭葉変性症など多様な認知症で、タウ病変を高いコントラストで捉え、これらの疾患の診断・鑑別が早期から可能にすることを実証しました(2020年10月30日プレスリリース:https://www.qst.go.jp/site/press/45206.html)。
こうした異常タンパク質病変の画像化に関するノウハウを活用し、量研は、エーザイ株式会社、小野薬品工業株式会社、武田薬品工業株式会社との共同研究において、αシヌクレイン病変に対するPET薬剤の候補として、18F-SPAL-T-06を共同で開発しました。次いで多系統萎縮症患者において、αシヌクレイン画像診断薬としての18F-SPAL-T-06の有効性を検討しました。
【研究の手法と成果】
本研究では、多系統萎縮症患者3名(パーキンソン症状優位型2名、小脳失調症優位型1名)と健常高齢者1名を対象に、18F-SPAL-T-06 PET検査を行い、αシヌクレイン蓄積が認められる脳部位とその量を調べました。その結果、健常高齢者と比較して多系統萎縮症患者では脳深部の大脳基底核の一部である被殻に18F-SPAL-T-06の高集積を認めました。さらに、パーキンソン症状優位型2名中の1名や小脳失調症優位型の多系統萎縮症患者において、小脳を中心とした18F-SPAL-T-06の高集積を認めました(図1)。これは、過去の研究により報告されている、多系統萎縮症の病型に応じたαシヌクレイン病変の分布と一致する結果になります。
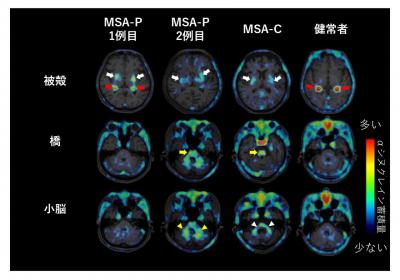
図1 多系統萎縮症患者と健常高齢者におけるαシヌクレイン蓄積画像の比較
白矢印は被殻の、黄矢印は橋の、黄三角は小脳白質の、白三角は中小脳脚のαシヌクレイン蓄積を示唆する18F-SPAL-T-06の集積を示す。
一方で、赤矢印は、αシヌクレイン蓄積とは無関係と考えられる、脳実質外の脈絡叢(脳室に存在する血管に富んだ組織)での18F-SPAL-T-06の集積を示す。
MSA-P:パーキンソン症状優位型多系統萎縮症、MSA-C:小脳失調症優位型多系統萎縮症。
さらに病状の進行により亡くなられた多系統萎縮症患者や健常高齢者の剖検で得られた脳標本を用い、脳標本のαシヌクレイン病変と脳内の18F-SPAL-T-06結合との関連を検討しました。これにより、PET検査で18F-SPAL-T-06の高集積がみられた被殻において、同薬剤がαシヌクレイン病変に強く結合することが確認され、18F-SPAL-T-06がαシヌクレイン病変を検出可能であることを実証しました(図2)。
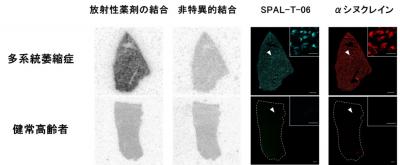
図2 多系統萎縮症患者と健常高齢者における死後脳を用いた検討
多系統萎縮症患者では、被殻における放射性薬剤18F-SPAL-T-06の結合が健常高齢者を大きく上回り、非特異的結合(非放射性薬剤で特異的結合を阻害して評価)は健常者と同程度であったことから、病変への薬剤の特異的結合が増加していることが証明された。
PET検査で18F-SPAL-T-06の高集積がみられた被殻において、αシヌクレインの蓄積が確認された。
【今後の展開】
本研究により、18F-SPAL-T-06が多系統萎縮症患者において、病型に応じたαシヌクレイン蓄積を高感度に可視化できることが示されました。本成果は、生体脳におけるαシヌクレインの可視化技術として、世界で初めての論文報告となります。本技術を通じて、多系統萎縮症における診断技術の確立、ひいてはαシヌクレイン病変を標的とした根本的治療薬の開発に大きく寄与すると期待されます。さらに、我々は脳内のαシヌクレイン蓄積を特徴とするパーキンソン病やレビー小体型認知症患者を対象とした、18F-SPAL-T-06の有効性の検討を行っています。
<量研 脳機能イメージング研究部 樋口部長のコメント>
αシヌクレインの病変がヒトの脳で画像化できたことは、多系統萎縮症の診断のみならず、パーキンソン病など他の疾患の診断・鑑別にもつながる重要な成果と考えています。特に今回は、研究機関と製薬企業3社が力を合わせてαシヌクレインのPET薬剤を開発し、臨床応用できたことが重要な意味を持っています。この産学連携は量研と製薬企業8社からなる量子イメージング創薬アライアンス・脳とこころの一環で、このアライアンスを通じて今後、本PET薬剤のみならず、脳疾患の治療薬剤開発に役立つ画像技術の開発を推進する予定です。
<ムーンショット型研究開発事業 高橋プロジェクトマネージャーのコメント>
本プロジェクトでは認知症を発症前に予測し、予防可能とすることを目指しています。
認知症の病因タンパクは発症の何年も前から脳内に蓄積することが知られているため、本研究で可能となった異常タンパク質の脳内蓄積画像化は、認知症の超早期病態を捉える上で大変重要な役割を担いうる技術です。特にαシヌクレイン病変のイメージングは、将来的にパーキンソン病関連認知症、レビー小体型認知症の病態解明や、アルツハイマー病における混合病理の役割解明につながる知見をもたらすと見込まれます。
以上より本研究成果は、本プロジェクトを通じた認知症発症前予測と予防につながる重要な研究であると考えています。
このプレスリリースは『Movement Disorders』のオンライン版に掲載される「Matsuoka K, et al. High-contrast imaging of α-synuclein pathologies in living patients with multiple system atrophy (邦題:多系統萎縮症に伴うαシヌクレイン病変の生体高感度イメージング)」に基づいて作成されています。
【用語解説】
1)多系統萎縮症
パーキンソン症状(運動障害など)、ふらつき、排尿障害などの様々な症状をきたす病気です。以前は別々に捉えられていた複数の病気が、現在では多系統萎縮症と総称される一つの病気として扱われています。30歳以降、多くは40歳以降に発症する方が多いと報告されています。
2)αシヌクレイン
パーキンソン病、レビー小体型認知症、多系統萎縮症などの患者において、脳内に蓄積することが知られています。脳内の神経細胞やグリア細胞の障害を引き起こすことにより、認知障害、運動障害などの様々な症状を発症します。
3) 量子イメージング創薬アライアンス・脳とこころ
量研が主宰する産学共同の研究開発体制で、精神神経疾患の治療薬開発において病態および薬効の物差しとなる画像バイオマーカーを、非臨床から臨床まで一気通貫で利用できる形で開発・活用することを主な目的としています。脳疾患創薬に関わる製薬企業8社(2022年7月時点)が会員として参入しています。
4)PET
Positron Emission Tomographyの略称。日本語では、陽電子断層撮影法と呼びます。身体の中の生体分子の動きを外から見ることができる技術の一種です。特定の放射性同位元素を結合したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体内の生体分子の局在や量などを測定できます。
5)パーキンソン病
50〜65歳に発症する方が多く、手足の震えや体のこわばりなどのパーキンソン症状が出現する病気です。1000人に1~1.5人が罹患すると推定され、加齢とともに発病率が増加すると報告されています。
6)レビー小体型認知症
アルツハイマー病に次いで多い神経変性型認知症で、物忘れのみならず、手足の震えや体のこわばりなどのパーキンソン症状や幻視を伴うことが特徴です。
7)タウタンパク質
細胞内の骨格形成や物質輸送に関与しているタンパク質の一種です。アルツハイマー型認知症をはじめとする様々な神経変性疾患において、タウが異常にリン酸化して脳内に蓄積することが知られています。量研は、脳内に蓄積したタウ病変に対して選択的に結合する薬剤を開発し、臨床応用を行ってきました。
8) 18F-SPAL-T-06
αシヌクレイン病変に強く結合する放射性薬剤で、18Fというラジオアイソトープで標識されています。この薬剤を静脈注射してPET検査を行うことにより、脳内のαシヌクレイン病変を画像化することが可能になります。(国際特許出願 PCT/JP2021/030899)
9) グリア細胞
神経系を構成する神経細胞以外の細胞の総称。
【論文情報】
タイトル:
High-contrast imaging of α-synuclein pathologies in living patients with multiple system atrophy
著者:
Kiwamu Matsuoka, M. D., Ph. D. 1, 2, Maiko Ono, Ph. D. 1, Yuhei Takado, M. D., Ph. D. 1, Kosei Hirata, M. D., Ph. D. 1, Hironobu Endo, M. D., Ph. D. 1, Toshiyuki Ohfusa, Ph. D. 3, Taichi Kojima, M. Sc. 4, Takeshi Yamamoto, Ph. D. 5, Tomohiro Onishi, Ph. D. 5, Asumi Orihara, M. D. 1, Kenji Tagai, M. D., Ph. D. 1, Keisuke Takahata, M. D., Ph. D. 1, Chie Seki, Ph. D. 1, Hitoshi Shinotoh, M. D., Ph. D. 1, 6, Kazunori Kawamura, Ph. D. 7, Hiroshi Shimizu, M. D., Ph. D. 8, Hitoshi Shimada, M. D., Ph. D. 1, 9, Akiyoshi Kakita, M. D., Ph. D. 8, Ming-Rong Zhang, Ph. D. 7, Tetsuya Suhara, M. D., Ph. D. 1, Makoto Higuchi, M. D., Ph. D 1.
所属:
1. Department of Functional Brain Imaging, Institute for Quantum Medical Science, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba, Japan
2. Department of Psychiatry, Nara Medical University, Nara, Japan
3. Neurology Tsukuba Research Department, Discovery, Medicine Creation, Neurology Business Group, Eisai Co., Ltd., Ibaraki, Japan
4. Translational Research Laboratories, Ono Pharmaceutical Co. Ltd., Osaka, Japan
5. Neuroscience Drug Discovery Unit, Research, Takeda Pharmaceutical Company Limited, Kanagawa, Japan
6. Neurology Clinic, Chiba, Chiba, Japan
7. Department of Advanced Nuclear Medicine Sciences, Institute for Quantum Medical Science, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba, Japan
8. Department of Pathology, Brain Research Institute, Niigata University, Niigata, Japan
9. Center for integrated human brain science, Brain Research Institute, Niigata University, Niigata, Japan