2018-07-24 理化学研究所
理化学研究所(理研)生命医科学研究センター粘膜免疫研究チームの鈴木敬一朗上級研究員、シドニア・ファガラサンチームリーダーらの国際共同研究グループ※は、免疫グロブリンA(IgA)[1]が腸内細菌叢[2]を制御するための新たなメカニズムを明らかにしました。 本研究成果は、今後、炎症性腸疾患[3]に対する新たな予防法・治療法の開発に貢献すると期待できます。
IgAは腸管内に分泌され、病原菌の排除や毒素の中和に関わる重要な抗体です。しかし、どのようなメカニズムで腸内常在菌を制御するのかは分かっていませんでした。今回、国際共同研究グループは、卵白オボアルブミン(OVA)を認識する単クローンIgA(7-6IgA)[4]が、ヒトの主要な腸内細菌であるBacteroides thetaiotaomicron(B.theta)と糖鎖[5]を介して結合することを見いだしました。また、7-6IgAは大腸粘液の中でB.thetaの機能未知遺伝子の発現を誘導することも分かり、本研究においてこの遺伝子由来のタンパク質を「粘液関連機能因子(Mucus-Associated Functional Factor;MAFF)」と名付けて詳しく解析しました。その結果、B.thetaはMAFFの働きを介して、Firmicutes門[6]に属する他の細菌種と相互作用し、腸内細菌叢全体の構成や代謝機能を変化させることが分かりました。さらに、マウスを用いた実験によって、MAFFが炎症性腸疾患の発症を予防する機能を持つことが明らかになりました。
本研究は、米国の科学雑誌『Journal of Experimental Medicine』(8月6日号)の掲載に先立ち、オンライン版(7月24日付け:日本時間7月24日)に掲載されます。
※国際共同研究グループ
理化学研究所 生命医科学研究センター
粘膜免疫研究チーム
基礎科学特別研究員 アレクシス・ボーゲルザング(Alexis Vogelzang)
リサーチアソシエイト 丸谷 美香子(まるや みかこ)
研究員 宮島 倫生(みやじまみちお)
チームリーダー シドニア・ファガラサン(Sidonia Fagarasan)
上級研究員 鈴木 敬一朗(すずき けいいちろう)
京都大学大学院医学研究科
AKプロジェクト
特定研究員 中島 啓(なかじま あきら)
テクニカルスタッフ 村田 めぐみ(むらた めぐみ)
テクニカルスタッフ 孫 安生(そん あおい)
特定准教授 鈴木 敬一朗(すずき けいいちろう)
創薬医学講座
特定教授 鶴山 竜昭(つるやま たつあき)
消化器内科学講座
大学院生 山田 聡(やまだ さとし)
助教 松浦 稔(まつうら みのる)
香川大学 医学部 分子微生物学
教授 桑原 知巳(くわはら ともみ)
札幌医科大学 医学部 消化器内科学講座
教授仲瀬裕志(なかせひろし)
ジョンホプキンス大学 医学校 病理学部
助教授ダニエル・ピーターソン(Daniel A. Peterson)
※研究支援
本研究は、京都大学「次世代免疫制御を目指す創薬医学融合拠点(拠点執行責任者:成宮周)」による支援を受けて行われました。
背景
私たちの体内に1,000種類以上存在する腸内細菌は、粘膜バリアーの構築、免疫組織の成熟、全身の代謝調節などに必須の役割を担っています。腸管内に多量に分泌される免疫グロブリンA(IgA)抗体は、腸内細菌の構成や分布の調節に重要な役割を果たすことが知られています。しかし、IgAがどのようなメカニズムで腸内細菌の調節に関わっているのかは分かっていませんでした。
これまでの研究により、IgAは腸内で常在細菌の表面をコートしていることが知られています。また、このコーティングには、通常の抗体-病原菌の結合様式とは異なり、糖鎖を介する場合があることが指摘されています。そこで、国際共同研究チームは細菌成分を認識しない単クローンIgA(7-6IgA)を作製し、強い糖鎖修飾を受けたIgAと細菌間の相互作用を詳しく解析しました。
研究手法と成果
国際共同研究グループはまず、卵白オボアルブミン(OVA)タンパク質と特異的に反応するIgAをマウスの腸管に誘導し、その腸管免疫細胞を用いたハイブリドーマ[4](腫瘍細胞の一種)を作製することによって、細菌成分を認識しない単クローンIgA(7-6IgA)を精製しました。7-6IgAは強い糖鎖修飾を受けており、OVAで抗原結合部位[7]を飽和した後でも、さまざまな培養細菌の表面に結合できることが分かりました。なかでも、ヒトの主要な腸内細菌であるBacteroides thetaiotaomicron(B.theta)の表面には、特に強く結合しました(図1A)。
次に、7-6IgAを産生するハイブリドーマ細胞を免疫不全マウスの皮下に注射して、7-6IgAだけを腸管IgAとして持つマウスを作製し、B.thetaとの相互作用について腸内細菌の遺伝子発現解析を行いました。その結果、7-6IgAの働きによって粘液や食物に含まれる多糖類の分解[8]に関わるB.thetaの遺伝子発現が変化していることが分かりました(図1B)。これらの中で、大腸粘液中で発現が上昇(図1C)している機能未知のオペロン[9]に注目し、それらがコードするタンパク質を暫定的に「粘液関連機能因子(Mucus-Associated Functional Factor;MAFF)と命名し、さらに詳しく調べました。
続いて、MAFFオペロンを欠損したB.theta株を作製し、通常マウスの腸管内に定着させると、野生型のB.thetaはMAFF欠損株よりも著しく大きな形態を示すことが観察されました(図2A上段)。しかし、無菌マウスにB.thetaを1種類だけ定着させたときには、そのような違いは見られませんでした(図2A下段)。これは、MAFFが機能を発揮するためには他の細菌種が必要であるということを示しています。
また、無菌マウスにB.thetaと同時にさまざまな細菌を定着させて、B.thetaの遺伝子発現を解析したところ、他の細菌種(特に大腸細菌叢)が存在するときだけ、大腸粘液内でMAFFオペロンの発現が誘導されることが分かりました(図2B)。
さらに、MAFFが他の腸内細菌の遺伝子発現に及ぼす影響を解析したところ、Firmicutes門に属する細菌において、短鎖脂肪酸[10]の生成を中心とした代謝活性がMAFFの働きによって調節されていることが分かりました。また、Firmicutes門に属する細菌種の増殖も誘導され、腸内細菌叢の構成がMAFFの働きによって大きく変化しました(図3A)。MAFFはIgAによって誘導されますが、7-6IgAの働きによっても同様の腸内細菌叢の変化が認められました(図3B)。
これらの腸内細菌の変化が炎症性腸疾患に影響を与えるのかを調べるために、DSS腸炎モデル[11]を誘導しました。B.thetaを定着させなかったマウスとMAFFオペロンを欠損したB.theta株を定着させたマウスでは激しい腸炎を発症しましたが、野生型のB.thetaを定着させたマウスでは腸炎発症に強い抵抗性を示しました(図3C、D)。これは、MAFFの働きによって炎症性腸疾患の発症が予防されたことを示しています。
以上の結果は、IgAが大腸粘液内でB.thetaにおけるMAFFオペロンの発現を誘導し、Firmicutes門に属する他の細菌種との相互作用を促進することによって、腸内細菌全体の代謝機能と構成を調節していることを示しています(図4)。
今後の期待
本研究では、これまで知られていなかったIgAの働きが存在することを明らかにしました。この過程には、腸内細菌の粘液内への局在に加えて異なる細菌種との相互作用が関与しており、未解明の疑問点が多く残されています。例えば、MAFFがどのような分子を認識して細菌間の相互作用を発揮するのかは、今後の研究で解明すべき重要な項目です。これらの研究を積み重ねることによって、今後、炎症性腸疾患の新たな予防法・治療法の開発に資することが期待できます。
原論文情報
Akira Nakajima, Alexis Vogelzang, Mikako Maruya, Michio Miyajima, Megumi Murata, Aoi Son, Tomomi Kuwahara, Tatsuaki Tsuruyama, Satoshi Yamada, Minoru Matsuura, Hiroshi Nakase, Daniel A. Peterson, Sidonia Fagarasan & Keiichiro Suzuki, “IgA regulates the composition and metabolic function of gut microbiota by promoting symbiosis between bacteria”, Journal of Experimental Medicine, 10.1084/jem.2018042
発表者
理化学研究所
生命医科学研究センター 粘膜免疫研究チーム
上級研究員 鈴木 敬一朗(すずき けいいちろう)
チームリーダー シドニア・ ファガラサン(Sidonia Fagarasan)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 免疫グロブリンA(IgA)
- 抗体と呼ばれる免液グロブリンの一種。IgM、IgD、IgG、IgE、IgAの五つのサブクラスに分類される。腸管を含む粘膜表面上にはIgAが分泌され、体内で最も多量に産生される抗体である。
-
- 腸内細菌叢
- 腸管内に定着している細菌群の総称。ヒトでは1,000種類100兆個以上存在し、その多くは食物の消化を助けるなど、宿主との共生関係にある。健康な状態では病原性はなく、常在菌と呼ばれる。
-
- 炎症性腸疾患
- 小腸や大腸に炎症を生じる疾患。特にクローン病と潰瘍性大腸炎の2疾患を指し、免疫機能の異常によって炎症が引き起こされる。現在、病因解明に向けてさまざまな方向から研究が進められている。
-
- 単クローンIgA、ハイブリドーマ
- 免疫系は体外から侵入する多様な抗原にそれぞれ反応して、多様な免疫グロブリンを産生する。この中から一種類の免疫グロブリンを選択、精製したものを単クローン抗体と呼ぶ。本研究では、特殊な処置を施したマウス腸管の免疫細胞を骨髄腫細胞と融合させた。このような腫瘍細胞をハイブリドーマと呼び、培養皿中で多量の抗体を得ることができる。本研究では、多くのハイブリドーマの中で卵白オボアルブミン(OVA)を特異的に認識するIgA分泌細胞を抽出して単クローンのIgAを作製し、これを7-6IgAと名付けた。
-
- 糖鎖
- 糖鎖は、グルコース(ブドウ糖)などの糖が鎖状につながった物質。遊離の状態で存在するものや、タンパク質や脂質に結合した状態のものがある。免疫グロブリンタンパク質は糖鎖による修飾を受けている。特にIgAは強い糖鎖修飾を受けていることが知られているが、これらの糖鎖が何をしているのかは不明である。
-
- Firmicutes門
- 細菌分類学上の一形態。「門」は上流での細菌分類に用いられる用語で、大部分の腸内細菌はBacteroidetes門かFirmicutes門のいずれかに属する。
-
- 抗原結合部位
- 免疫グロブリンが抗原を認識する部分。多くの場合、単一のタンパク質やペプチドなどと特異的に結合する。
-
- 多糖類の分解
- ヒトは多糖類を分解する酵素を持たないので、でんぷんや食物繊維などに含まれる多糖類を吸収できない。腸内細菌がこれらの多糖類を分解することによって、宿主に吸収、利用されている。
-
- オペロン
- 細菌のゲノム上に存在し、一つの機能を持つ遺伝子群の単位。MAFFにおいては、maffCとmaffDの2つの遺伝子が一つのオペロンを形成することが、データベース上の解析で予測されている。
-
- 短鎖脂肪酸
- 腸内細菌の代謝作用によって産生される脂肪酸の一種。大腸上皮のエネルギー源などとして利用され、炎症性腸疾患に対して防護的に作用することなどが知られている。
-
- DSS腸炎モデル
- デキストラン硫酸ナトリウム(Dextran Sodium Sulfate;DSS)を含む飲料水をマウスに投与することによって誘導される腸炎モデル。上皮細胞を直接障害することによって腸炎を誘導する。

図1 7-6IgAのB.thetaへの結合と腸内におけるB.theta遺伝子発現への効果
A : B.thetaの菌体を精製7-6IgAと培養し、表面がIgAでコートされたB.thetaをフローサイトメトリーにより検出した。この実験では69%のB.thetaが7-6IgAと結合していることが分かる。横軸のSSCは側方散乱光と呼ばれ、細胞の内部構造などを反映する。本図では細菌集団の範囲を表している。
B : 抗体を持たない免疫不全マウス(Rag1欠損マウス)の皮下に、7-6IgAを産生するハイブリドーマを接種し、同時にB.thetaを腸管内に定着させた。盲腸内細菌に対するRNAシークエンスを行い、B.theta遺伝子の中で有意差のあるものを抽出した。矢印が本研究で注目したMAFFに対応する。MAFFはmaffCとmaffDの二つの遺伝子からなるオペロンである。
C : 通常マウスにB.thetaを定着させ、大腸内容物と大腸粘液を分けて採取。B.thetaにおけるmaffC遺伝子の発現量を定量PCRにより解析した。maffC遺伝子が大腸粘液中で強く発現していることが分かる。

図2 腸管内におけるB.theta MAFFの働き
A : 抗生物質処理を行った通常マウス(上段)あるいは無菌マウス(下段)に、野生型あるいはMAFF欠損B.theta株を定着させた。内容物を含む大腸組織切片において、B.thetaを検出するプローブを用いたFluorescent in situ hybridization(FISH)を行い、B.thetaを可視化した(赤色)。通常マウスの野生型B.thetaはMAFF欠損B.thetaよりも著しく大きかったが、無菌マウスでは違いは見られなかった。スケールバーは2μm(1μmは1,000分の1mm)。
B : 無菌マウスに、B.thetaと他の細菌を混合して定着させて、maffC遺伝子の発現を定量PCRで測定した。B.theta単独(一番左)ではmaffC遺伝子の発現は低く、他の細菌種(特にマウス大腸細菌叢)と同時に定着させた場合(一番右:赤枠)に、maffC遺伝子の発現が粘液内で誘導されていることが分かる。

図3 IgA-MAFFを介した腸内細菌叢と大腸恒常性の制御
A : 通常マウスを抗生物質処理した後に、野生型あるいはMAFF欠損B.thetaを定着させ、4週間後に腸内細菌の構成を16SrRNAの遺伝子配列を用いて解析した。横軸には各マウスから採取した個別の検体データが並べられている。野生型定着群では16匹、MAFF欠損B.theta株定着群では21匹のマウスから検体を収集した。MAFFの働きを介してClostridiales(Firmicutes門)に属する細菌(赤)が増殖したことが分かる。
B : 図1Bと同様に、免疫不全マウスに7-6IgA産生ハイブリドーマを接種した。7-6IgAの存在下でClostridialesに属する細菌(赤+黄)が増殖したことが分かる。
C : 図3Aと同様に、抗生物質処理をしたマウスにB.thetaを定着させてDSS腸炎を誘導した。生存曲線を示す。野性型B.thetaを定着させたマウスは生存したが、MAFF欠損B.thetaを定着させたマウス、あるいはB.thetaを定着させなかったマウスは生存率がだんだん低下していった。
D : DSS腸炎誘導10日後の大腸組織に対して、顕微鏡下で大腸炎症の程度をスコア化した。スコアが高いほど腸炎の程度が強いことを表している。MAFFの働きを介して、腸炎誘導が防御されていることが分かる。
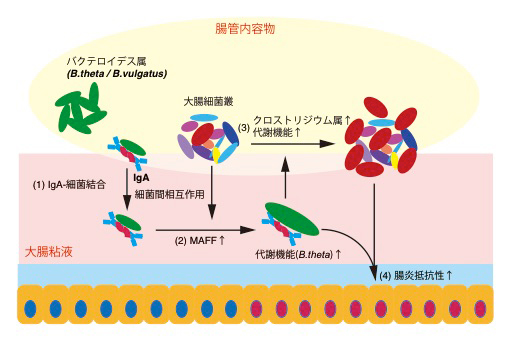
図4 大腸におけるIgA-MAFFを介した腸内細菌叢維持のメカニズム
(1)強い糖鎖修飾を受けたIgAは、通常の抗原結合部位を介さずに細菌表面に結合する。
(2)IgAの働きによってBacteroidetes門に属する細菌では大腸粘液内においてMAFFの発現が上昇する。
(3)この過程には他の細菌種との相互作用が必要である。MAFFを介した作用によってB.thetaの代謝機能が変化し、引き続いてクロストリジウム属(Firmicutes門)細菌の代謝機能促進と腸管内での増殖が誘導される。
(4)腸内細菌叢全体の代謝機能の変化によって腸炎抵抗性が獲得される。