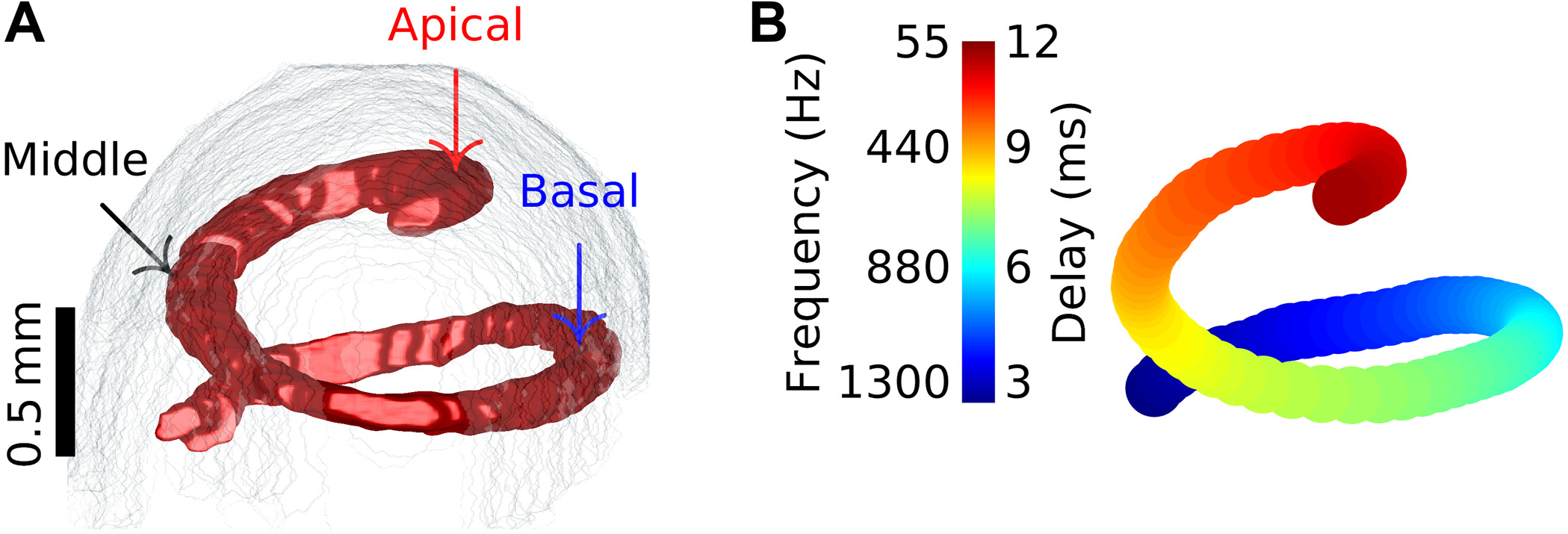
2022-09-24 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫細胞治療研究チームの藤井眞一郎チームリーダー(科技ハブ産連本部創薬・医療技術基盤プログラム副プログラムディレクター)、清水佳奈子上級研究員らの共同研究チームは、「人工アジュバントベクター細胞(aAVC:エーベック)」[1]の投与により、再発または治療抵抗性の急性骨髄性白血病[2]患者に対して自然免疫、獲得免疫、記憶免疫[3]を誘導できることを示しました。
本研究成果は、がんの治療、再発予防、転移抑制などの新しい免疫療法として貢献すると期待できます。
今回、共同研究チームは、免疫力が低下しているがん患者に対して樹状細胞[4]の力を利用して治療するaAVCに、がん抗原(がん細胞に特異的に発現するタンパク質)WT1[5]を発現させた「aAVC-WT1」の作製に成功しました。aAVC-WT1を用いた急性骨髄性白血病患者に対する医師主導治験[6]を2017年より開始し、第一相試験[6]を終了しました。試験の結果、治験に参加した患者のほぼ全員において自然免疫が活性化され、約半分の患者で腫瘍量(白血病細胞)が50%以上も減少しました。治験での効果を示した複数の患者では、aAVC-WT1投与2週間後に獲得免疫であるキラーT細胞[7]が増加しました。増加したキラーT細胞が複数のWT1エピトープ(抗原決定基)[8]に反応したことから、樹状細胞特有のクロスプレゼンテーション[9]が起きたことが分かりました。このようなキラーT細胞は記憶キラーT細胞[7]として維持されることも確認し、進行した白血病患者において長期記憶キラーT細胞を誘導できることを世界で初めて示しました。
本研究は、科学雑誌『Molecular Therapy-Oncolytics』オンライン版(9月23日付:日本時間9月24日)に掲載されました。
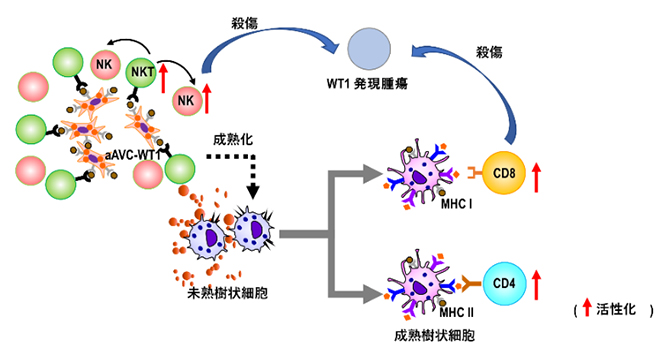
aAVC-WT1による免疫サイクル活性化のメカニズム
背景
生体防御を担う免疫系には、先天的な免疫システムでさまざまな種類の抗原を対象に初期防衛を担う「自然免疫」と、抗体や多様な細胞性免疫応答によって特定の異物を認識し排除する「獲得免疫」があり、両者が協調して働いています。
自然免疫には、異常な細胞を殺傷するナチュラルキラー細胞(NK細胞)[10]とナチュラルキラーT細胞(NKT細胞)[10]、病原体や死んだ細胞を貧食するマクロファージと好中球、樹状細胞などが関わっています。獲得免疫には、T細胞と抗体を産生するB細胞といったリンパ球が関与しています。T細胞には、細胞傷害活性の高いキラーT細胞と、B細胞やキラーT細胞の分化・増殖・機能を補助するヘルパーT細胞があります。獲得免疫の一部の細胞は「記憶免疫」という機能を持ち、再び同じ異物が侵入したら、素早く攻撃を開始できるようになっています。また、樹状細胞は体内に侵入した抗原を取り込んでその情報をT細胞へ提示し、T細胞は提示された抗原を認識してそれらを排除します。つまり、樹状細胞は自然免疫と獲得免疫の両方を連結させる”司令塔”としての役割を担っています。
がん細胞は、その種類により自然免疫と獲得免疫に対する感受性が異なっています。そのため、がん細胞を完全に排除するには、自然免疫と獲得免疫の両者の活性化が必要となります。
藤井チームリーダーらは、NKT細胞だけを活性化するリガンドの一つである糖脂質のα-GalCer(アルファ-ガラクトシルセラミド)[11]を用いて、自然免疫と獲得免疫の活性化の連鎖について研究してきました。NKT細胞はα-GalCerの刺激を受けて活性化されると、生体内に存在する樹状細胞を成熟化させ、成熟樹状細胞がT細胞を誘導します。この現象を利用して、自然免疫と獲得免疫の二つの免疫システムを同時に誘導できるように、がん抗原(がん細胞に特異的に発現するタンパク質)とα-GalCerを同時に発現させた「人工アジュバントベクター細胞(aAVC:エーベック)」を開発しました。アジュバントは”免疫反応を増幅させる”こと、ベクターは”運び屋”を意味します。
aAVCは、藤井チームリーダーらが独自に開発したワクチンプラットフォームで、HLAの型を問わず抗原の入れ替えが可能であり、がん抗原の入れ替えだけで多様ながんに対応できます。これまでの基礎研究として巨大腫瘍の担がん治療モデルに対しても抗腫瘍効果が認められ、抗原特異的なキラーT細胞の腫瘍内集簇(しゅうぞく)を確認しました注1)。さらに、aAVCは1回の投与で自然免疫および獲得免疫だけでなく、CD4陽性T細胞[12]およびCD8陽性T細胞[12]の記憶免疫を1年以上も誘導することも検証しました注2-3)。しかし、aAVCをヒトに投与して、自然免疫から記憶免疫までを誘導できるかどうか、また、その臨床効果はまだ検証されていませんでした。特に、T細胞の機能と長期維持の関係性は評価が難しいため、記憶免疫の誘導期間の検証や、ヒトにおける記憶T細胞と臨床との相関の解明はほとんど進んでいませんでした。
注1)2016年7月1日プレスリリース「がん免疫の課題を克服する治療モデルを構築」
注2)Shimizu K, Yamasaki S, Shinga J, Sato Y, Watanabe T, Ohara O, Kuzushima K, Yagita H, Komuro Y, Asakura M, and Fujii S. Systemic DC activation modulates the tumor microenvironment and shapes the long-lived tumor-specific memory mediated by CD8+ T cells. Cancer Res. 2016, 76:3756-66.
注3)Shimizu K, Mizuno T, Shinga J, Asakura M, Kakimi K, Ishii Y, Masuda K, Maeda T, Sugahara H, Sato Y, Matsushita H, Nishida K, Hanada KI, Dörrie J, Schaft N, Bickham K, Koike H, Ando T, Nagai R, Fujii S. Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Res. 2013, 73:62-73.
研究手法と成果
がん抗原とCD1d[13]というタンパク質を発現させた、ベクターとなる他家細胞(患者以外の細胞)に、NKT細胞のリガンドであるα-GalCerを提示させると、細胞表面にCD1dとα-GalCerの複合体ができ、aAVCが完成します(図1)。aAVCは、細胞製剤にもかかわらずベースとしている細胞が他家細胞のため、通常の医薬品のようにあらかじめ製造・保存しておくことが可能です。また、がん抗原の部分は置き換え可能であるため、がん抗原の種類を変えてさまざまながんの治療への使用が期待できます。共同研究チームは、これまでaAVCの効果を卵白アルブミン(OVA)抗原、皮膚がんの抗原TRP2およびMART-1、ウイルス抗原のHA(ヘマグルチニン)などを使って調べてきました。今回は、急性骨髄性白血病などさまざまながんに発現するWT1という抗原を用いた「aAVC-WT1」を細胞培養加工施設(CPC)内で作製しました。
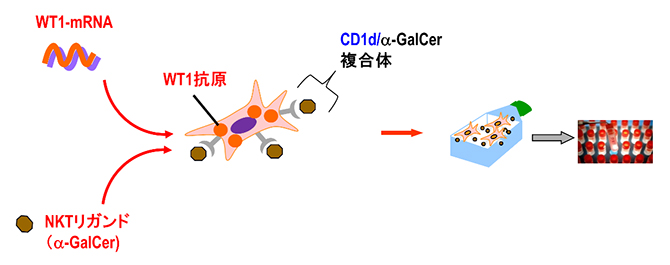
図1 aAVC-WT1細胞の製造
他家細胞にCD1dとWT1抗原をそれぞれコードするmRNAを遺伝子導入する。さらに、NKT細胞リガンド(α-GalCer)を細胞上のCD1d分子に提示させる。最終的に細胞表面上にCD1d/α-GalCer複合体ができ、細胞内にWT1抗原が発現したaAVC-WT1が完成する。
そして、aAVC-WT1を用いた医師主導治験第一相試験を2017年より開始し、2020年に終了しました。開始するにあたって、2011~2017年にわたり計17回の医薬品医療機器総合機構(PMDA)との薬事戦略相談を行いました。この治験はもちろん「first-in-human」と呼ばれる、世界で初めてヒト生体にaAVCを投与する試験です。目的は安全性を確認し、最大耐用量を決めることであり、主要評価項目は安全性、副次的評価項目は免疫応答、臨床応答です。
対象は、60歳以上の再発または治療抵抗性の急性骨髄性白血病の患者9名です。患者には、化学療法を2週間以上中止して化学療法の影響を排除した上で、aAVC-WT1を1カ月間隔で2回、静脈内に投与しました。投与したaAVC-WT1細胞量は、患者によって低用量(1回当たり100万細胞)、中用量(1回当たり1,000万細胞)、高用量(1回当たり10,000万細胞)の3種類としました。高用量においてもaAVC-WT1に関連する重篤な有害事象は認められなかったので、最大耐用量は1回当たり10,000万細胞となりました。
まず、自然免疫を調べるために、投与前および投与後においてそれぞれ経時的に免疫応答を解析しました。効果の指標として、NKT細胞およびNK細胞の数、NKT細胞とNK細胞から分泌されるサイトカイン[14]の一種であるインターフェロンガンマ(IFN-γ)[14]のELISPOT法[15]による定量、単離したNK細胞からのIFN-γの発現量の三つを評価しました。
解析の結果、1回目投与後と2回目投与後の少なくとも一方で、NKT細胞数またはNK細胞数が増加しました(図2左上)。機能的評価として、IFN-γの産生細胞が1回目投与後と2回目投与後の少なくとも一方で増加しました(図2右上)。さらに、末梢血と腫瘍部位(骨髄)の中のNK細胞を単離し、IFN-γの発現をqPCR法(定量PCR法)[16]で測定しました。図2に示す症例では、末梢血では1回目投与後7日目から14日目の間に、骨髄では半年から1年の間にIFN-γの発現が認められました(図2下)。このように自然免疫については、今回治験に参加した全ての患者において、NKT細胞あるいはNK細胞の増殖、かつIFN-γ産生のいずれか、あるいはそれら全てを確認することができました。
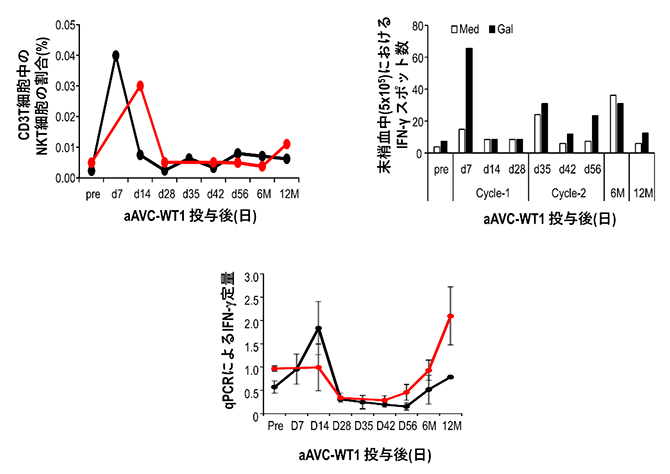
図2 aAVC-WT1治療による自然免疫の活性化
(左上) 急性骨髄性白血病患者にaAVC-WT1を投与すると、NKT細胞が末梢血(黒線)および腫瘍部位である骨髄(赤線)で増加した。
(右上) IFN-γ産生をELISPOT法で検証すると、1回目および2回目の投与後にIFN-γが産生された。ここで、Medはα-GalCerによる再刺激無し、Galは再刺激有りを示す。
(下) NK細胞のみを単離してIFN-γ発現量を実測した。末梢血(黒線)、骨髄(赤線)でのNK細胞からIFN-γ産生が認められた。
次に、がんの腫瘍量(白血病細胞数)の変化を調べました。すると、治験に参加した9名の患者(低用量・中用量・高用量各3名)のうち白血病細胞数が15%以上減少した人が6名、50%以上減少した人が5名(中用量と高用量)、完全寛解(正常な機能が回復した状態)に一度でも入った人が3名(中用量と高用量)でした(図3)。これらのデータは症例数が少ないため、まだ治療薬としての最終評価には至りませんが、これまで報告されている再発または治療抵抗性の急性骨髄性白血病患者と今回治験に参加した患者の生存期間の中央値を比較したところ、従来の4.5カ月に対して、本治験では12.1カ月という結果になりました。
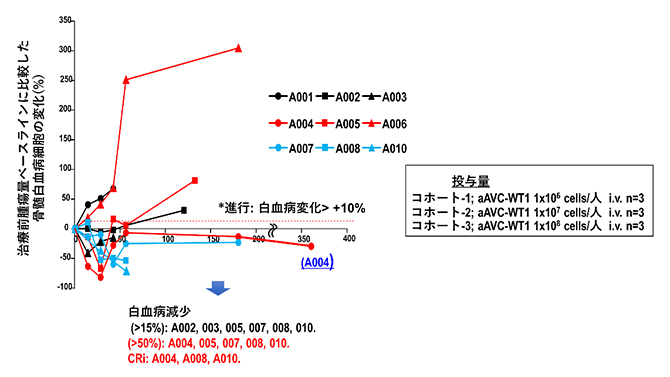
図3 白血病細胞数の変化
aAVC-WT1の1回目投与後に腫瘍量を測定した。2回の投与が完遂した低用量(黒:A001、A002、A003)、中用量(赤:A004、A005、A006)、高用量(水色:A007、A008、A010)の9名において、1回目投与前に対しての腫瘍量の減少を検討すると15%以上腫瘍の減少が6名、50%以上の減少が5名、一度でも完全寛解(CRi)に入った方が3名認められた。
さらに、獲得免疫と記憶免疫を調べるために、臨床効果の得られた患者4人に対して、末梢血および骨髄における白血病細胞に対するT細胞機能を評価しました。WT1テトラマー(四量体)を用いて、WT1に反応するキラーT細胞(CD8陽性T細胞)の数を調べた結果、aAVC-WT1投与前に比べて末梢血では2週間後に大きく増加し、骨髄でもわずかに増加しました(図4)。以降、時間とともにキラーT細胞の数は徐々に減少するものの、12カ月経過後も残存したことから、記憶キラーT細胞が長期間存在する可能性が示されました。
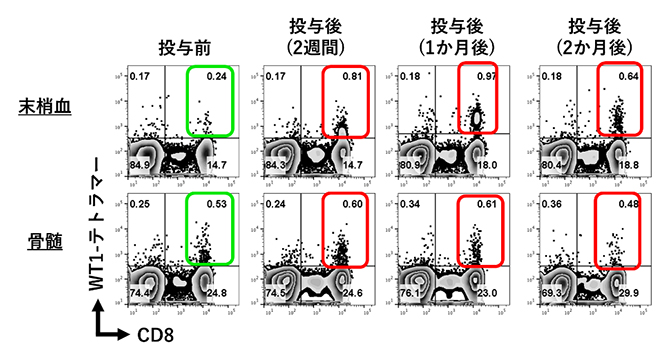
図4 WT1抗原に反応するキラーT細胞数の変化
aAVC-WT1投与後、WT1テトラマーを用いてWT1抗原に反応するキラーT細胞(CD8陽性T細胞)を評価した。WT1テトラマー陽性キラーT細胞は、末梢血および骨髄において投与後に増加した(赤枠)。
次に、キラーT細胞の機能的解析を行いました。aAVC-WT1の特長は、抗原の1個のエピトープ(抗原決定基)だけではなく、複数のエピトープに反応するキラーT細胞が誘導されることです。このことを検証するために、WT1タンパク質全長の中から15アミノ酸配列のペプチド(オーバラップペプチド)を129個ロックフェラー大学に合成してもらいました。このペプチドライブラリーと細胞内サイトカイン染色を用いて、CD4陽性T細胞(ヘルパーT細胞)とCD8陽性T細胞(キラーT細胞)によるIFN-γおよびTNF-α[14]の産生を評価し、機能的解析を行いました。その結果、1回目投与の1~2週間後、すなわちエフェクター期(活性化したT細胞ががん細胞を攻撃する期間)でペプチドライブラリーに反応するT細胞が増殖し、12カ月後まで続くことを確認しました(図5)。
さらに、どのペプチド領域が実際に反応しているのかを検証するために、129個のペプチドのうち、10~13個のペプチドを含有するサブプールを作り、免疫の応答性を調べました。すると、いくつかのサブプールにT細胞が反応していることを確認しました。この中には、1回目投与後2週間目に新しいT細胞が誘導され、長期に維持されたものもありますが、1回目投与後2週間目以降に新しいT細胞が誘導され、維持できたものも存在しました。一方、1回目投与開始前からT細胞が存在していて、それがさらに活性化機能が検出されたものや、短期間だけ検出されるT細胞などがあることが分かりました。
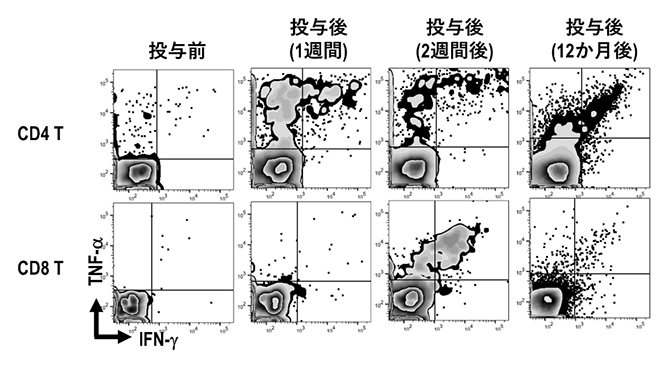
図5 WT1抗原に反応するT細胞の機能的評価
aAVC-WT1の1回目投与後において、WT1抗原に反応するT細胞を、WT1ペプチドライブラリーを用いてサイトカイン産生を指標にし、機能的評価を行った。CD4陽性T細胞(ヘルパーT細胞)は1週間後から、CD8陽性T細胞(キラーT細胞)は2週間後から増加し、1年後においても機能的な記憶T細胞が存在していた。
次に、上記に示したキラーT細胞が維持される期間を検証することを目的として、一細胞レベルでのキラーT細胞(T細胞クローン)を評価するためにT細胞受容体(TCR)[17]の解析を行いました。すると、T細胞クローンは長期的増殖を維持する集団と減少していく集団、新しく出現する集団の三つに分けられ、短期で消失する集団と長期に維持される集団の存在を確認できました(図6左)。またT細胞クローンには、抗原に感作(かんさ)され疲弊する前のT細胞(TPEX細胞[18])が含まれると考えられます。TPEX細胞から再活性化して増殖するT細胞クローン(Inc)、数的には減少していくクローンの集団(Dec)には消失していくものもありますが、一部には機能性を維持して長寿命となるクローンもありました。一方で、全く新しく出現して長期間維持されるクローン(New)も存在していることが確認できました(図6右)。この結果は、aAVC-WT1の投与が元々存在していたTPEX細胞の活性化を促進するとともに新しくクローンを出現させることで、長期記憶キラーT細胞を誘導することを示しています。
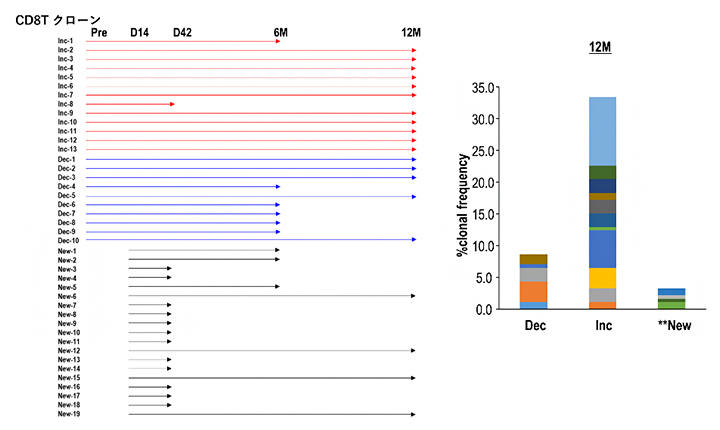
図6 aAVC-WT1によるキラーT細胞クローンの長期持続
(左)aAVC-WT1の投与後キラーT細胞を追跡し、その持続性を評価した。抗腫瘍キラーT細胞クローンの中には、疲弊する前のT細胞(TPEX細胞)から再活性化して増殖するT細胞クローン(Inc、赤矢印)、数的には減少する中で長寿命を示すクローン(Dec、青矢印)、および全く新しく出現するクローン(New、黒矢印)が存在した。
(右)12カ月持続している長期T細胞クローンは、Dec、Inc、Newタイプからなる(縦軸は、それぞれの総T細胞クローン数の割合)。
以上の結果をまとめると、マウスだけでなくヒトでもaAVC-WT1の投与により自然免疫、獲得免疫、記憶免疫という一連の免疫サイクルが誘導されることが確認できました。これは、免疫の監視機構が成立できたことを意味します。また、aAVC-WT1を投与することで、少なくともWT1テトラマーに反応するキラーT細胞、あるいはペプチドライブラリーに反応するキラーT細胞の誘導を確認できたことは、宿主(患者)内に存在する樹状細胞の抗原提示能が増強されたことを意味します。なぜなら、aAVCによりCD8陽性T細胞を活性化するためには樹状細胞が必須だからです注2)。このようなクロスプレゼンテーションと呼ばれる現象がヒト生体内で起き、キラーT細胞が誘導できたことは、科学的検証の意味でも非常に重要です。
今後の期待
現在、がんは2人に1人が罹患する疾患であり、その対応は極めて重要です。しかし、がん細胞は多様であり、さまざまな方法で免疫回避をするため、治療法の確立は容易ではありません。この免疫回避を起こさない治療法を目指して、他家細胞とmRNAを利用し、抗原のデリバリーとアジュバント機能を併せ持つ体内樹状細胞標的療法の確立を目指して、新しいがん治療型ワクチンのプラットフォームとしてaAVCを作製してきました。
本研究では、ヒトにおいてNK細胞およびNKT細胞の活性化とキラーT細胞の効率的誘導を確認しました。さらに、さまざまな種類の記憶キラーT細胞の効率的誘導も確認できましたが、長期記憶のメカニズムについてはさらなる解析が必要です。
本研究成果は、mRNAを利用した治療薬を目指したワクチン製剤による再発または治療抵抗性白血病患者への投与により安全性のみならず一定の有効性が示されたことから、治療薬開発へ向けた指標になると期待できます。また、今回同定した記憶キラーT細胞の解析は、記憶免疫機構を解明する分野の研究に貢献することが期待できます。今後の治験でより多くの患者を対象に臨床的効果を検証していきたいと考えております。
進行がんに対しての免疫応答を確認できたことは、完治を目指した治療法の確立や固形腫瘍への治験に向けたワクチン開発につながる可能性を示しています。例えば、免疫チェックポイント阻害剤[19]抵抗性患者の治療法や免疫チェックポイント阻害剤との併用療法、あるいは従来の抗がん剤抵抗性患者の治療に貢献することが期待できます。
補足説明
1.人工アジュバントベクター細胞(aAVC:エーベック)
がんの免疫療法で研究が進められている人工細胞。他家細胞(マウス用にはNIH3T3細胞を、ヒト用にはHEK293細胞)に、CD1d分子のmRNAと標的がん抗原分子のmRNAを遺伝子導入させ、CD1d上にアルファガラクシトシルセラミド(α-GalCer)を発現させた細胞。アジュバントとは免疫反応を増幅させること、ベクターは運び屋をいう意味。aAVCは、artificial adjuvant vector cellsの略。
2.急性骨髄性白血病
骨髄の中の未熟な細胞(幼若骨髄系細胞)ががん化し、増殖し、骨髄を占拠することにより、正常な血液細胞が作られなくなり、貧血症状、出血、感染による症状が現れる疾患。通常は化学療法や移植治療が行われる。
3.記憶免疫
免疫反応で、特定の抗原に対する抗体の構造が保持されており、2回目の抗原の進入に対して強い免疫応答を起こすことができる。
4.樹状細胞
樹状細胞は樹状突起を持つ白血球。未感作T細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。
5.WT1
WT1遺伝子は、小児の腎悪性腫瘍の一つであるWilms’腫瘍の発生と関連している遺伝子であり、それによりコードされているWT-1タンパク質はさまざまな増殖関連遺伝子の転写を調節している。急性骨髄性白血病をはじめ、さまざまな腫瘍に発現が認められる。
6.医師主導治験、第一相試験
医師主導治験とは、医師自らが治験を企画・立案し、治験届を提出し治験を実施するもの。臨床試験のうち第一相試験は、主に治験薬の安全性および薬物の体内動態、薬剤の最大用量を確認するために行われる。
7.キラーT細胞、記憶キラーT細胞
獲得免疫をつかさどるT細胞には、標的異物(ウイルスやがん細胞)に対して、攻撃、殺傷能を持つキラーT細胞とB細胞やキラーT細胞の分化・増殖・機能を補助するヘルパーT細胞がある。記憶キラーT細胞は、その機能を記憶できているT細胞のことで、再度抗原に遭遇すると、短時間で強力に標的異物を攻撃できる。
8.エピトープ(抗原決定基)
T細胞、B細胞などが抗原と結合する際には、抗原全体を認識するのではなく、抗原の比較的小さな部位を認識して結合する。この結合部位を抗原のエピトープ(抗原決定基)と呼び、6~20個のアミノ酸や5~8個の単糖の配列から成る。
9.クロスプレゼンテーション
エンドサイトーシスあるいはファゴサイトーシスで抗原提示細胞に取り込まれた外来性物質が、MHCクラスI分子を介して提示されること。通常、樹状細胞がその機能を担い、ナイーブなCD8陽性T細胞を誘導するといわれている。
10.ナチュラルキラー細胞(NK細胞)、ナチュラルキラーT細胞(NKT細胞)
両者とも自然免疫リンパ球の一種である。NK細胞は、ウイルスによる感染やがん細胞に対する初期防御機構としての働きを担っているリンパ球の一種。NKT細胞は、NK細胞のマーカーと1種類のT細胞受容体を発現していて、アレルギー疾患、がん、自己免疫疾患を制御する機能を持つ中核的な免疫調節細胞。
11.α-GalCer(アルファガラクトシルセラミド)
NKT細胞だけを活性化する糖脂質リガンドの一つであり、CD1d分子上に提示される。沖縄に生息する海綿の一種(Agelas mauritianus)から得られた。
12.CD4陽性T細胞、CD8陽性T細胞
リンパ球の一種であるT細胞の中で、CD4陽性T細胞は細胞表面にCD4と呼ばれる特徴的なタンパク質を発現するもので、活性化するとヘルパーT細胞に分化し、抗原を認識すると他の免疫細胞を活性化するなど、さまざまな免疫応答を引き起こす。CD8陽性T細胞は細胞表面にCD8を発現するもので、活性化するとキラーT細胞に分化し、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。
13.CD1d
糖脂質抗原の情報を伝えるのに必要な分子。β2-ミクログロブリンと非共有結合した膜タンパク質で抗原提示細胞上に発現しており、糖脂質を提示しNKT細胞を活性化する。HLA(ヒト白血球抗原)のような多型性はなく、ヒト、マウス間でも相動性が高いため、同一糖脂質抗原をヒト、マウス無関係にNKT細胞を活性化できる。
14.サイトカイン、インターフェロンガンマ(INF-γ)、TNF-α
サイトカインは細胞間相互作用を担うタンパク質性因子のこと。INF-γは抗原刺激や微生物感染に反応してT細胞(ヘルパーT細胞:Th1細胞)などから分泌される。抗腫瘍作用、抗ウイルス能増強、マクロファージやNK細胞の活性化などさまざまな機能がある。TNFαは、腫瘍の壊死に関わるサイトカインである。
15.ELISPOT法
単一細胞レベルで分泌されたサイトカイン産生細胞数などを検出できる方法であり、がんや感染症、自己免疫疾患などの疾患において抗原特異的免疫応答を評価するのに用いられる。
16.qPCR法(定量PCR法)
ポリメラーゼ連鎖反応(PCR)を用いて、サンプル中の特定配列のDNAを増幅し、そのDNA量を測定する手法。
17.T細胞受容体(TCR)
T細胞の表面に存在する、抗原を認識する分子。T細胞が胸腺で分化する際、V遺伝子、D遺伝子、J遺伝子がランダムに組換えを起こすことで、各T細胞に固有のT細胞受容体が生成される。
18.TPEX細胞
疲弊T細胞は、全体的に増殖能が低く、古典的なメモリーT細胞を形成できないことから最終分化したT細胞と考えられてきた。しかし、前疲弊段階のT細胞のプールは、細胞増殖が可能でエフェクターとしての機能が保たれており、TPEX(疲弊前駆細胞)と呼ばれる。
19.免疫チェックポイント阻害剤
T細胞の活性化を抑制する負の共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称で、T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。
共同研究チーム
理化学研究所 生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部創薬・医療技術基盤プログラム 副プログラムディレクター)
上級研究員 清水 佳奈子(シミズ・カナコ)
東京大学 医科学研究所
附属先端医療研究センター
教授(研究当時) 東條 有伸(トウジョウ・アリノブ)
(現 東京医科歯科大学副学長)
附属病院内科系診療部門
助教 川俣 豊隆(カワマタ・トヨタカ)
原論文情報
Shin-ichiro Fujii, Toyotaka Kawamata, Kanako Shimizu, Jun Nakabayashi, Satoru Yamasaki, Tomonori Iyoda, Jun Shinga, Hiroshi Nakazato, An Sanpei, Masami Kawamura, Shogo Ueda, Jan Dörrie, Svetlana Mojsov, Madhav V Dhodapkar, Michihiro Hidaka, Masanori Nojima, Fumitaka Nagamura, Shigemi Yoshida, Toshio Goto, Arinobu Tojo, “Reinvigoration of innate and adaptive immunity via therapeutic cellular vaccine for AML patients”, Molecular Therapy – Oncolytics, 10.1016/j.omto.2022.09.001
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
上級研究員 清水 佳奈子(シミズ・カナコ)
報道担当
理化学研究所 広報室 報道担当