2023-01-26 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫シグナル研究チームの今西 貴之 上級研究員、齊藤 隆 チームリーダーらの国際共同研究グループは、T細胞[1]が老化するメカニズム、および老化T細胞が引き金となって炎症性老化(インフラマエイジング)[2]を発症する機構を明らかにしました。
本研究成果は、老化と加齢性疾患の新たな治療法の開発に貢献すると期待できます。
RIPK1は、さまざまな自然免疫[3]受容体の下流で、細胞の生存と細胞死を制御することが知られるリン酸化酵素で、最近、その欠損患者では重度の免疫不全と炎症性疾患を発症することが報告されました。
今回、国際共同研究グループは、T細胞特異的にRIPK1を欠損させた(RIPK1-tKO)マウスを用いて、T細胞におけるRIPK1の機能解析を行いました。その結果、RIPK1を欠損したT細胞は早期に炎症性老化が誘導され、この老化T細胞が引き金となってさまざまな加齢性疾患を発症し、老化が進み寿命が短縮することが分かりました。さらに、この炎症性老化の誘導は正常の老化T細胞でも起こることが明らかになりました。
本研究成果は、科学雑誌『Science Advances』オンライン版(1月25日付:日本時間1月26日)に掲載されました。
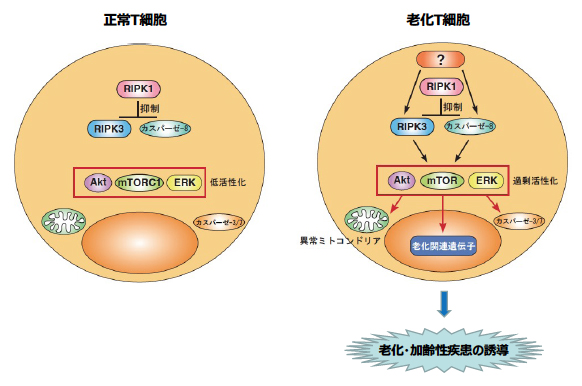
老化を抑制するRIPK1、およびRIPK3とカスパーゼ-8がT細胞の老化を誘導するメカニズム
背景
免疫機能は、病原体やがん細胞などの異物から生体を保護する高度なシステムですが、加齢によって獲得免疫[3]をつかさどるT細胞の機能低下(免疫老化)が起こります。これに伴って、感染症に対する抵抗性が低くなるだけでなく、高齢者におけるワクチンの有効性が低下することになり、感染症のリスクが高まることが知られています。
免疫老化のもう一つの大きな特徴は炎症反応が起こることで、一般的に細胞は老化すると、炎症性サイトカイン[4]やケモカイン[4]の産生の増強を特徴とする「細胞老化関連分泌形質(SASP)[4]」と呼ばれる形質に変化し、高齢者はしばしば、心血管疾患や肺炎などの慢性的な炎症性疾患に至ることが知られています。しかし、T細胞の老化の分子機構やT細胞の老化が生体に及ぼす影響には、不明な点がまだ多く残されています。
「RIPK1(receptor interacting protein kinase 1)」はセリン/スレオニンリン酸化酵素で、さまざまな自然免疫受容体の下流で、細胞の生存と細胞死を制御しています。ヒトではRIPK1を欠損すると、重篤な免疫不全を発症するとともに、さまざまな炎症性疾患を発症することが最近報告されています注1)。さらに、RIPK1欠損患者ではリンパ球減少症[5]が見られることから、T細胞に発現するRIPK1がT細胞の恒常性に重要な役割を果たしていると考えられます。そこで本研究では、T細胞におけるRIPK1の役割を調べました。
注1)Cuchet-Lourenço, D. et al. Biallelic RIPK1 mutations in humans cause severe immunodeficiency, arthritis, and intestinal inflammation. Science. Aug 24;361(6404):810-813, 2018.
研究手法と成果
国際共同研究グループはまず、T細胞特異的にRIPK1を欠損させた(RIPK1-tKO)マウスを作製しました。RIPK1-tKOマウスは生後4カ月頃までは正常に見える健康状態でしたが、生後5カ月頃から体重減少や目の混濁、神経変性疾患、肺や唾液腺の炎症を発症し、早期に死亡することが明らかになりました(図1)。
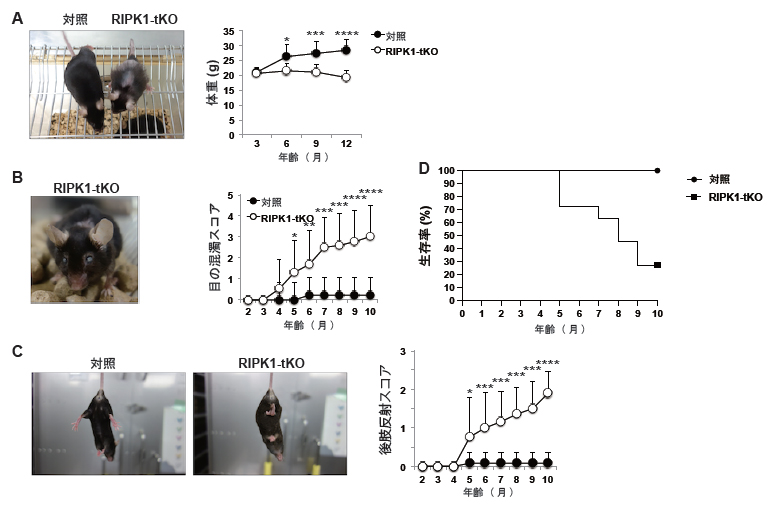
図1 T細胞特異的RIPK1欠損(RIPK1-tKO)マウスにおける加齢性疾患の発症
(a)RIPK1-tKOマウスの外見(左)と体重(右)。RIPK1-tKOマウスは体重増加が抑制されている。
(b)RIPK1-tKOマウスに誘導される角膜の混濁(左)とスコア(右)。
(c)RIPK1-tKOマウスを逆さに持ち上げたときの後肢の動きの様子(左)と後肢反射スコア(右)。正常マウスは反射的に後肢を広げるが、RIPK1-tKOマウスは広げられない。
(d)RIPK1-tKOマウスの生存率。
また、RIPK1-tKOマウスには、RIPK1欠損患者と同様にT細胞の細胞死が増加することにより、リンパ球減少症が見られました。興味深いことに、RIPK1-tKOマウスでは、CD4陽性[1]T細胞内のエフェクター/メモリー表現型T細胞[6]の割合が加齢とともに劇的に増加し、一方でCD4陽性のナイーブT細胞[7]の割合は減少することが分かりました。これは、RIPK1欠損CD4陽性T細胞が老化T細胞の性質と類似している可能性を示しています。
そこで、RIPK1-tKOマウスのRIPK1欠損CD4陽性T細胞の遺伝子発現を調べたところ、老化に関連する遺伝子の発現が著しく増加していることが明らかになりました。実際、RIPK1-tKOマウスでは、上記の疾患のほかにサルコペニア(加齢性筋肉減弱現象)や低血糖、貧血、心肥大などの加齢性疾患を早期に発症することが明らかになりました。
細胞は老化すると細胞老化関連分泌形質に変化しますが、RIPK1欠損CD4陽性T細胞も細胞老化関連分泌形質になっており、さまざまなサイトカインやケモカインを大量に産生することが分かりました。また、このマウスでは、まだ加齢性疾患を発症していない生後2カ月から、血中のさまざまなサイトカインの産生が増大していることが明らかになりました。このことから、RIPK1欠損CD4陽性T細胞がマウスの若いときから慢性炎症(炎症性老化)を誘発し、その蓄積によって老化が早まり、加齢性疾患を早期に発症することが示唆されました。
RIPK1欠損CD4陽性T細胞が老化する分子機構を解明するために、RIPK1欠損CD4陽性T細胞で発現が増加している遺伝子をパスウェイ解析[8]することによって、RIPK1によって制御されるシグナル伝達経路を同定することを試みました。その結果、RIPK1欠損CD4陽性T細胞では、細胞周期に関連した遺伝子の発現が著しく増加していることが分かりました。T細胞では、細胞周期関連遺伝子の発現はmTOR複合体1(mTORC1)[9]が制御していることから、mTORC1の活性化を調べました。その結果、RIPK1欠損CD4陽性T細胞ではmTORC1の活性化が増強しており、RIPK1欠損CD4陽性T細胞をmTORC1の阻害剤で処理すると、mTORC1の活性化が減弱し、老化関連遺伝子の発現も低下することが明らかになりました。
RIPK1はカスパーゼ-8[10]やRIPK3[11]と相互作用することが知られているため、RIPK1欠損CD4陽性T細胞における両者の役割を調べました。RIPK1欠損CD4陽性T細胞をカスパーゼ-8阻害剤(Z-IETD)で処理すると、mTORC1の活性化の増強や老化関連遺伝子の発現が部分的に低下しました。また、正常な老化CD4陽性T細胞をカスパーゼ-8阻害剤で処理しても、同様の結果が得られました。
次にRIPK1とRIPK3の二重欠損CD4陽性T細胞を用いて、RIPK3の役割を調べました。RIPK1/3二重欠損CD4陽性T細胞では、mTORC1活性化と老化関連遺伝子の発現の増強が部分的に弱くなったのに対して、RIPK1/3二重欠損CD4陽性T細胞をさらにカスパーゼ-8阻害剤で処理すると、mTORC1の活性化も老化関連遺伝子の発現の増強も、完全に抑えられることが分かりました(図2)。このことから、カスパーゼ-8とRIPK3がT細胞の老化を誘導し、RIPK1はその誘導を抑制していることが示唆されました。
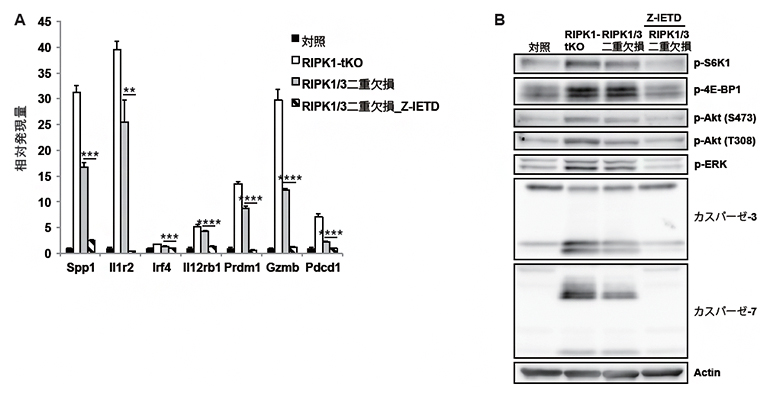
図2 RIPK3、カスパーゼ-8によるT細胞老化の誘導
(a)RIPK1-tKO、RIPK1/3二重欠損、RIPK1/3二重欠損をZ-IETD(カスパーゼ-8阻害剤)処理したCD4陽性T細胞における老化関連遺伝子群のmRNAの発現量。
(b)(A)と同じCD4陽性T細胞におけるシグナル分子S6K1、4E-BP1、Akt、ERKのリン酸化(p-S6K1、p-4E-BP1、p-Akt、p-ERK)とカスパーゼ-3/7の発現量を解析した。濃い部分ほど、その分子が多く発現することを示す。RIPK1欠損CD4陽性T細胞では、mTORC1(S6K1、4E-BP1)やAkt、ERK、カスパーゼ-3/7の過剰な活性化が見られるのに対して、Z-IETDで処理したRIPK1/3二重欠損CD4陽性T細胞では、それらの分子の活性化が消失した。
老化した細胞は老化を強化・伝播させることが知られているため、次にRIPK1-tKOマウスの組織環境がT細胞の老化に及ぼす影響を検討しました。野生型のCD4陽性T細胞をRIPK1-tKOマウスに移入すると、老化関連遺伝子の発現やサイトカイン産生が増加したのに対し、逆にRIPK1欠損CD4陽性T細胞を正常マウスに移入すると、老化関連遺伝子の発現やサイトカイン産生が低下することが判明しました。これらのことから、T細胞の老化の誘導および制御に、組織環境由来のシグナルが重要な役割を果たすことが示唆され、組織環境シグナルの実態の解明が重要であることが分かりました(図3)。
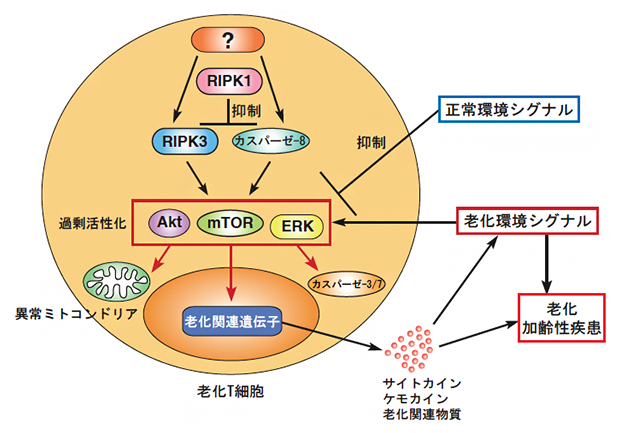
図3 RIPK1によるT細胞の老化と加齢性疾患発症の制御メカニズム
RIPK1はRIPK3とカスパーゼ-8の活性化を抑制することで、mTORC1の過剰な活性化を抑制する。mTORC1の過剰な活性化は老化関連遺伝子の発現を誘導し、T細胞の老化を促進し、さまざまなサイトカインやケモカイン、老化関連物質が産生される。その結果、組織の老化が進み、加齢性疾患を発症する。組織の老化環境シグナルはmTORC1の活性化を増強し、T細胞の老化と加齢性疾患の発症を悪化させる一方、正常な組織環境シグナルはmTORC1の活性化を抑制し、T細胞の老化を抑制する。
今後の期待
今回の研究成果により、T細胞に発現するRIPK1がRIPK3とカスパーゼ-8の機能を抑制することにより、T細胞の老化を負に制御していることが明らかになりました。さらにT細胞が老化すると、さまざまな全身性の加齢性疾患を発症し、老化を促進することが明らかになりました(図3)。そのため、RIPK3およびカスパーゼ-8の機能制御により、健康寿命を延ばす画期的な治療薬の開発が期待できます。また、RIPK3とカスパーゼ-8を活性化する上流の分子(図3の「?」に該当)の解明が今後の重要な課題であると考えられます。
補足説明
1.T細胞、CD4陽性
免疫細胞の一種。細胞表面に発現するT細胞抗原受容体を介して、樹状細胞などの抗原提示細胞が提示する抗原情報を認識し、活性化する。活性化したT細胞は直接他の細胞と相互作用し、またサイトカインと呼ばれる液性因子を分泌することで、B細胞や他の免疫細胞の細胞分化や機能を調節する。主に、CD4陽性のヘルパーT細胞とCD8陽性の細胞障害性(キラー)T細胞に分類される。CD4陽性のヘルパーT細胞は、抗体を作り出すB細胞や自然免疫を担うマクロファージなどの働きを促進する指令を出す役割がある。CD8陽性のキラーT細胞は、ウイルス感染細胞やがん細胞を殺傷し、排除する。
2.炎症性老化(インフラマエイジング)
無症状の慢性的な炎症により、老化や加齢性疾患が促進される現象のことで、inflammation(炎症)とaging(老化)から生まれた造語である。
3.自然免疫、獲得免疫
自然免疫は、体に侵入してきた病原体を迅速に感知し、感染初期の生体防御を誘導する機構で、樹状細胞やマクロファージなどが担当する。自然免疫の活性化は、その後の獲得免疫の発動にも重要である。獲得免疫は、病原体に感染することにより後天的に形成される免疫で、高度な特異性と病原体の記憶を特徴とし、同じ病原体に感染した際に病原体を効率よく排除する。主に、リンパ球のT細胞とB細胞が担当する。
4.サイトカイン、ケモカイン、細胞老化関連分泌形質(SASP)
サイトカイン・ケモカインは、免疫細胞から分泌されるタンパク質で、相手の細胞表面の受容体を介して種々の生理作用を及ぼし、細胞間情報伝達を担う。細胞老化関連分泌形質は、細胞老化を起こした細胞から、炎症作用や発がん促進作用を持つ炎症性サイトカイン・ケモカイン、細胞外マトリックス分解酵素などのさまざまな因子を分泌させる現象。SASPはSenescence-associated secretory phenotypeの略。
5.リンパ球減少症
血液中のリンパ球が著しく減少した状態のことをいい、エイズ、がん、老化などが原因で起こることが多い。
6.エフェクター/メモリー表現型T細胞
CD44hiCD62Lloの細胞表面マーカー分子を発現するT細胞で、エフェクターヘルパーT細胞に似た性質を持ち、さまざまなサイトカインを産生する能力がある。加齢に伴い、ナイーブT細胞が減少し、エフェクター/メモリー表現型T細胞が増加することが知られている。
7.ナイーブT細胞
ナイーブT細胞とは、抗原にさらされたことのないT細胞のことで、抗原提示細胞からの抗原刺激を受けることにより、活性化され機能分化したTh1細胞やTh2細胞などのエフェクターヘルパーT細胞に分化する。Th1細胞は、細胞内に寄生する細菌やウイルスなどの病原体の排除を促す。Th2細胞は元来、細胞外に寄生する寄生虫などの排除を誘導するが、花粉やハウスダストなどの異物に対してもアレルギー反応を誘導することが知られている。
8.パスウェイ解析
遺伝子発現解析をもとに活性化されているシグナル伝達経路や上流の分子を予測する解析方法。
9.mTOR複合体1(mTORC1)
mTORは、エネルギーや栄養、増殖因子などの環境シグナルに反応して活性化が調節されるタンパク質リン酸化酵素で、複数のタンパク質の複合体であるmTORC1およびmTORC2を形成する。mTORC1は、リボソームの生成とタンパク合成経路を活性化するとともに、タンパク質分解を抑えることにより細胞の増殖を促進する。mTORはmechanistic target of rapamycinの略。
10.カスパーゼ-8
アスパラギン酸特異的システインプロテアーゼの一種で、アポトーシスと呼ばれる細胞死を実行する役割のほかに、T細胞の活性化に重要な役割を果たすことが明らかになっている。
11.RIPK3
セリン/スレオニンリン酸化酵素酸化酵素で、ネクローシスと呼ばれる細胞死を誘導する役割に加えて、炎症性サイトカインの産生を促進する機能が知られている。
国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫シグナル研究チーム
チームリーダー 齊藤 隆(サイトウ・タカシ)
上級研究員 今西 貴之 (イマニシ・タカユキ)
テクニカルスタッフⅠ 海野 緑(ウンノ・ミドリ)
テクニカルスタッフⅡ(研究当時)米田 奈津美(ヨネダ・ナツミ)
(現 創薬抗体基盤ユニット テクニカルスタッフⅡ)
自然免疫システム研究チーム
テクニカルスタッフⅠ 望月 美穂(モチヅキ・ミホ)
大阪大学大学院 医学系研究科 感染症・免疫学講座 生体防御学教室
准教授 本村 泰隆(モトムラ・ヤスタカ)
順天堂大学大学院 医学系研究科 研究基盤センター
助教 佐々木 崇晴(ササキ・タカハル)
ケルン大学(ドイツ)遺伝学研究所 分子医学センター
教授 マノリス・パスパラキス(Manolis Pasparakis)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「T細胞の老化が生体におよぼす影響とその分子機構の解明(研究代表者:今西貴之)」、公益財団法人武田科学振興財団医学系研究助成「T細胞の老化による炎症性疾患誘導の分子機構の解明(研究代表者:今西貴之)」による助成を受けて行われました。
原論文情報
Takayuki Imanishi, Midori Unno, Natsumi Yoneda, Yasutaka Motomura, Miho Mochizuki, Takaharu Sasaki, Manolis Pasparakis, and Takashi Saito, “RIPK1 blocks T cell senescence mediated by RIPK3 and caspase-8”, Science Advances, 10.1126/sciadv.add6097
発表者
理化学研究所
生命医科学研究センター 免疫シグナル研究チーム
チームリーダー 齊藤 隆(サイトウ・タカシ)
上級研究員 今西 貴之(イマニシ・タカユキ)
報道担当
理化学研究所 広報室 報道担当