2023-01-31 生理学研究所
内容
皮膚の傷が治る際には、皮膚表面の細胞である表皮細胞が増殖・移動して傷口を埋めることが重要です。これまでこのような細胞の機能には温度感受性TRPチャネルの1つであるTRPV3が関与することが知られていました。しかし、このTRPV3がどのように細胞の機能を制御するのかはよく分かっていませんでした。
今回、自然科学研究機構 生理学研究所/生命創成探究センターの富永真琴教授らのグループは製薬メーカー 株式会社池田模範堂の山野井遊博士、昭和大学医学部の髙山靖規講師、京都薬科大学の細木誠之准教授、立命館大学の丸中良典客員教授(京都工場保健会総合医学研究所長)との共同研究により、TRPV3がクロライドイオンチャネルであるANO1の活性化を介し、表皮細胞の増殖・移動を促進することを明らかにしました。本研究結果は、Communications Biology(2023年1月23日号)に掲載されました。
擦り傷、切り傷などで皮膚が傷ついた時には皮膚の表面を覆っている表皮細胞が削り取られてしまい、その下にある真皮と呼ばれる敏感な組織が露出することで痛みを感じます。また、この真皮には無数の血管があるためこれらが破けることで出血します。このような傷が治る際には傷の周囲に残った表皮細胞が増殖し、傷口を再度覆うように移動することが知られています。これまで、この表皮細胞の増殖・移動には温度感受性TRPチャネルの1つであるTRPV3が関わることが知られていました。しかし、このTRPV3がどのように細胞の機能を制御するのかはよく分かっていませんでした。
これまで富永真琴教授らのグループは、他のTRPチャネル(TRPA1やTPRV1)が同じ細胞にあるクロライドイオンチャネルであるANO1を活性化することを発見していましたが、TPRV3とANO1の関係や、ANO1やクロライドイオンと傷の治癒の関係は、分かっていませんでした。しかし、表皮細胞にはTRPV3もANO1もあることから、今回の研究では、TRPV3の活性化がANO1の活性化を誘導する可能性について検討しました。ヒト表皮細胞を用いて実験を行った結果、TRPV3を活性化する成分であるカンフル(樟脳)を表皮細胞に作用させるとクロライドイオンに由来する電流が流れ、ANO1チャネルの働きを阻害する薬剤を加えた時にだけ、電流が小さくなることが確認されました(図1)。このことはTRPV3の活性化がANO1の活性化を誘導し、クロライドイオンチャネル由来の電流が流れていることを示しています。
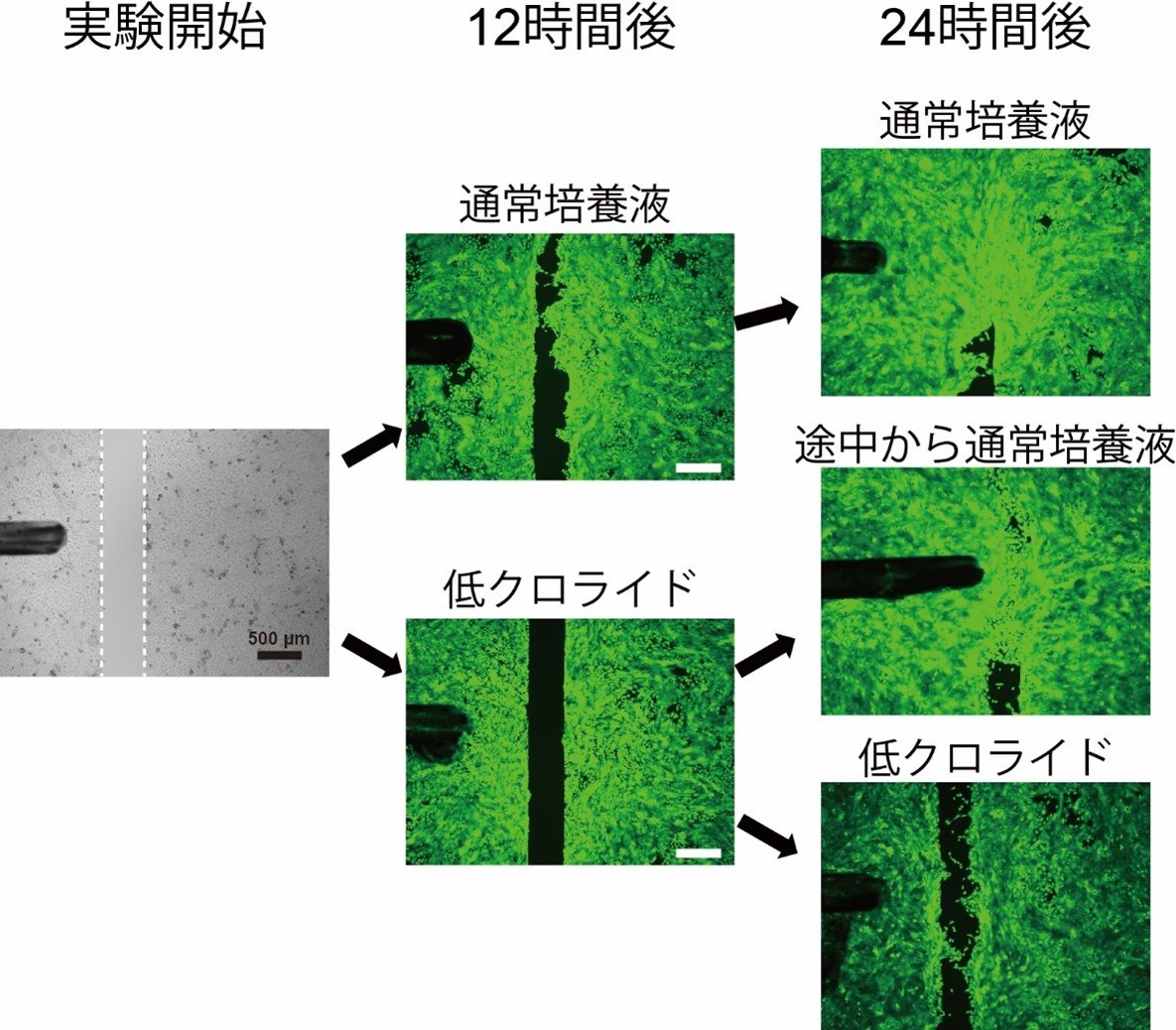
さらに、人工的に傷の治りを模した実験で表皮細胞の動きを観察するとANO1の働きを阻害する薬剤の存在下では表皮細胞の動きが遅くなり、増殖も抑制されることが分かりました(図2)。同様の実験を、クロライドイオンを減らした培養液の中で行うとANO1の働きを阻害した場合と同じように、表皮細胞の動きが遅くなり、増殖も抑制されることが分かりました(図3)。さらに表皮細胞内のクロライドイオン濃度を測定したところ、細胞外のクロライドイオン濃度よりも低く保たれていることが分かりました。
これらのことからTRPV3により活性化されたANO1を介してクロライドイオンが細胞内へ流入することが、表皮細胞による傷の修復に重要と考えられます。
ANO1やクロライドイオンと傷の治癒の関係はこれまで注目されておらず、今回の結果が更なる傷の治りのメカニズム解明に役立ち、新たな傷の治療法の開発につながるものと期待されます。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
1.表皮細胞において、TRPV3がANO1を活性化することを明らかにしました。
2.ANO1によるクロライドイオンの細胞内への流入が傷の修復に関わる細胞機能に重要であることを明らかにしました。
この研究の社会的意義
これまで注目されていなかったANO1やクロライドイオンと傷の修復の関係が明らかになったことで、新たな傷の治療法の開発に役立つと考えられます。
図1 TRPV3活性化剤によるANO1の活性化
TRPV3を活性化する成分であるカンフル(樟脳)を表皮細胞に作用させるとクロライドイオンに由来する電流が流れることが確認されました(a)。反応の線が下に移動しているほど、大きな電流が流れていることを意味しています。
また、この電流は途中でANO1の阻害剤を加えることで小さくなる(b)ことからANO1に由来するものと考えられます。
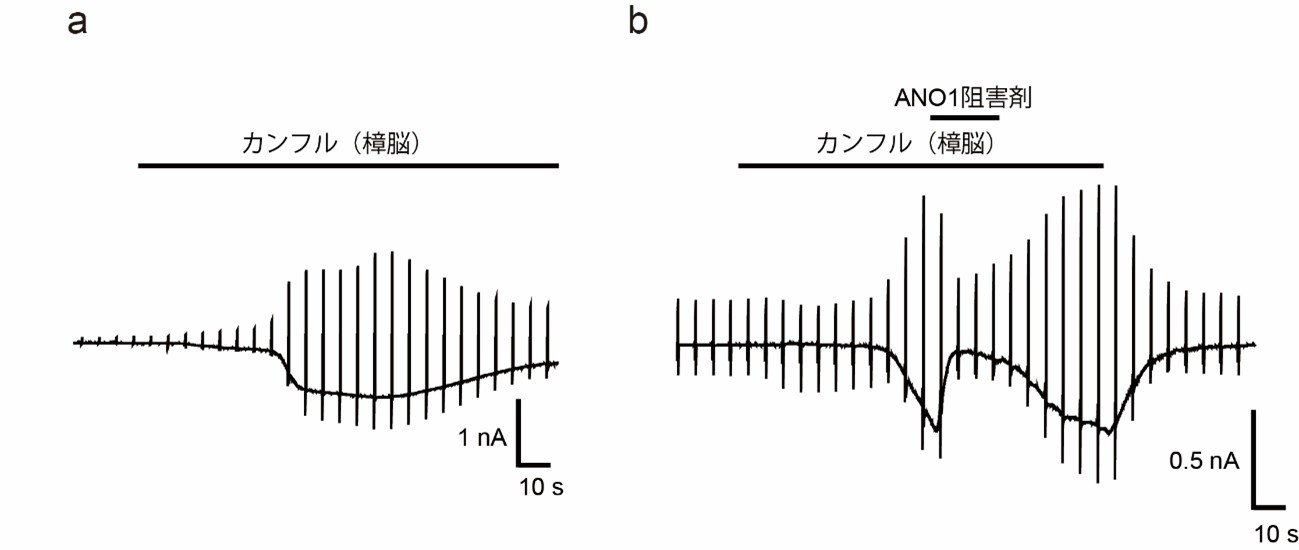
図2 人工傷モデルにおいてANO1は表皮細胞の動きや増殖に重要
シート状に培養した表皮細胞を一部除去(下図左側写真の白点線内)し、このスペースを表皮細胞が埋める過程を観察しました。ANO1の阻害剤がない場合は時間経過と共にスペースが埋まっていきますが、阻害剤が入っている場合はほとんどスペースが埋まらないことが分かります。つまり、ANO1は表皮細胞の動きや増殖を促進する働きをしていると考えられます。
また、12時間後まで阻害剤入で培養した後に阻害剤を除去し、24時間後まで培養した場合は再度スペースが埋まり始めています。このことから阻害剤に細胞を破壊するような作用は無いことが分かります。
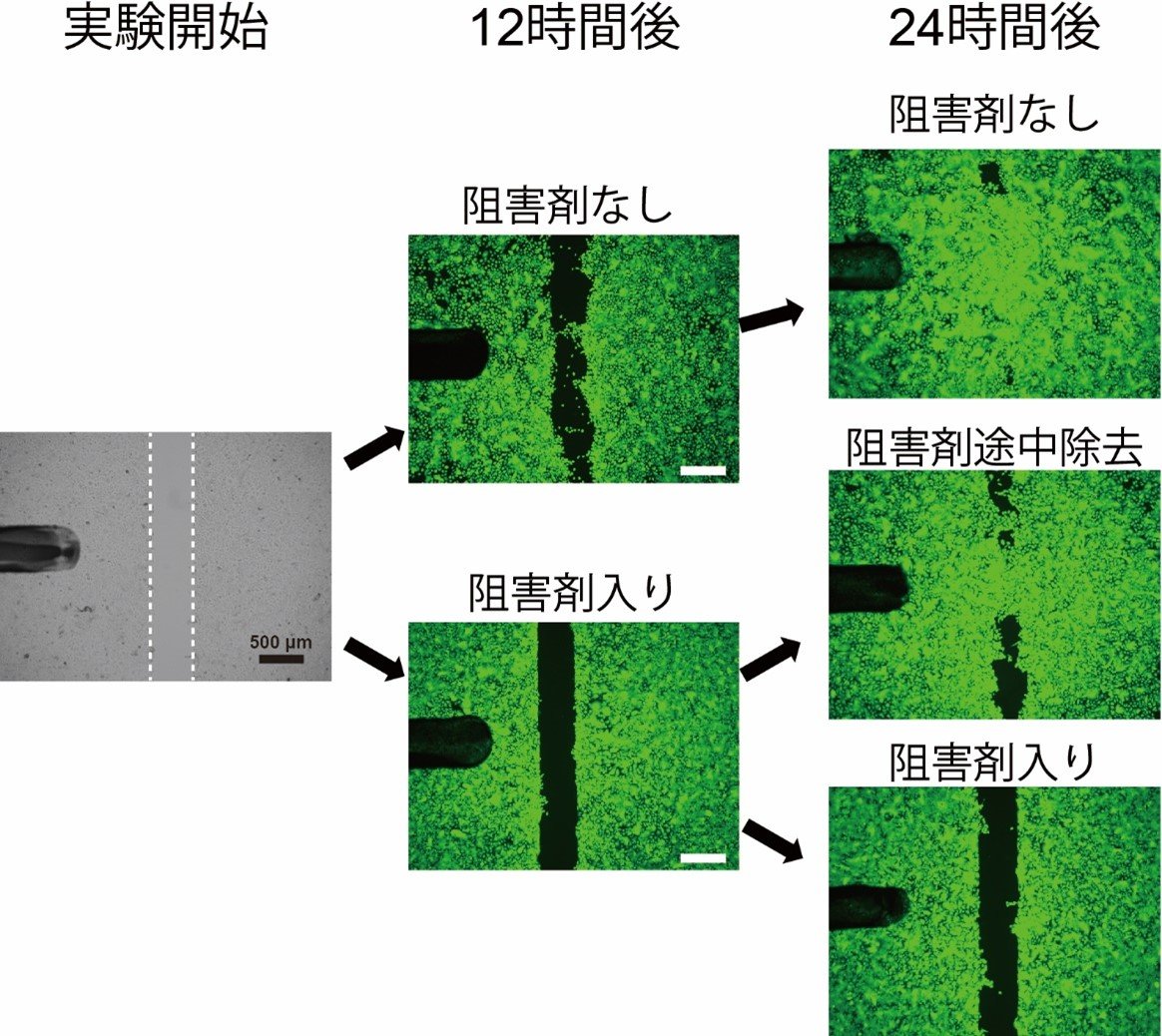
図3 人工傷モデルにおいてクロライドイオンは表皮細胞の動きや増殖に重要
人工傷モデルでクロライドイオンを減らした培養液を用い、通常の培養液と比較しました。低クロライド培養液ではANO1阻害剤を用いた場合と同様にほとんどスペースが埋まらないことが分かります。このことは、ANO1が表皮細胞の動きや増殖を促進する際にクロライドイオンが重要な働きをしていることを示しています。
また、12時間後まで低クロライド培養液で培養した後に通常の培養液に戻し、24時間後まで培養した場合は再度スペースが埋まり始めています。このことから低クロライド培養液にも細胞を破壊するような作用が無いことが分かります。
論文情報
TRPV3-ANO1 interaction positively regulates wound healing in keratinocytes
Yu Yamanoi, Jing Lei, Yasunori Takayama, Shigekuni Hosogi, Yoshinori Marunaka, Makoto Tominaga
Communications Biology 6, Article number: 88 (2023)
DOI:https://doi.org/10.1038/s42003-023-04482-1
リリース元
自然科学研究機構 生理学研究所
生命創成探究センター
株式会社 池田模範堂
昭和大学
京都薬科大学
立命館大学