2023-02-01 国立がん研究センター,日本臨床腫瘍研究グループ
発表のポイント
- 日本臨床腫瘍研究グループの肝胆膵グループにおける大規模な臨床試験の結果、胆道がん根治手術後の患者さんに対して、S-1(エスワン)*1補助療法により生存期間が有意に延長することが示されました。
- 本試験の結果、胆道がん根治手術後にはS-1補助療法が標準治療として確立し、エビデンスに基づいた治療の提供が可能となります。
- 本試験の成果は英国学術雑誌「The Lancet」に発表されました。
概要
国立研究開発法人国立がん研究センター中央病院(病院長:島田和明、所在地:東京都中央区)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
この度、JCOGの肝胆膵グループでは、根治手術が施行された胆道がんの患者さん440人を対象に、S-1補助療法を行うことが、術後経過観察よりも優れているかを検証するため、ランダム化第III相試験*2(JCOG1202/ASCOT試験、研究代表者:国立がん研究センター東病院 肝胆膵外科 小西 大)を実施しました。その結果、S-1補助療法を行うことで、生存期間が有意に延長することが示されました。今後、日本のガイドラインが新たな標準治療に書き換えられる予定で、胆道がんの患者さんに対してエビデンスに基づいた治療の提供が可能となります。
本試験の成果は、英国学術雑誌「The Lancet」で発表(2023年1月21日付)されました。
背景
胆道がんには胆管がん、胆嚢がん、乳頭部がんが含まれます。国内で年間約2万人が罹患するがんで、部位別では第13位と比較的まれながん種です。治癒するためには外科手術が必要ですが、早期発見が難しく、診断時にはがんが周囲の重要臓器・血管に広がっていることが多いために手術不能なことが多くあります。手術可能な場合でも、肝切除や膵切除などの大きな手術が必要になることが多い疾患です。
また、胆道がんは手術後の再発率が高く、膵がんと並んで難治がんとされてきました。そのため、補助療法の確立が長年求められてきました。これまで、胆道がん手術後の補助療法に関して、いくつかのランダム化第III相試験が行われ、英国ではカペシタビンの有用性が報告されていましたが、統計学的には有意な結果は示されておらず、十分なエビデンスが確立しているとは言えない状況であり、国内では術後経過観察が標準治療でした。
研究方法・成果
JCOG の肝胆膵グループでは、全国38施設の協力を得て、標準治療である術後経過観察に対し、胆道がん手術後にS-1補助療法を行う治療の優越性を検証するランダム化第III相試験を実施しました。
- 臨床研究実施計画・研究概要公開システム
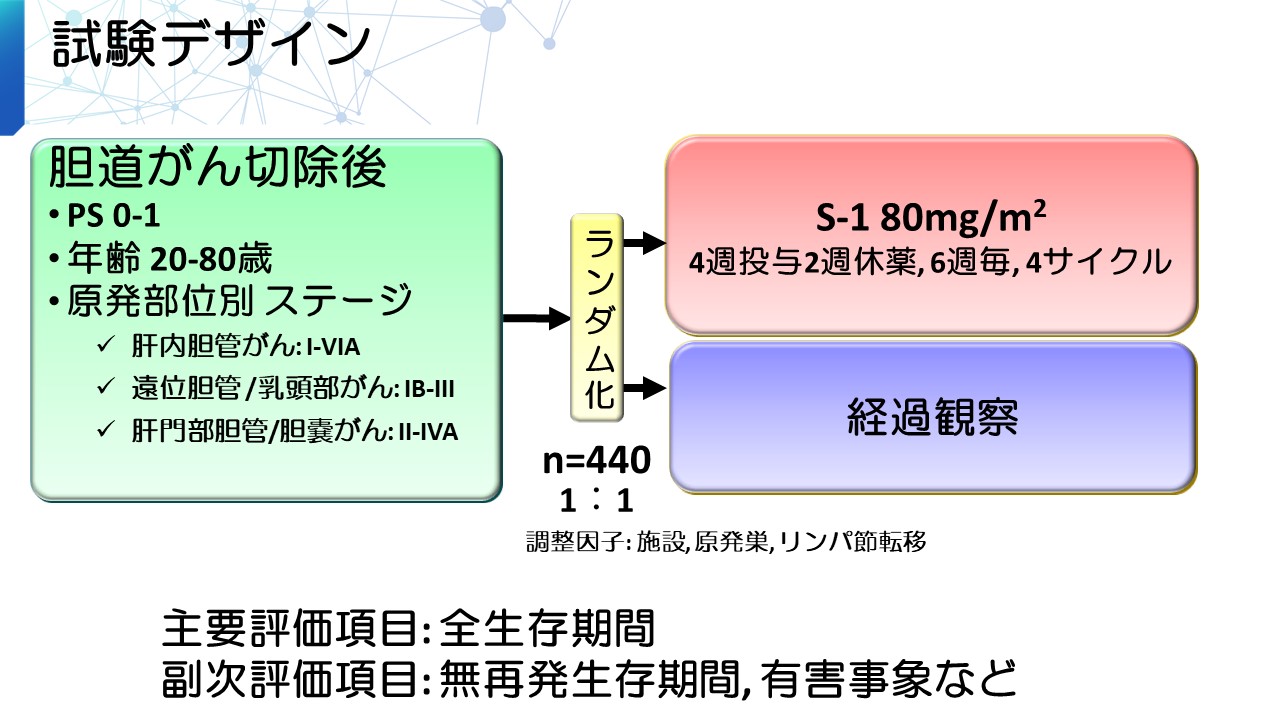
2013年9月から2018年6月の期間に胆道がんの患者さん440人が登録されました。登録終了後、3年後に解析が行われ、3年生存割合は経過観察群で67.6%、S-1群で77.1%(ハザード比*3 0.69、P値=0.0080 [片側検定])と、S-1群で有意に生存期間が延長するという結果が得られました。また、S-1群の主なGrade (重症度評価)3~4の有害事象は、好中球減少 (14%)、胆道感染(7%)でした。
以上の結果から、S-1補助療法が胆道がん根治手術後の標準治療となります。
展望
本試験の結果を受け、エビデンスに基づいた治療の提供が可能となり、胆道がんの根治手術後はS-1補助療法を行うことが第一選択として推奨されます。同様の臨床試験は海外でも実施されており、本試験の結果により、日本だけでなく海外のガイドラインでも標準治療に書き換えられ、胆道がん患者さんにさらに有効な治療が提供されることが期待されます。
また、JCOG肝胆膵グループではさらなる治療成績の向上を目指して、現在、ゲムシタビン、シスプラチン、S-1の3剤併用による術前化学療法の有効性を検証するランダム化第III相試験を実施しております。
発表論文
雑誌名
The Lancet
タイトル
Adjuvant S-1 compared with observation in resected biliary tract cancer (JCOG1202, ASCOT): a multicentre, open-label, randomised, controlled, phase 3 trial
著者
Kohei Nakachi, Masafumi Ikeda, Masaru Konishi, Shogo Nomura, Hiroshi Katayama, Tomoko Kataoka, Akiko Todaka, Hiroaki Yanagimoto, Soichiro Morinaga, Shogo Kobayashi, Kazuaki Shimada, Yu Takahashi, Toshio Nakagohri, Kunihito Gotoh, Ken Kamata, Yasuhiro Shimizu, Makoto Ueno, Hiroshi Ishii, Takuji Okusaka, Junji Furuse
掲載日
2023年1月21日
DOI
https://doi.org/10.1016/S0140-6736(22)02038-4
研究費
- 国立がん研究センター研究開発費
難治性悪性腫瘍に対する標準治療確立のための多施設共同研究(23-A-22)
成人固形がんに対する標準治療確立のための基盤研究(26-A-4, 2020-J-3)
成人固形がんに対する標準治療確立のための基盤研究(JCOG)(29-A-3) - 厚生労働科学研究委託費 革新的がん医療実用化研究事業
胆道がんに対する治療法の確立に関する研究(H26-076) - 国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「胆道がんに対する治療法の確立に関する研究」(JP16ck0106079, JP17ck0106350)
日本臨床腫瘍研究グループ(JCOG)の概要
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)は、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する各種委員会、中央支援機構(国立がん研究センター中央病院臨床研究支援部門)から構成されており、法人格を有さない任意団体です。
JCOG website: http://www.jcog.jp/index.htm
用語解説
*1 S-1(エスワン)
テガフール・ギメラシル・オテラシルカリウム(Tegafur/Gimeracil/Oteracil)を有効成分とする経口の抗悪性腫瘍剤(抗がん剤)の一種。日本で開発され、胃がん、大腸がん、膵がんなどで根治手術後の補助療法の有効性が確立している。
*2 ランダム化第III相試験
登録された患者さんをランダムに各治療群に割り付け、治療成績を比較する検証的な研究
*3 ハザード比
時間当たりの死亡のリスクの比
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター東病院
肝胆膵外科 小西 大/肝胆膵内科 池田 公史
栃木県立がんセンター
腫瘍内科 仲地 耕平
日本臨床腫瘍研究グループ(JCOG)
国立研究開発法人国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 多施設研究支援室
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)