2023-02-01 東京都医学総合研究所,国立精神・神経医療研究センター,福祉保健局
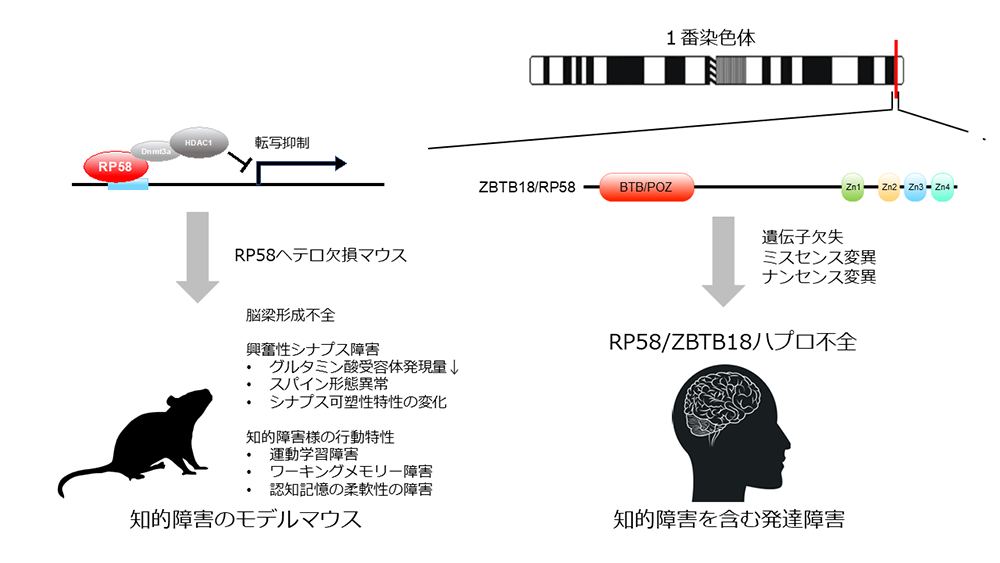
公益財団法人東京都医学総合研究所 旧神経細胞分化プロジェクト平井清華外部研究員、睡眠プロジェクト三輪秀樹協力研究員(国立精神・神経医療研究センター精神保健研究所精神薬理研究部 室長)、新保裕子研究技術員 (神奈川県立こども医療センター臨床研究所 研究員)、岡戸晴生シニア研究員、フロンティア研究室脳代謝制御グループ平井志伸主任研究員らの研究グループにより、RP58/ZBTB18ハプロ不全(注1)による知的障害の病理機序が、興奮性シナプスの障害である可能性が示唆されました。今回、RP58/ZBTB18ハプロ不全のモデル動物として、RP58ヘテロ欠損マウスを作製、解析し、次の4点を明らかにしました(図1)。
- 本モデルマウスの脳の組織解析では、大脳皮質の層形成には有意な異常は見られませんでしたが、脳梁の形成不全を示しました。これは、RP58/ZBTB18ハプロ不全患者でも報告されている異常です。
- 本モデルマウスは運動学習、ワーキングメモリー、認知記憶の柔軟性が障害されていました。これらの表現型は知的障害の症状と類似しており、このマウスはRP58変異を原因とした知的障害のモデルマウスとして妥当であると考えられました。
- 上記マウスの大脳皮質ではグルタミン酸受容体の発現減少が見出されました。また、海馬CA1ニューロンでのNMDA受容体の応答に異常があり、頻回刺激を繰り返した場合のシナプス長期増強の飽和レベルが低下していました。これらのことは、記憶や学習機能に重要な役割を果たすグルタミン酸受容体シナプス応答に異常が生じていることを示しています。
- さらに海馬CA1錐体細胞のスパインの形態解析により、スパインの形態異常が発見されました(図2)。
これらの成果は、RP58/ZBTB18ハプロ不全の背景に興奮性シナプスの障害が存在することを示唆しており、RP58/ZBTB18ハプロ不全により生じる知的障害の予防、治療法の開発に役立つことが期待されます。
本研究成果は、2023年2月1日(水曜日)午前10時(日本標準時)に米国科学誌『Molecular Psychiatry』にオンライン掲載されました。
ポイント
- 転写抑制因子RP58の変異により生じる知的障害のモデル動物として、RP58ヘテロ欠損マウスを解析し、主に行動解析結果から、モデルマウスとしての妥当性を明らかにしました。
- 上記モデルマウスを解析し、興奮性シナプス障害を発見しました。
- これらの発見により、RP58ハプロ不全の病態機序の解明、新たな予防・治療法の開発につながると考えられます。
研究の背景
知的障害は発達期に生じる障害で、知的能力と適応能力に制約を伴う状態であり、人口の1-3%が何らかの障害を有していると考えられています。環境、栄養、外傷、代謝、中毒など様々な原因がありますが、遺伝子変異、染色体異常という先天的な原因で生じるケースも多く、例えば、1q43-44微小欠失症候群(注2)では、その責任遺伝子の一つとして転写抑制因子RP58が同定されています。また、近年、知的障害の患者の中からRP58遺伝子自体の変異も同定されています。これらの患者では、RP58の機能が減弱していることが想定されます。さらに、RP58のナンセンス変異の患者が知的障害を示す症例が報告され、RP58ハプロ不全が知的障害の原因になることが明らかとなりました。
一方、私たちは、これまでモデル動物を用いてRP58遺伝子の脳での機能解析を行ってきました。RP58はBTBドメインとZnフィンガーモチーフを持つ転写抑制因子でありますが、胎仔期から大脳皮質に高発現し、大脳皮質のグルタミン酸作動性ニューロンの分化、放射状移動、成熟に必須のタンパク質であることを明らかにしています。そして、RP58の転写抑制の標的遺伝子として、Id1-4, Ngn2, Rnd2を同定してきました。RP58の完全欠損マウスは、大脳皮質形成不全を示し、出生直後致死ですが、ヘテロ欠損マウスでは出生時、著明な変化がなく、これまで異常は検出できませんでした。しかし、今回、RP58ハプロ不全のモデル動物としてRP58ヘテロ欠損マウスを詳細に解析したところ、成体で、脳梁形成不全、行動異常、シナプス異常を見出すことに成功しました。従って、RP58は発現量が減少することで、個体の生存には問題ないものの、シナプス障害が見られ、認知機能低下を伴う行動障害が引き起こされると考えられます。
研究の内容
RP58ハプロ不全は、RP58遺伝子の欠失やミスセンス変異、ナンセンス変異のために、RP58の機能が不十分になることが原因で、知的障害を含む神経発達症(発達障害)を生じると考えられています。本研究では、RP58ハプロ不全がシナプス異常を示すことについて、モデルマウスを用いて実証しました。つまり、RP58ヘテロ欠損マウスは、認知機能障害を示し、知的障害に相当する行動特性を示しました。このモデルマウスは、その他、脳梁形成不全、グルタミン酸受容体発現低下、NMDA受容体応答不全、興奮性スパイン成熟不全を示しました。
主な研究成果は以下の4点です(図1)。
(1)RP58ハプロ不全のモデル動物として、RP58ヘテロ欠損マウスを作製しました
RP58ヘテロ欠損マウスではRP58の発現がmRNA、蛋白、共に半減していました。クリューバーバレル染色で、脳梁の尾側の形成不全を見出しました。その他の脳の構造に著明な変化は見出せませんでした。また、大脳皮質層形成を浅層マーカSatb2、深層マーカCtip2の染色で検証しましたが、有意な変化は見られませんでした。
(2)上記モデルマウスの行動解析を行い、知的障害類似異常を見出しました
具体的には、自発的な活動性の亢進、不安亢進、運動学習能低下、ワーキングメモリー低下が明らかになりました。また、水迷路テストでは、空間学習能は正常でしたが、逆転学習能の低下が見出され、認知記憶能の柔軟性の低下が示唆されました。これらの結果は、知的機能の低下、適応能力の低下に相当すると考えられます。RP58ハプロ不全患者では、軽度から重度の知的障害、運動発達遅延、注意欠陥多動性障害、自閉的行動、常同行動などを示します。本モデルマウスは、患者で見られる症状とおおむね共通と想定される行動特性を示すことから、本疾患のモデルマウスとして妥当と考えられます。
(3)作製したモデルマウスは、グルタミン酸シグナル伝達の異常を示しました
大脳皮質のウエスタンブロット解析により、AMPA受容体GluA1-4の中でGluA1のみ半減しています。NMDA受容体では、GluN1及びGluN2Bには変化はなく、成熟したスパインに発現するGluN2Aは半減していました。一方、多くのニューロンに存在するNeuN、グルタミン酸作動性シナプス後部に存在する足場タンパク質Homer、シナプス前部に存在するVGluT1に変化はありませんでした。
さらに、上記の脳のシナプス機能を解析し、NMDA受容体応答不全、シナプス長期増強の飽和度の低下を見出しました。具体的には、海馬のスライスを作製し、CA1錐体細胞の電気生理学的解析により、AMPA受容体を介した興奮性シナプス後電位のシナプスの入力―出力関係は正常であること、また、ペアパルス比、頻回刺激による応答増強に変化はありませんでした。このことから、シナプス前部からのグルタミン酸放出に変化はないことが示されました。パッチクランプ膜電位固定法によりNMDA受容体とAMPA受容体応答の比率に変化はありませんが、NMDA受容体を介するシナプス後電流量が、最も大きくなる膜電位において、低下していることを見出しました。そこで、NMDA受容体が関与する長期増強を調べたところ、頻回刺激1回による長期増強には差がありませんが、頻回刺激を繰り返した場合、長期増強がより低率で飽和してしまうことを見出しました。これは、記憶学習の可塑性の容量が小さいことを示し、可塑性低下の基盤になっていることが示唆されます。
(4)樹状突起のスパイン形態を解析したところ、成熟スパインの形態異常が見出されました(図2)
スパインの形態を見るために一部のニューロンのみに蛍光タンパク質GFPが発現するマウス(Thy1-GFPマウス)を用いて解析しました。海馬のCA1錐体細胞のスパイン密度に変化はありませんでした。スパインの長さとヘッドの幅で4タイプにスパインを分類しても、4タイプの比率に変化はありませんでした。しかしスパインヘッドの幅の大きいタイプ(太いスパイン)同士で比較すると、RP58ヘテロマウスではスパインヘッドの幅がより小さく、スパインの長さがより短いことが明らかとなりました。一方、スパインヘッドの幅が小さいタイプ(細いスパイン)同士の比較では差はありません。スパインヘッドの幅の大きいタイプにはマッシュルーム型、スタッブ型という成熟型スパインと考えられているスパインが含まれていることから、成熟スパインの形態異常と考えられます。
社会的意義・今後の展望
RP58の発現量の不足が認知機能低下を引き起こすことが実証され、その原因として、興奮性ニューロンの興奮性シナプスのスパイン成熟不全であることが示唆されました。このことは、RP58ハプロ不全患者の認知機能障害の予防法、治療法の開発の糸口になると期待されます。しかし、RP58発現低下がどのようなメカニズムでシナプス機能不全を引き起こしているか、その機序は不明です。今後、RP58の標的遺伝子を同定することにより、その機序を解明することが希求され、その際にこのモデルマウスが有用と考えられます。
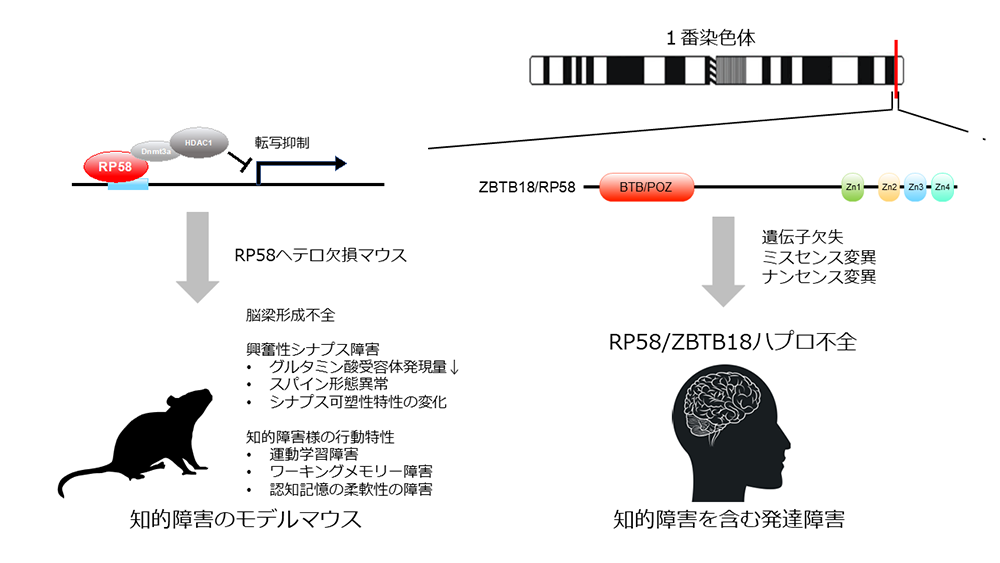
図1 知的障害のモデルマウスの確立
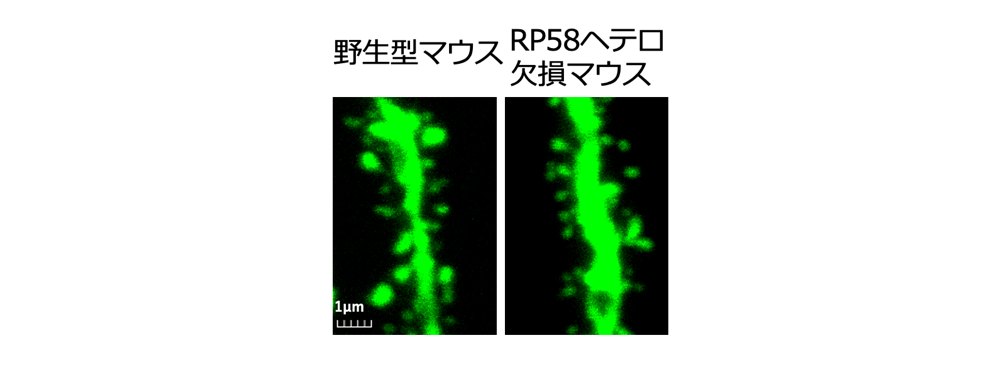
図2 スパインの形態
用語解説
(注1)RP58/ZBTB18ハプロ不全
ハプロ不全(haploinsufficiency)とは、正常な単一アリルのみからの遺伝子発現量では効果が不足し、正常な機能を維持することができないことによる疾患。RP58/ZBTB18の正常な遺伝子産物(タンパク質やRNA)の量的不足に起因し、遺伝形式は顕性遺伝(優性遺伝)となる。多くは遺伝ではなく、親の生殖細胞や受精後に新たに発生した個体レベルで生じる突然変異(de novo変異)による。
(注2)1q43-44微小欠失症候群
サブテロメア微細欠失症候群の一つである。脳梁異常、筋緊張低下、小頭症、成長障害及び多様な顔面異形を頻繁に併発する知的発達障害を特徴とする。常染色体顕性(優性)知的発達障害22 (MRD22) であり、1q43-44 領域のZBTB18(別名RP58, ZNF238)遺伝子、AKTセリン/スレオニンキナーゼ3(AKT3)遺伝子、ヘテロ核リボヌクレオタンパク質U (HNRNPU)遺伝子、CEP170遺伝子等のハプロ不全が原因と考えられる。
本研究は、当研究所の旧神経細胞分化プロジェクト、睡眠プロジェクト、脳代謝制御グループ、脳神経回路形成プロジェクト、体内時計プロジェクト及び国立精神神経医療研究センター、神奈川県立こども医療センター臨床研究所、日本大学歯学部との共同研究です。
原著論文
<論文名>
” The mouse model of intellectual disability by ZBTB18/RP58 haploinsufficiency shows cognitive dysfunction with synaptic impairment “
<発表雑誌>
Molecular Psychiatry
DOI: 10.1038/s41380-023-01941-3
URL: https://www.nature.com/articles/s41380-023-01941-3
本研究の主な助成事業
日本学術振興会(JSPS)科学研究費基金・基盤研究(B)「脳高次機能の発達と老化の制御に共通する分子機構の解明」(18H02537)、「脳老化を抑制する転写抑制因子RP58とそのメカニズムの解析」(22H02729)(以上、岡戸)、(19K08033, 18KK0442), and Intramural Research Grant (3-1) for Neurological and Psychiatric Disorders provided by the National Center of Neurology and Psychiatry, Japan (以上、三輪) の支援を受けました。
お問い合わせ先
(研究に関すること)
睡眠プロジェクト:岡戸晴生 シニア研究員
(東京都医学総合研究所に関すること)
事務局研究推進課
(国立精神・神経医療研究センターに関すること)
総務課 広報室