2023-04-22 生理学研究所
国立大学法人 東海国立大学機構 名古屋大学大学院医学系研究科分子細胞学分野の客員研究者 橋本明香里(公立陶生病院 研修医:神戸大学医学部卒業)、和氣弘明 教授の研究グループは、早期視覚喪失がもたらす触覚機能向上のメカニズムを明らかにしました。
私たちは目や手、耳といった様々な感覚情報を用いて自分の周囲の状況を感知します。視覚情報は後頭部にある視覚野で、触覚(体性感覚)は頭頂部にある体性感覚野で、聴覚情報は側頭部にある聴覚野で、といったように、それぞれの情報はそれぞれの「専門部位」で主に情報処理されます。では目が見えなくなった人では視覚野は機能しなくなってしまうのか、というとそうではありません。視覚情報を失った視覚野は、代わりに他の種類の感覚情報、つまり聴覚や体性感覚情報を処理するようになり、その結果、聴覚や触覚が鋭敏になる、という「異種感覚間可塑性」と呼ばれる現象が生じます。この現象は1990年代に提唱され、広く知られています。先天盲のヒトが点字を読む時は、それが触覚にも関わらず体性感覚野のみならず視覚野が活性化され、実際に見る感覚で字を読むことが示唆されています。しかし、その詳細なメカニズムはまだわかっていませんでした。本研究グループは、脳内のグリア細胞の一つであるミクログリアに着目してこのメカニズムの一端を解明しました。
私たちの脳は1000億個以上の神経細胞と、その約10倍もの数のグリア細胞(注1)から成り立っています。神経細胞は電気信号を用いて情報伝達や情報処理を行い、グリア細胞は神経回路の形成や情報伝達の調節、神経細胞への栄養の運搬などの役割を担っています。中でもグリア細胞の一つ、脳内の免疫細胞として知られるミクログリアは、常に突起を進展退縮させながら、神経細胞同士の接続部「シナプス」(注2)を監視、形成、除去することで神経回路の形成や精緻化、障害時の再編成に寄与する機能を持っていることが近年知られてきました。とりわけミクログリアの興奮性シナプスに対する作用はよく知られ、発達期および障害からの回復期ではこれらの形成・除去を行うことで機能的な神経回路を形成することが知られています。その一方で抑制性シナプスへの関与は未だ解明が進んでいません。
本研究では2光子生体イメージング(注3)、電子顕微鏡(注4)、電気生理学的手法(注5)、分子生物・遺伝学的手法などの様々なアプローチ方法を用いて、視覚遮断後のマウスの高次視覚野(注6)がヒゲ刺激による体性感覚情報に応答し、ヒゲ感覚識別能力が向上するメカニズムを明らかにしました。生まれて間もない時期に視覚遮断を受けると、マウスの高次視覚野では、ミクログリアによる抑制性シナプスの除去が亢進し、潜在的に存在していた体性感覚野から高次視覚野への伝達経路の抑制システムが解き放たれることで、高次視覚野の神経細胞がヒゲ刺激に応答するようになり、さらにそれが機能向上につながることを解明しました。またこの際にミクログリアが、細胞の外に存在する細胞外基質(注7)と呼ばれる足場をマトリックスメタロプロテアーゼ9(注8)という分子によって溶かすことで抑制性シナプスを剥がすという機序を明らかにしました。つまり、ミクログリアがストッパーを外すことによって脳が「専門外」の情報を処理するようになる、というイメージです。
近年、健常人においても視覚だけでなく聴覚や体性感覚刺激が高次視覚野の神経活動に影響を及ぼしうることが知られており、高次視覚野は感覚統合の観点でも注目されています。今回の研究で高次視覚野における体性感覚情報処理システムとミクログリアによる制御が解明されたことで、脳の多種感覚情報統合・分別にかかわる新たなメカニズムの提唱にもつながる可能性があります。さらに自閉スペクトラム症(注9)では抑制性シナプスの減少や感覚統合の障害が報告されており、こういった精神神経疾患での新たな治療ターゲットにもなりえることが示唆されます。
尚、本研究は大阪大学大学院生命機能研究科心生物学研究室の八木健 教授、足澤悦子 助教、特別研究員 河村菜々実、自治医科大学医学部解剖学講座組織学部門の大野伸彦 教授の協力および、New South Wales大学のAndrew J Moorhouse博士、マウントサイナイ医科大学のAnne Schaefer博士との国際共同研究によって行われました。本研究成果は、2023 年 4月21日(金)付で米国科学誌「Cell Reports」にオンライン掲載されました。
ポイント
- 先天的に視覚遮断されているマウスの高次視覚野は、体性感覚刺激に対する神経活動応答が増加し、その結果体性感覚の機能が向上する
- 生理的に存在する体性感覚野から高次視覚野への情報伝達経路を抑制するシステムをミクログリアが除去することで、視覚遮断後の高次視覚野の体性感覚に対する神経応答の増加がもたらされる
- この抑制システムの除去は、ミクログリアがマトリックスメタロプロテアーゼ9により細胞外基質を溶かし、抑制性シナプスを剥がすことで誘引される
1. 背景
私たちは目や手、耳といった様々な感覚情報を用いて自分の周囲の状況を感知します。視覚情報は後頭部にある視覚野で、触覚(体性感覚)は頭頂部にある体性感覚野で、聴覚情報は側頭部にある聴覚野で、といったように、それぞれの情報はそれぞれの「専門部位」で主に情報処理されます。では目が見えなくなった人や動物では視覚野は機能しなくなってしまうのか、というとそうではありません。視覚情報を失った視覚野は、代わりに他の種類の感覚情報、つまり聴覚や体性感覚情報を処理するようになり、その結果聴覚や触覚が鋭敏になる、という「異種感覚間可塑性」と呼ばれる現象があります。この現象は1990年代に提唱され広く知られています。先天盲のヒトが点字を読む時は、それが触覚にも関わらず体性感覚野のみならず視覚野が活性化され、実際に見る感覚で字を読むことが示唆されています。同様のことがマウスでも知られており、視覚遮断後のマウスの視覚野はヒゲ刺激(マウスのヒゲは、ヒトの手にあたる重要な体性感覚情報)により活動を示すことが知られています。しかし、その詳細なメカニズムはまだわかっていませんでした。
2. 研究成果
本研究では脳内のグリア細胞の一つであるミクログリアに着目して異種感覚間可塑性のメカニズムの一端を解明しました。脳内の免疫細胞として知られるミクログリアは、常に突起を進展退縮させながら、神経細胞同士の接続部「シナプス」を監視、形成、除去することで神経回路の形成や精緻化、障害時の再編成に寄与する機能を持っていることが近年分かってきています。今回研究グループは、2光子生体イメージング、電子顕微鏡、電気生理学的手法、分子生物・遺伝学的手法などの様々なアプローチ方法を用いて、視覚遮断後のマウスの高次視覚野がミクログリアの助けを受け、ヒゲ刺激による体性感覚情報に応答し、ヒゲ感覚識別能力が向上するメカニズムを明らかにしました。生まれて間もない時期に視覚遮断を受けると、マウスの高次視覚野にあるミクログリアが抑制性シナプスを除去し、潜在的に存在していた体性感覚野から高次視覚野への伝達経路の抑制システムを解き放つことで、高次視覚野の神経細胞はヒゲ刺激に応答するようになること、さらに、それが機能向上につながることを解明しました。またこの際にミクログリアは細胞外基質と呼ばれる細胞の外に存在する足場をマトリックスメタロプロテアーゼ9という分子によって溶かすことで抑制性シナプスを剥がすことを明らかにしました。
(1) 一次体性感覚野から高次視覚野への情報伝達経路はヒゲ刺激により活動応答を示す
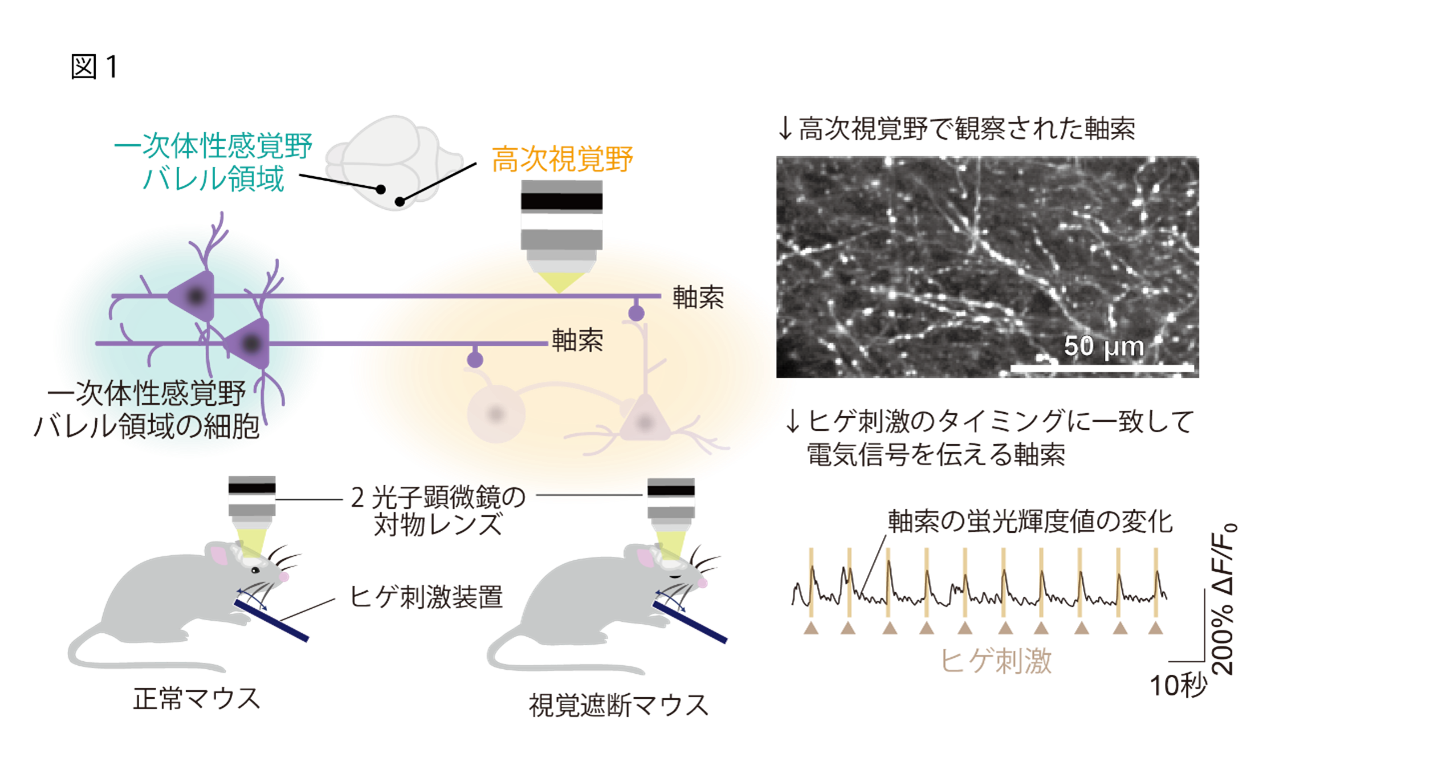
はじめに研究グループは、マウスのヒゲ情報処理を担う一次体性感覚野バレル領域(注10)からAL領域と呼ばれる高次視覚野の一部の領域に軸索(注11)投射が存在することを発見し、この皮質間の軸索投射がヒゲ刺激情報を高次視覚野に伝達する可能性を検証しました。生きたマウスの神経活動をライブイメージングできる2光子顕微鏡下の生体カルシウムイメージング(注12)を用いて、この軸索の神経活動を観察しました。本研究では開眼して間もない生後2週間のタイミングで片目を遮断する処置を行ったマウスを視覚遮断モデルマウスとして使用しました。軸索のカルシウムイメージングの結果、正常マウスでも視覚遮断モデルマウスでも同等にヒゲ刺激に強く応答する神経活動を示すことが明らかになりました。(図1)
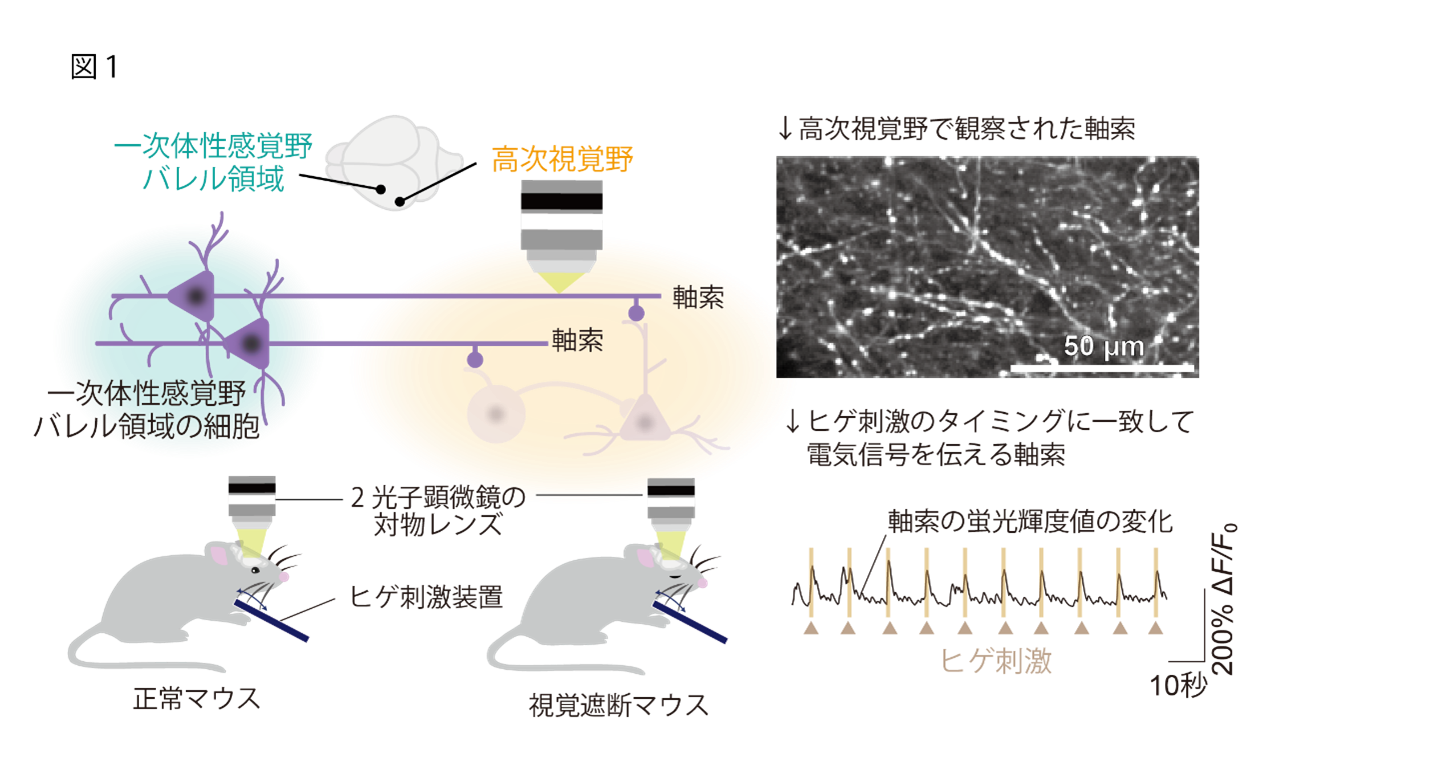
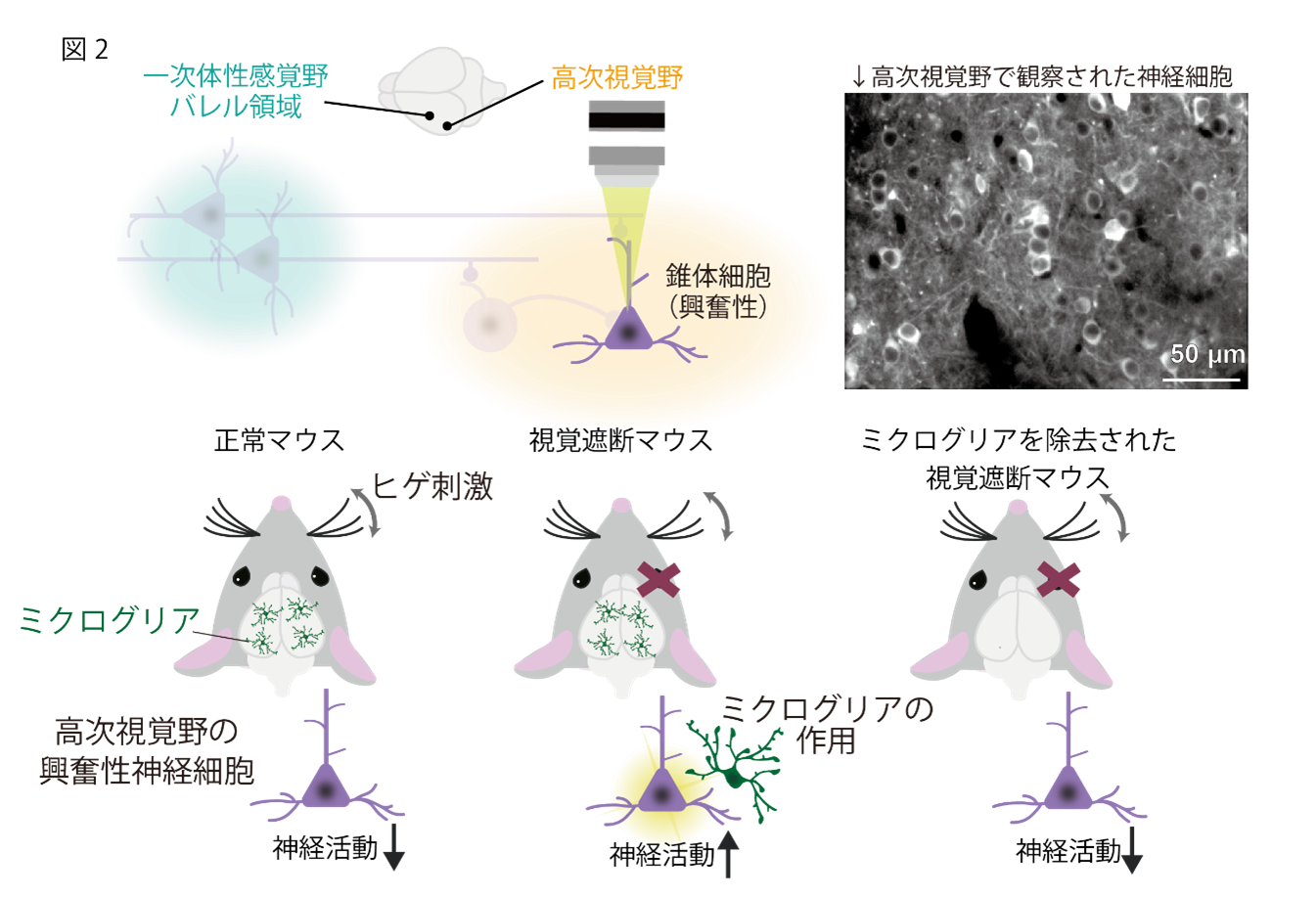
(2) ヒゲ刺激を受けると、正常時の高次視覚野の神経活動は抑制されるが、視覚遮断によりその活動が増加する
次にヒゲ刺激時の高次視覚野の神経活動を生体カルシウムイメージングで観察しました。正常のマウスでは紙やすりでヒゲを刺激した時に神経活動が自発活動(ヒゲ刺激を受けていない定常状態の神経活動)に比べて抑制される様子が観察されました。その一方、視覚遮断を受けたマウスは、正常マウスに比べて、ヒゲ刺激時に高い神経活動応答を示しました。さらにPLX3397(注13)という薬剤を用いてミクログリアを除去すると、視覚遮断後の神経活動は抑制されることが分かりました。この結果より、ミクログリアによって高次視覚野の神経回路再編が誘導されることが想定されました(図2)。
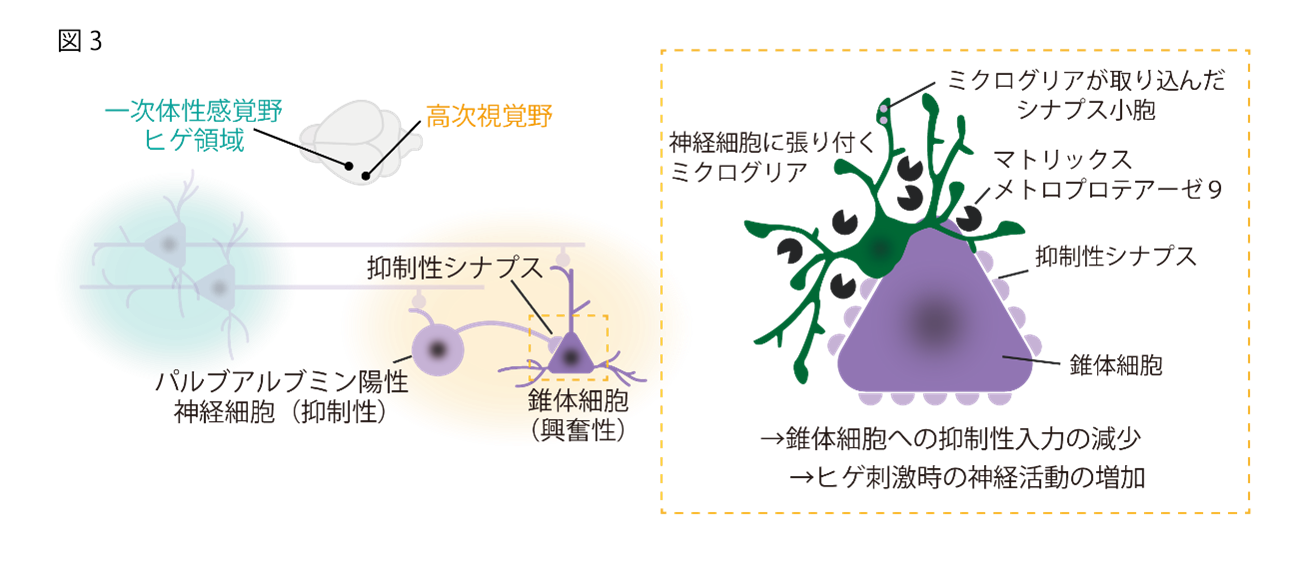
(3) 視覚遮断後、ミクログリアは細胞外基質を溶かして抑制性シナプスを剥がし、興奮性神経細胞への抑制性入力を減少させる
先ほどの結果より、ミクログリアが視覚遮断後の高次視覚野の神経回路再編に何らかの役割を担っていることが予想されました。そこで研究グループは視覚遮断後のミクログリアのシナプスへの関与に着目しました。視覚遮断から5日後のマウスの脳では、ミクログリアが抑制性シナプスを取り込んでおり、その結果、全体として抑制性シナプスが減少していることが観察されました。さらに、ミクログリアが興奮性の錐体細胞(注14)の細胞体を包み込むように密着し、パルブアルブミン陽性神経細胞(注15)由来の抑制性シナプス入力を剥がしとっている様子も確認できました。
電気生理学的な手法でも視覚遮断による抑制性入力の低下が証明されました。バレル領域にチャネルロドプシン(注16)を強制発現させた高次視覚野での神経細胞の光刺激に対する応答を確認することにより、バレル領域からの投射を受ける高次視覚野の興奮性の錐体細胞と抑制性のパルブアルブミン陽性神経細胞を特定し、その二者間のシナプス結合の強度をpaired recordingにより確認しました。すると、パルブアルブミン陽性神経細胞から錐体細胞へのシナプス入力が視覚遮断後に低下すること、そしてこの現象はミクログリアを除去すると観察されなくなることがわかりました。
さらに視覚遮断後のミクログリアではマトリックスメトロプロテアーゼ9の発現が上昇していることが確認されました。これによりミクログリアが神経細胞体周囲の細胞外基質を溶かしてシナプス間隙に入り込んでいると考えられます。実際、マトリックスメトロプロテアーゼ9の阻害剤を投与すると高次視覚野の視覚野のヒゲ刺激に応答する神経活動が抑制されました。(図3)
(4) 視覚遮断後、高次視覚野の神経活動依存的にヒゲ感覚機能が向上する
さらに視覚遮断後のヒゲ刺激に対する高次視覚野の神経応答が、体性感覚の機能向上に寄与するのかを検証するため、研究グループは目の粗いやすりと細かいやすりをランダムに提示しその2種を正しく判別できたら報酬がもらえるような感覚訓練学習を用いました。すると、正常マウスに比較して視覚遮断マウスでは早く学習が成立しました。一方でムシモール(注17)という薬剤で高次視覚野の神経活動を局所的に抑制すると、視覚遮断マウスでの学習効率は正常マウスと同程度まで低下しました。さらにミクログリア除去の処置を行った視覚遮断マウスでも同様に学習効率の低下を認めました。これにより、視覚遮断後の高次視覚野でのミクログリアによる神経回路再編成は、残存する体性感覚の能力向上に寄与することがわかりました。
3. 今後の展開
本研究は、発達早期の視覚遮断が、ミクログリアによる高次視覚野の抑制性シナプス除去を引き起こし、体性感覚に対する神経活動応答、さらには代償的な体性感覚機能向上をもたらすことを解明しました。近年、健常人においても視覚だけでなく聴覚や体性感覚刺激が高次視覚野の神経活動に影響を及ぼしうることが分かってきており、高次視覚野は感覚統合の観点でも注目されています。今回の研究で高次視覚野における体性感覚情報処理システムとミクログリアによる制御が解明されたことで、脳の多種感覚情報統合・分別にかかわる新たなメカニズムの提唱にもつながる可能性があります。さらに自閉スペクトラム症では抑制性シナプスの減少や感覚統合の障害が報告されており、こういった精神神経疾患での新たな治療ターゲットにもなりえることが示唆されます。
4. 研究助成
本研究は、日本学術振興会科研費の基盤研究B(課題番号:JP21H02662・JP18H02598 [和氣])、学術変革領域 A(JP20H05699 [和氣])、 JSTCREST (課題番号:JPMJCR1755 ホログラム光刺激による神経回路再編の人為的創出[和氣] とJPMJCR22P6 生体マルチセンシングシステムの究明と活用技術の創出[和氣])、国際共同研究加速基金(JP20KK0170 [和氣])の助成 を受けたものです。 また拠点形成事業、先端バイオイメージング支援プラットフォームの支援を受けて行われました。
5. 用語説明
(注1)グリア細胞:脳内の細胞は、神経細胞とグリア細胞に分類される。グリア細胞は神経細胞の隙間を埋める糊やセメントのような存在だと考えられていたが、近年、神経回路の形成や情報伝達の調節、神経細胞を栄養するなどの多彩な役割を持つことが明らかになっている。グリア細胞には大きく分けて、ミクログリア、アストロサイト、オリゴデンドロサイトがある。
(注2) シナプス:神経細胞間や筋繊維に形成される、シグナル伝達などの神経活動にかかわる接続部位。神経細胞同士はシナプスで結合し、シナプス前終末から放出された神経伝達物質がシナプス後部の受容体に結合することで化学的な信号伝達が行われる。脳にはグルタミン酸を介して細胞を興奮させる作用を持つ興奮性シナプスと、GABAを介して細胞の活動を抑制させる抑制性シナプスが存在する。
(注3)2光子生体イメージング:2光子顕微鏡を用いて、生きたままの動物の神経細胞の活動を観察する方法。2光子顕微鏡は赤外線レーザーを使用するため組織透過性が高く、非侵襲的に生体深部を観察できるという特性を持つ。
(注4)電子顕微鏡:加速した電子を試料に照射することにより、高倍率での観察が行える顕微鏡。本研究ではナノメートルレベルの分解能でX,Y,Zの広視野のイメージングが可能なシリアルブロックフェイス走査電子顕微鏡法を用い、高解像度の三次元画像を取得した。
(注5)電気生理学的手法:神経、脳、筋肉、心臓などの組織または細胞の電気的性質と生理機能との関係を解明する手法。本研究で用いた脳スライスのpaired recording(dual whole-cell clamp recording)では、単一細胞から単一細胞へのシナプス伝達の特性を詳細に解析することができる。
(注6)高次視覚野:目から入った視覚情報は、物体像の輪郭の抽出などが行われる大脳皮質の一次視覚野に伝えらえる。一次視覚野を経由した視覚情報は、高次視覚野において色の処理や物体像に含まれる図形特性の検出など、より高度な処置が行われる。マウスの大脳皮質視覚野には9つの高次視覚野が存在している。
(注7)細胞外基質(細胞外マトリックス, ECM):細胞と細胞の間に存在し、組織の支持体となる。ヒアルロン酸やコンドロイチン硫酸プロテオグリカンが代表的な細胞外基質である。近年、細胞外基質がシナプス新生や可塑性の制御といった機能を持っていることが報告された。
(注8)マトリックスメタロプロテアーゼ9:細胞外基質タンパク質のリモデリングの役割を持つ酵素の一つ。脳ではミクログリアやマクロファージによる遺伝子発現がメインを占めている。
(注9)自閉スペクトラム症(ASD;Autism Spectrum Disorder):社会的コミュニケーション障害と常同行動・限定的興味行動の2つを中核症状とした神経発達障害。ASD病態の原因のひとつとして、神経細胞のシナプス機能の異常、特に興奮性―抑制性のバランス(E/I balance)の変質が考えられている。
(注10)バレル領域:げっ歯類に特徴的な、ヒゲからの触覚情報を処理する一次体性感覚野の領域の一つ。げっ歯類の多くは夜行性のためヒゲを私たちの指のように動かし周囲に触れることで触覚情報を得ているため、ヒゲ感覚情報を担う脳部位が非常に発達している。ヒゲ一本一本にあたる部分が個別の領域を持っており、特定の染色でその領域を観察すると樽(バレル)のように見えるため、バレル領域と呼ばれる。
(注11)軸索:神経細胞の細胞体から伸びる細い突起で、次の神経細胞にシナプスを形成し(=軸索投射)、情報を伝えるための構造。
(注12)生体カルシウムイメージング:神経発火に伴い神経細胞内のカルシウムイオン濃度が上昇することを利用し、蛍光カルシウムセンサーで神経活動を光の強度として可視化する手法。
(注13)PLX3397 (Pexidartinib):colony stimulating factor-1受容体(CSF1R)拮抗薬。CSF1Rは主に、単球/マクロファージ系列の細胞の生存・分化・増殖に関与するサイトカインであるコロニー刺激因子1の受容体であり、中枢神経ではミクログリアに強く発現している。PLX3397の投与により脳内のミクログリアは速やかに消失するが、投与を終えると1週間程度でミクログリアは再増殖する。
(注14)錐体細胞:大脳皮質の主要な興奮性神経細胞。グルタミン酸を神経伝達物質としている。数多くの抑制性神経細胞が錐体細胞の様々な部位に抑制性シナプスを形成して、その活動を制御していることが知られている。
(注15)パルブアルブミン陽性神経細胞:局所の神経活動を調整する抑制性神経細胞のサブタイプであり、パルブアルブミン蛋白を発現する。近傍の錐体細胞の細胞体に投射し強力な抑制性シナプスを形成しそれらの発火のタイミングを制御するという特徴を持つ。
(注16)チャネルロドプシン:緑藻植物のクラミドモナスから単離された光駆動性の陽イオンチャネル。青色の光が当たると外部から陽イオン(ナトリウムイオンなど)を細胞内に通す。神経細胞に強制発現させ、青色光を照射すると、ナトリウムイオンが細胞内に流入し、脱分極により神経細胞が興奮することから、特定の神経細胞の活動を制御するために使用されている。
(注17)ムシモール:毒キノコのテングタケが持つ毒素の一種で、GABAと構造が類似し、GABA-Aサブタイプ受容体を活性化して神経活動を抑制する。脳の注入した範囲に限局して脳活動を抑制できるため、神経生理学研究で広く用いられる。
6. 発表雑誌
掲載誌名:Cell Reports
論文タイトル:Microglia Enable Cross-Modal Plasticity by Removing Inhibitory Synapses
著者・所属
Akari Hashimoto1, Nanami Kawamura2, Etsuko Tarusawa2, Ikuko Takeda1, Yuki Aoyama1, Nobuhiko Ohno3,4, Mio Inoue1, Mai Kagamiuchi1, Daisuke Kato 1, Mami Matsumoto5,6, Yoshihiro Hasegawa1, Junichi Nabekura7,13, Anne Schaefer8,9, Andrew J Moorhouse10, Takeshi Yagi2, and Hiroaki Wake1,11,12,13,14*
(*Corresponding author)
1. Department of Anatomy and Molecular Cell Biology, Nagoya University Graduate School of Medicine, Nagoya, 466-8550, Japan.
2. KOKORO-Biology Group, Laboratories for Integrated Biology, Graduate School of Frontier Biosciences, Osaka University, Osaka, 565-0871, Japan.
3. Department of Anatomy, Division of Histology and Cell Biology, Jichi Medical University, Tochigi, 329-0498, Japan.
4. Division of Ultrastructural Research, National Institute for Physiological Sciences, Okazaki, 444-8585, Japan.
5. Section of Electron Microscopy, Supportive Center for Brain Research, National Institute for Physiological Sciences, Okazaki, 444-8585, Japan.
6. Department of Developmental and Regenerative Neurobiology, Institute of Brain Science, Nagoya City University Graduate School of Medical Sciences, Nagoya, 467-8601, Japan.
7. Division of Homeostatic Development, National Institute for Physiological Sciences, Okazaki, 444-8585, Japan.
8. Center for Glial Biology, Department of Neuroscience and Psychiatry, Friedman
Brain Institute, Icahn School of Medicine at Mount Sinai, New York, 10029-6574, US.
9. Max Planck Institute for Biology of Ageing, Cologne, 50931, Germany
10. School of Biomedical Sciences, The University of New South Wales, Sydney, 2052, Australia.
11. Division of Multicellular Circuit Dynamics, National Institute for Physiological Sciences, Okazaki, 444-8585, Japan.
12. Center for Optical Scattering Image Science, Kobe University, Kobe, 657-8501, Japan.
13. Department of Physiological Sciences, Graduate University for Advanced Studies, SOKENDAI, Hayama, 240-0193, Japan.
14. Core Research for Evolutional Science and Technology, Japan Science and Technology Agency, Saitama, 332-0012, Japan.
DOI:10.1016/j.celrep.2023.112383
お問い合わせ
<研究に関すること>
名古屋大学大学院医学系研究科 機能形態学講座分子細胞学
教授 和氣 弘明
自然科学研究機構 生理学研究所 多細胞回路動態研究部門
教授(兼任) 和氣 弘明
<JST事業に関して>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子
<報道対応>
名古屋大学医学部・医学系研究科 総務課総務係
自然科学研究機構 生理学研究所 研究力強化戦略室
科学技術振興機構 広報課