2018/08/20 京都大学
1. 概要
京都大学iPS細胞研究所は京都大学医学部附属病院と連携し、「「血小板輸血不応症を合併した再生不良性貧血」患者を対象とするiPS細胞由来血小板の自己輸血に関する臨床研究」を計画してきました。平成30年7月20日に、厚生労働大臣に、本研究に係る再生医療等提供計画を提出しましたので、下記のとおり発表いたします。
なお、厚生科学審議会における審議の結果、計画を変更する可能性がありますので、ご承知おき願いします。
2. 背景
再生不良性貧血などで血小板が不足すると、血小板輸血が行われます。しかし、輸血後も血液中の血小板数が上昇しない、血小板輸血不応になる場合があります。その原因の一つに、輸血血小板が異物として認識され、自身の免疫細胞が輸血血小板を破壊することがあります。血小板輸血不応の場合、輸血により血小板を補うことができません。患者さん自身の細胞から作製した血小板であれば、自身の免疫細胞に破壊されず輸血の効果が得られると期待できます。
3. 経過
| 平成30年5月28日 | 京都大学特定認定再生医療等委員会より承認 |
|---|---|
| 平成30年7月20日 | 厚生労働大臣に再生医療等提供計画を提出 |
| 平成30年8月29日(予定) | 厚生科学審議会 再生医療等評価部会にて初回審議 |
4. 臨床研究計画の概要
(1) 試験名
「血小板減少症に対するiPS細胞由来血小板の自己輸血に関する臨床研究」
(2) 目的
再生不良性貧血で、かつ血小板輸血不応症を併発している特定の患者の末梢血単核球から作製するiPS細胞を経由して誘導される血小板を当該患者に投与し、iPS細胞由来血小板製剤の安全性について検証を行う。
(3) 試験デザイン
単施設非盲検非対照試験/単回投与用量漸増試験
(4) 評価項目
| 主要評価項目 | 安全性(有害事象の発生頻度と程度) |
|---|---|
| 副次評価項目 | 有効性(補正血小板増加数) |
(5) 対象疾患
血小板輸血不応症を合併した再生不良性貧血
(6) 対象被験者数
1例
(7) 観察期間
血小板輸血後1年間
(8) 臨床研究参加の募集
安全性の評価が主目的であり、限定された症例(数)に対し実施するため、募集は行いません。
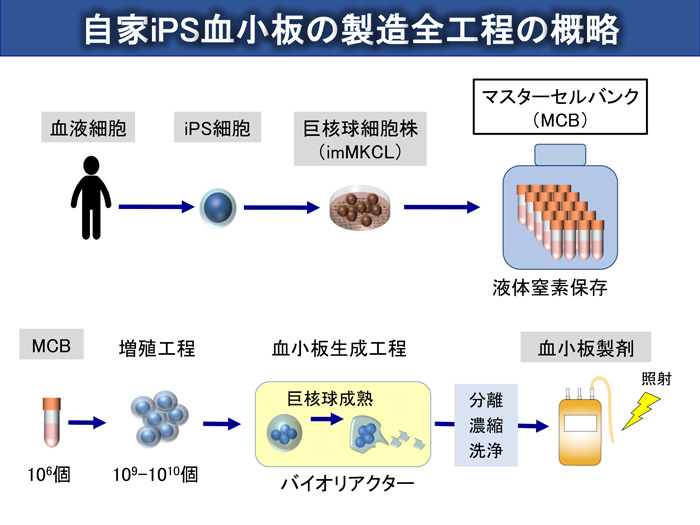
(9) 血小板輸血までの流れ
患者さんから細胞を採取し、iPS細胞を作製します。その細胞から、巨核球細胞株を作り出し、マスターセルとして凍結保存します。このマスターセルを解凍し、培養液中で巨核球を増殖させたのち、血小板産生を行います。分離・濃縮・洗浄したのち、放射線照射により増殖できる細胞を除去した上で患者さんへの輸血に使用します。

5. 臨床研究実施体制
〇 研究開発(製造)責任者:
京都大学iPS細胞研究所 臨床応用研究部門 江藤浩之 教授
〇 実施責任医師:
京都大学医学部附属病院 血液内科 髙折晃史 教授
〇 実施診療科/部門:
京都大学医学部附属病院 血液内科、輸血細胞治療部
被験者選定、輸血実施、重篤な有害事象報告、症例報告書作成および報告、
モニタリング、データマネジメント、統計解析
〇 臨床研究協力機関:
京都大学iPS細胞研究所
iPS細胞由来の血小板の製造、品質管理
6. 本研究への支援
本臨床研究は、下記機関より支援を受けて実施されます。
- 国立研究開発法人 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム 再生医療の実現化ハイウェイ
「iPS細胞技術を基盤とする血小板製剤の開発と臨床試験」 - 国立研究開発法人 日本医療研究開発機構(AMED)
再生医療実用化研究事業「自家iPS細胞由来血小板製剤の安全性有効性検証臨床研究」