2023-10-19 東京大学
発表のポイント
- ひも状のタンパク質は、特定の形をつくることで機能を発揮します。その仕組みを正確に予測可能な物理学理論の開発に成功しました。これは最新のAIにも解けない難問でした。
- 開発した予測法は、タンパク質が特定の形へと折りたたまれていく経路を示す「地図」を効率的に描くことができ、大きさや形に関わらず、多様なタンパク質に対して汎用的に利用可能です。
- 本研究の成果は、タンパク質の動きを予測するAIの開発、医療用タンパク質や産業用酵素の新規設計、およびタンパク質の工業生産プロセスの開発などへの応用が期待されます。
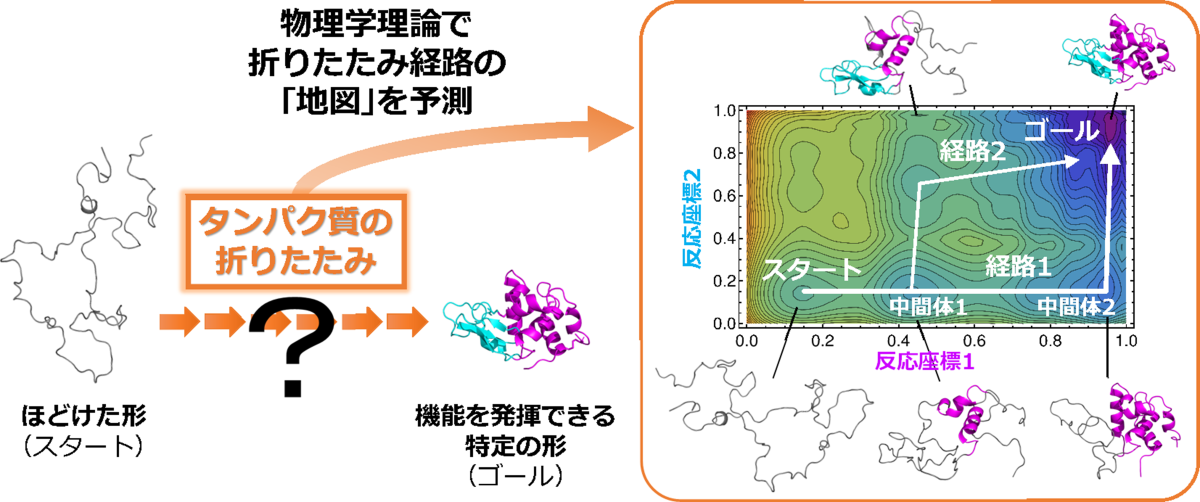
タンパク質の折りたたみ経路を示す「地図」の予測
発表概要
東京大学大学院総合文化研究科・教養学部の大岡紘治特任助教と新井宗仁教授の研究グループは、タンパク質がどのようにして特定の形をつくるのかを正確に予測する物理学理論を開発しました。
タンパク質は生命維持に重要な働きをする長いひも状の分子であり、医療や産業にも利用されています。多くのタンパク質は伸びてほどけた形ではなく、らせん状やひだ状の形へと折りたたまれて初めて機能を発揮できます。しかし、タンパク質が特定の形をつくる仕組みの解明は長年の未解決課題であり、タンパク質の形を予測できる最新のAI「AlphaFold 2」にも解けない難問でした。
研究グループは、物理学の一分野である統計力学の理論を新たに構築することで、タンパク質が特定の形へと折りたたまれていく経路を示す正確な「地図」を効率的に描くことに成功し、20年来の難問を解決しました。開発した予測法は、タンパク質の大きさや形に関わらず、多様なタンパク質に対して汎用的に利用可能です。また、ジスルフィド結合(注1)という架橋を持つ複雑なタンパク質が正しい形をつくるプロセスについても、実験結果を再現できました。
本研究の成果は今後、タンパク質の動きを予測するAIの開発につながると期待されます。さらに、医療用タンパク質や産業用酵素の新規設計、および正しく折りたたまれたタンパク質を工業的に大量生産するプロセスの開発などへの応用も期待されます。
発表内容
〈研究の背景〉
私たちの体は、約2万種類のタンパク質によってつくられています。それらのタンパク質は、筋肉、臓器、毛髪、骨、皮膚などを構成するほか、体に必要な物質をつくる酵素や、ウイルス感染を防ぐ抗体などとして、生命維持に重要な働きをしています(図1)。また、このようなタンパク質の特性を利用して、さまざまな医薬品や産業用酵素が開発されています。
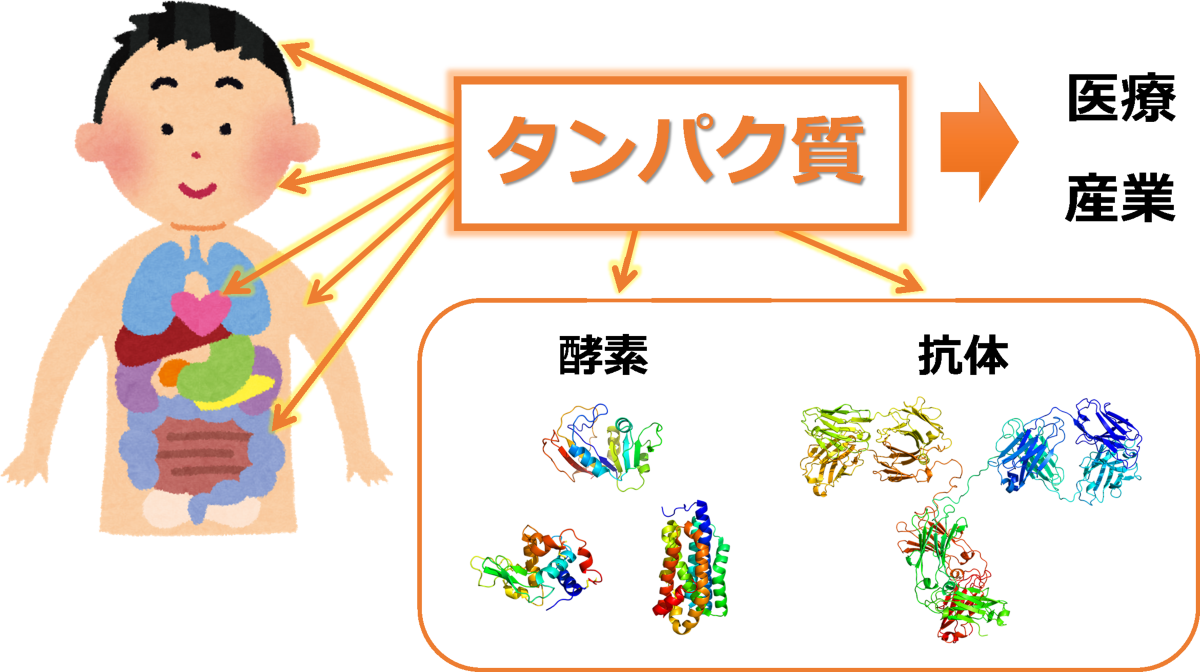
図1:タンパク質は私たちの体の基本的な材料であり、医療や産業にも利用されている
タンパク質は20種類のアミノ酸が平均して数百個つながった長いひも状の高分子であり、体内で作られたばかりのときには伸びてほどけた形をしています(図2)。多くのタンパク質はこの状態のままでは働くことができず、アミノ酸のつながり方(アミノ酸配列)に応じて、ある部分はらせん状に、ある部分はひだ状に折りたたまれ、それらが集合して特定のコンパクトな形をつくります(図2)。タンパク質はこのように特定の形に折りたたまれて初めて、生命維持に必要な機能を発揮できるようになります。したがって、タンパク質が特定の形へと折りたたまれていく仕組みの解明は、生命科学における重要課題のひとつです。最近、アミノ酸のつながり方を指定すれば、そのタンパク質がつくる形を予測できる「AlphaFold 2」というAIが開発されました。しかし、タンパク質が特定の形をつくる仕組みはAlphaFold 2にも予測不可能な難問であり、長年の未解決課題となっています。
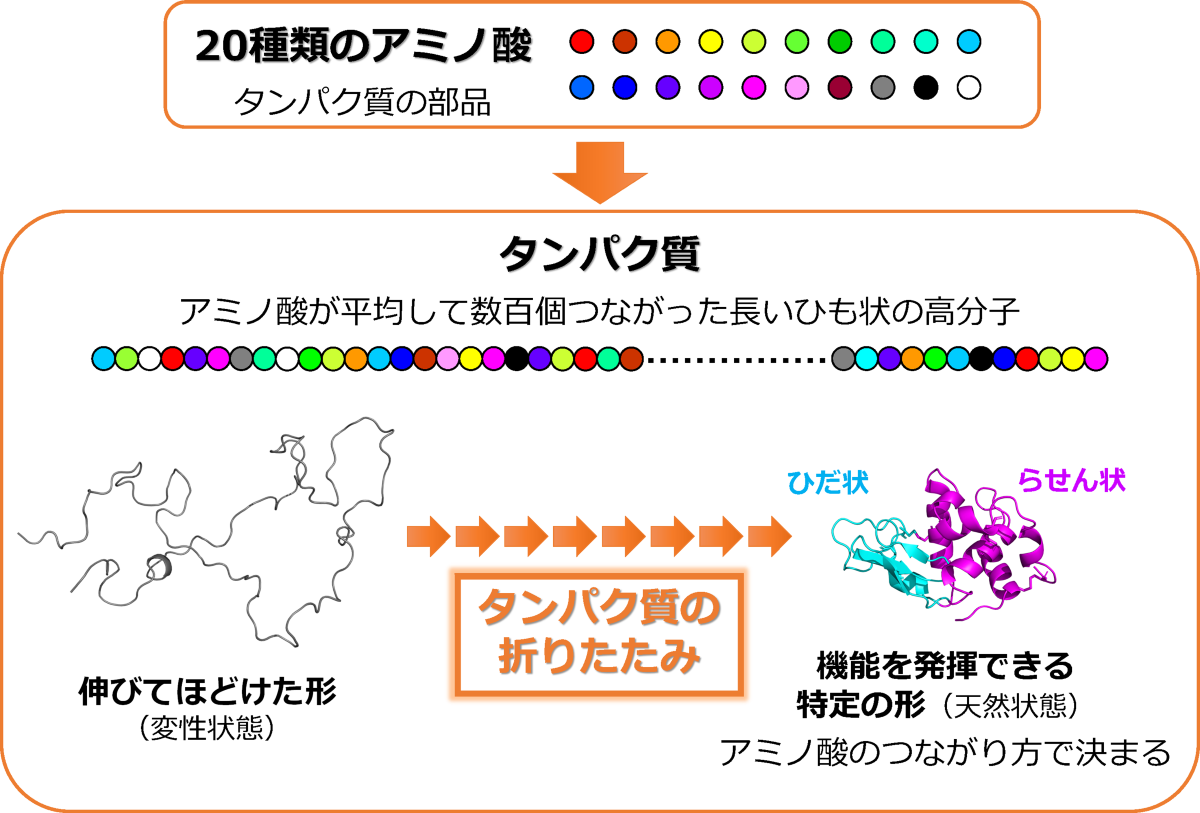
図2:タンパク質は長いひも状の高分子であり、特定の形に折りたたまれて初めて機能を発揮できる
1960年代から現在までの間に、日本も含めた世界中の研究者によって、100種類以上のタンパク質の折りたたみ反応が実験によって詳細に調べられてきました。しかし、人が持つ約2万種類のタンパク質すべてについての折りたたみ反応を調べることは困難なため、タンパク質がどのようにして特定の形をつくるのかを正確に予測できる理論の開発が必要になります。また、実験結果を理論的に説明できたときに初めて、その現象を理解できたと言うことができます。タンパク質を構成するアミノ酸の数が100個以下の小型タンパク質については、タンパク質が折りたたまれていく仕組みを予測可能な統計物理学の理論が1999年に提唱されました。この理論は、提唱者の名前をとってWako-Saitô-Muñoz-Eaton(WSME)モデルと呼ばれています。このモデルでは、タンパク質が最終的につくる形を指定すると、タンパク質がその形へと折りたたまれていく経路を示す「地図」を描くことができます。その地図の等高線は自由エネルギーという物理量に相当していることから、この地図はタンパク質の「自由エネルギー地形」と呼ばれます。タンパク質は自由エネルギーが低くなる方向へと折りたたまれていくため、山に降った雨が海へ流れていく経路を地図を見て理解できるのと同様に、タンパク質が折りたたまれていく経路や途中の形などを、タンパク質の自由エネルギー地形から包括的に予測できます。 しかし、従来のWSMEモデルでは、実験結果の細部までを正確に再現することは困難でした。また、天然に存在するほとんどのタンパク質は100個以上のアミノ酸から構成される大型タンパク質であり、それらが折りたたまれていく仕組みを正確に予測できる汎用的な理論は存在せず、その開発は20年来の難問として残されていました。
〈研究の内容〉
本研究では、小型タンパク質から大型タンパク質まで、あらゆるタンパク質の自由エネルギー地形を予測できる理論の開発という難問に挑戦しました。従来のWSMEモデルでは、隣り合うアミノ酸の間に働く力(局所的相互作用)が重視されており、「タンパク質内の2つのアミノ酸がくっついて特定の形をつくるためには、それらの間につながれたすべてのアミノ酸が特定の形に折りたたまれている必要がある」という仮定をしていました(図3a)。しかし、これまでの実験から、大型タンパク質ではこの仮定が成り立たないケースがあり、遠く離れたアミノ酸の間に働く力(非局所的相互作用)も重要なことが知られています。そこで研究グループは、WSMEモデルに非局所的相互作用も取り込むことができる新たな理論(WSME-Lモデル)を構築しました(図3b)。さらに、このモデルの厳密解を求めることにより、自由エネルギー地形を効率よく計算できる手法を開発しました。
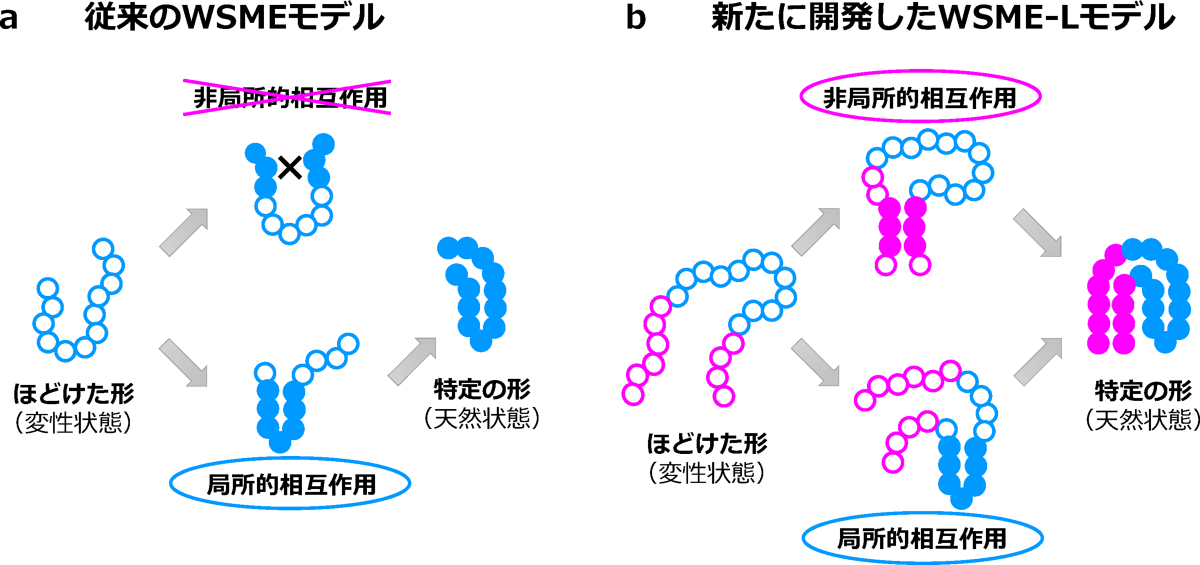
図3:従来のWSMEモデル(a)と新たに開発したWSME-Lモデル(b)の比較
タンパク質を構成するアミノ酸を丸いビーズで示してある。また、特定の形に折りたたまれたアミノ酸を●(塗りつぶした円)、折りたたまれていないアミノ酸を○(白抜きの円)で示す。従来のモデルでは、隣り合うアミノ酸の間に働く力(局所的相互作用)がタンパク質の両端に広がっていくことで特定の形がつくられるとし(水色の領域)、遠く離れたアミノ酸の間に働く力(非局所的相互作用)は考慮されていなかった。これに対し、新たに開発したモデルでは非局所的相互作用も考慮することにより、「ひも」の両端にある領域(ピンク色)が先にくっついて特定の形をつくることも可能になった。
WSME-Lモデルの有効性を検証するために、まず、いくつかの小型タンパク質にこのモデルを適用しました。その結果、従来のWSMEモデルに比べて、折りたたみ反応経路や途中の形についての予測精度が向上し、実験結果の細部までを正確に再現可能になりました。次に、WSME-Lモデルを複数の大型タンパク質に適用しました。従来のWSMEモデルでは、これらのタンパク質の折りたたみ反応経路を正しく予測できなかったのに対し(図4a)、新たに開発したWSME-Lモデルでは、実験結果と合う自由エネルギー地形を予測することに成功しました(図4b)。計算時間は、小型タンパク質についてはデスクトップPCで10秒程度、大型タンパク質ではスパコンで1時間程度でした。
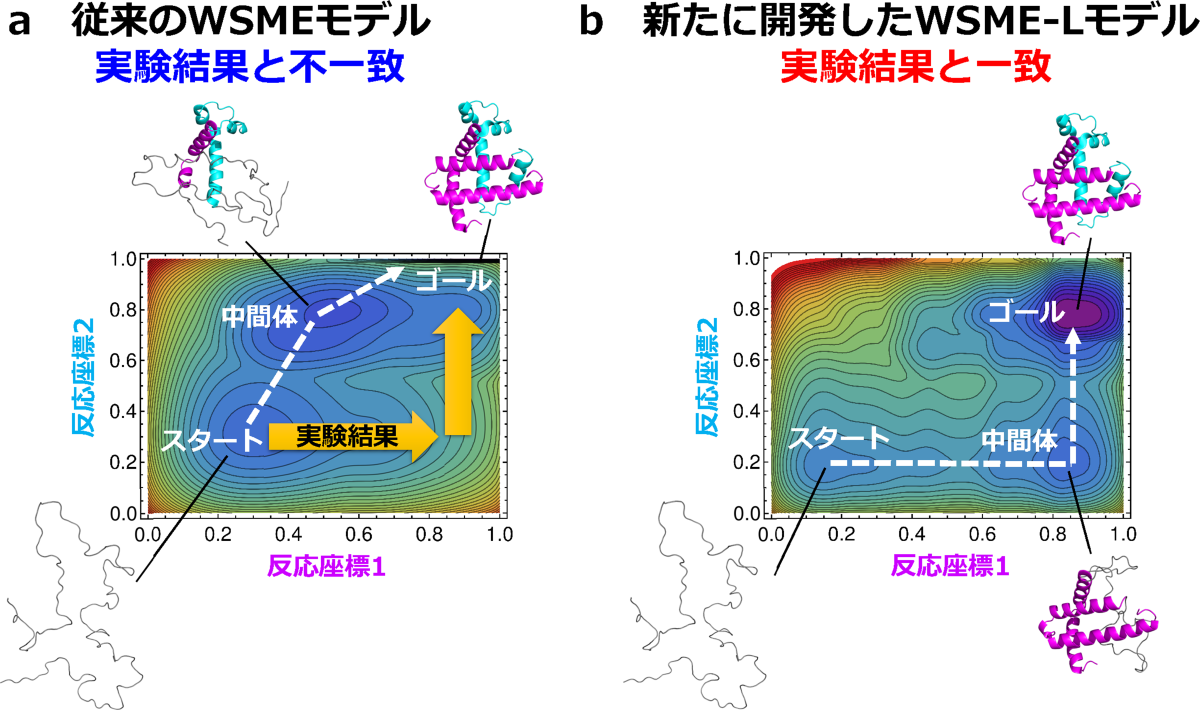
図4:大型タンパク質の折りたたみ反応経路を示す地図。従来のモデル(a)と新しいモデル(b)の比較。
アポミオグロビンの例を示す。スタートはほどけた形(変性状態)、ゴールは最終的に折りたたまれた形(天然状態)を表す。地形図の横軸はピンク色の領域が折りたたまれた割合、縦軸は水色の領域が折りたたまれた割合を示す。このタンパク質の折りたたみ実験では、地形図の右下を通る経路が観測されたが、従来のWSMEモデルは地形図の左側を通る経路を予測し、実験結果と一致しなかった(a)。これに対し、新たに開発したWSME-Lモデルは地形図の右下を通る経路を予測し、実験結果と一致した(b)。
細胞の外に分泌される多くのタンパク質(抗体など)には、ジスルフィド結合という分子内架橋が存在し、タンパク質を安定化しています。ジスルフィド結合(SS結合とも呼ぶ)が折りたたみ反応の途中でつくられる場合には反応が複雑になるため、従来のWSMEモデルでは正しく予測できませんでした。そこで本研究では、ジスルフィド結合を非局所的相互作用の一種として扱うWSME-L(SS)モデルを開発しました。このモデルによりジスルフィド結合の形成を伴う折りたたみ反応も予測可能となり、実験結果を再現できました。
ジスルフィド結合が折りたたみ反応の最初から既にできている場合には、タンパク質の形が複雑になるため、反応の予測がさらに難しくなります。研究グループは、WSME-L(SS)モデルを改良することにより、そのように複雑な反応であっても予測可能なWSME-L(SSintact)モデルを開発しました。このモデルをリゾチームの折りたたみ反応に適用したところ、実験結果(図5a)を正確に再現する地形図(図5b)を得ることに成功しました。
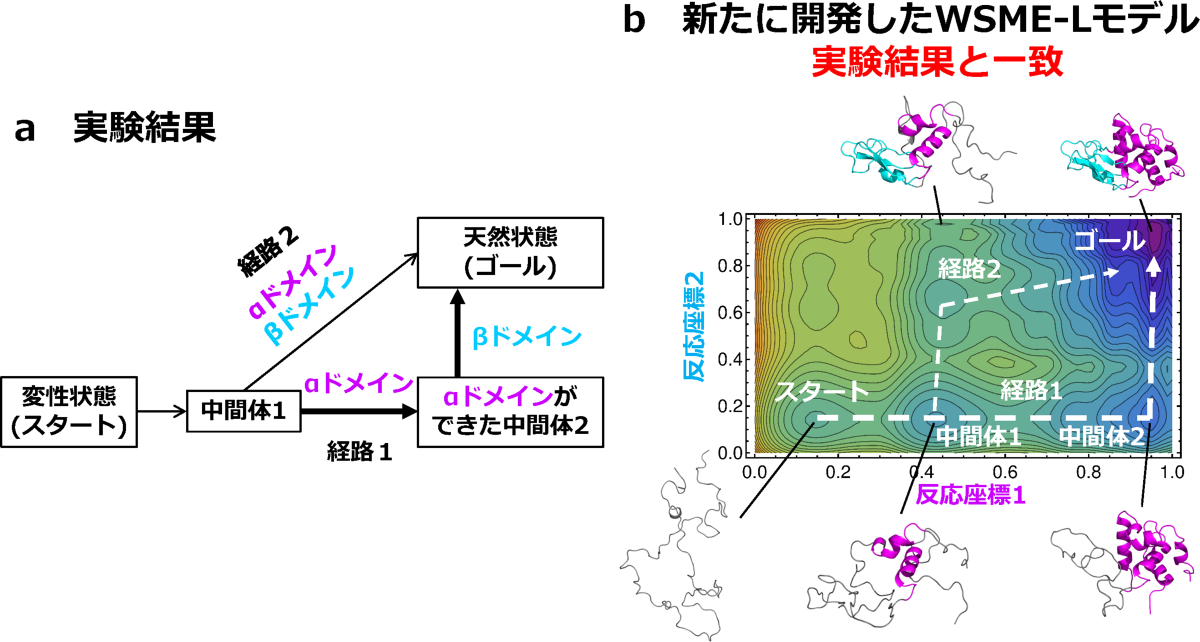
図5:ジスルフィド結合を持つタンパク質の折りたたみ反応経路を示す地図。実験(a)と予測(b)の比較。
リゾチームの例を示す。スタートはほどけた形(変性状態)、ゴールは最終的に折りたたまれた形(天然状態)を表す。地形図の横軸はピンク色の領域が折りたたまれた割合、縦軸は水色の領域が折りたたまれた割合を示す。実験では、右下を通る経路1と中間体1から右上に至る経路2という2つの経路が観測された(a)。新たに開発したWSME-Lモデルは、実験と同様の2つの経路を再現できた(b)。
以上のように、新たに開発したWSME-Lモデルは、小型タンパク質から大型タンパク質まで、また、ジスルフィド結合の有無に関わらず、多様なタンパク質が特定の形へと折りたたまれていく仕組みを統一的に予測できる革新的な理論であることが示されました。
最先端のAIであるAlphaFold 2は、アミノ酸のつながり方を指定すれば、そのタンパク質が最終的につくる形を正確に予測できます。しかし、その途中の反応過程はブラックボックスになっています。本研究で開発した予測法は、そのギャップを埋めることができます。
〈今後の展望〉
人は約2万種類ものタンパク質を持つのに対し、実験によって折りたたみ反応が調べられたタンパク質は100種類程度に限られています。本研究で開発したWSME-Lモデルは、タンパク質の形についての情報があれば利用できるため、今後、実験やAlphaFold 2予測で得られたタンパク質の形に対して適用していけば、あらゆるタンパク質が形をつくる仕組みを解明できると期待されます。また、多様なタンパク質にこの理論を適用し、それによって得られた大量の予測データを深層学習すれば、AlphaFold 2の次に登場が期待される「タンパク質の動き(ダイナミクス)を予測するAI」の開発につながる可能性があります。
タンパク質が特定の形に正しく折りたたまれることに失敗すると、アルツハイマー病やパーキンソン病などの疾患を引き起こすことが知られています。本研究の成果はこのような疾患のメカニズムの解明に適用できます。さらに、医療用タンパク質や産業用酵素を工業的に大量生産するプロセスの開発などへの応用も期待されます。 タンパク質は、結合や触媒などの機能を発揮するときにもダイナミックに形を変化させます。そこで今後は本研究の理論を発展させて、タンパク質の結合や触媒などにおける反応速度を予測する理論の構築を目指します。この理論が完成すれば、結合や触媒などの反応速度を向上させた人工タンパク質を効率的に設計できる新たな理論手法の開発につながり、医療や産業への大きな波及効果が期待されます。
発表者
東京大学 大学院総合文化研究科・教養学部
大岡 紘治(特任助教)
新井 宗仁(教授)〈兼:大学院理学系研究科〉
論文情報
雑誌:Nature Communications
題名:Accurate prediction of protein folding mechanisms by simple structure-based statistical mechanical models
著者:Koji Ooka, Munehito Arai*
DOI:10.1038/s41467-023-41664-1
研究助成
本研究は、科研費「基盤研究(A)(課題番号:16H02217)」、「基盤研究(B)(課題番号:19H02521)」、「特別研究員奨励費(課題番号:20J11762)」、「挑戦的研究(萌芽)(課題番号:21K18841)」、「学術変革領域研究(A)(課題番号:23H04545)」、栢森情報科学振興財団の支援により実施されました。
用語説明
(注1)ジスルフィド結合
システインというアミノ酸のペアの間に形成される共有結合。このような架橋がタンパク質分子内にできるとタンパク質は安定になる。抗体にも多く存在している。ジスルフィド結合を複数持つタンパク質を正しい形へと人工的に折りたたむことは難しいが、この問題を解決できれば、医療や産業に有用なタンパク質を微生物で大量生産した後、人工的に正しい形をつくらせることによって、有用なタンパク質の安価な製造を実現できる。