2023-12-06 京都大学iPS細胞研究所
ポイント
- ナイーブ型注1)ヒト多能性幹細胞を用いて、着床前の原始内胚葉注2)へ誘導する方法を開発した。
- 着床前の原始内胚葉およびエピブラスト注3)の2種の細胞をナイーブ型ヒト多能性幹細胞から同時に誘導することで、二層性胚盤注4)に類似の構造(バイラミノイド)を形成した。
- バイラミノイドを形成する2種の細胞と栄養膜細胞注5)が相互作用する非統合胚モデル注6)を作製し、前後軸の形成や着床後にみられる特定の細胞群への分化などを再現した。
- 非統合胚モデルを用いて、胚体外組織を形成する原始内胚葉や栄養膜細胞がヒト胚の着床期の発生を進めるメカニズムの一端を解明した。
1. 要旨
大久保巧研究員(CiRA未来生命科学開拓部門)、山本拓也准教授(CiRA同部門、京都大学高等研究院ヒト生物学高等研究拠点WPI-ASHBi)、髙島康弘准教授(CiRA同部門)らの研究グループは、着床前の胚である胚盤胞注7)を構成する3種の細胞をナイーブ型ヒト多能性幹細胞(iPS細胞とES細胞)から誘導し共培養することで、三次元発生モデルの構築を行いました。
ヒト発生を理解する新たな研究手法として、ヒト由来の幹細胞をもとに、ヒトの初期胚の構造を再現した細胞培養モデルを開発する研究が近年注目されています。
研究グループはまず、着床前の原始内胚葉に遺伝子発現が非常に近い細胞(naïve hPSC-derived hypoblast-like cells; nHyC)の誘導方法を開発しました。次に、ナイーブ型ヒト多能性幹細胞由来の着床前のエピブラストに類似の細胞(naïve hPSC-derived epiblast-like cells; nEpiC)とnHyCから構成される、生体の二層性胚盤に似た構造の形成に成功し、この構造をバイラミノイド(Bilaminoids)と名づけました。さらに、ナイーブ型ヒト多能性幹細胞由来の栄養膜細胞に類似した細胞(naïve hPSC-derived trophoblast-like cells; nTB)を、バイラミノイドを形成する2種の細胞と半透過性の多孔質膜で隔てて同時に培養し、着床前のヒト胚を構成する3系統の細胞が部分的に隔離されながら相互作用可能な非統合胚モデルを構築しました。
本研究では、着床前という早期の発生段階に類似の3系統の細胞による二層性胚盤および非統合胚モデルを用いて、着床前から、胚の形態や体細胞分化などの大きな変化がみられる原腸陥入初期までの発生を再現しました。また、胚体外組織を形成する原始内胚葉と栄養外胚葉の着床前後の役割を解析することで、本モデルが着床前後のヒト胚発生を詳細に理解するための有用なツールとなることを示しました。
今後は本成果を発展させ、これまでヒトの胚では解析が難しかったヒト発生の詳細な理解を深めるとともに、より自然な発生過程を再現することでヒト多能性幹細胞から組織や臓器を誘導する新たな手法の開発につながることが期待されます。
この研究成果は2023年12月5日(日本時間)に英科学誌「Nature」で公開されました。
2. 研究の背景
近年、ヒトの初期胚の詳細な解析が可能になり、マウスとヒトのあいだで発生の仕組みが異なる点が明らかになりつつあります。一方で、特に胚が母体の子宮に着床する時期や着床後の発生は、胚を用いた研究が規制されているため、ブラックボックスとなっています。こうした状況から、ヒト胚を用いない形でのヒト発生研究の手法が検討されていました。
数年前から、ヒトの幹細胞をもとに、初期胚を構成する複数種類の細胞を作製し、それらを同時に培養することで、ヒトの胚発生のモデルとして用いる研究が国内外で盛んに行われています。
通常、ヒトの多能性幹細胞であるES細胞およびiPS細胞はいずれも「プライム(Primed)型」として分類され、着床後のヒト胚のエピブラストと類似しています。プライム型の多能性幹細胞は、将来、胎児を構成する細胞群に分化できますが、将来、胚体外組織の胎盤になる栄養外胚葉と、同じく胚体外組織である卵黄嚢になる原始内胚葉の2種に分化させることはできません。そこで、プライム型に相当する発生の時期よりも早い、着床前の胚盤胞のエピブラストの状態に相当する「ナイーブ(Naïve)型」の多能性幹細胞を利用して胚モデルを作製した研究が報告されています。本研究グループは、2014年にナイーブ型のヒトiPS細胞の作製法の確立を報告し、2021年には、将来、胎盤となる栄養外胚葉をナイーブ型多能性幹細胞から誘導し、さらに栄養膜細胞へ分化を進めることに成功しています(CiRAニュース 2021年4月8日)。
本研究では、これらの成果をさらに発展させ、ナイーブ型ヒト多能性幹細胞から着床前の原始内胚葉に性質の近い細胞の誘導法を確立し、着床前の胚を再現する三次元発生モデルの構築に取り組みました。また、作製したモデルを用いて、胚体外組織を作る細胞が胚の成長と発生にどのような役割を果たしているかを調べました。
3. 研究結果
1)ナイーブ型ヒト多能性幹細胞から原始内胚葉への分化誘導法の確立
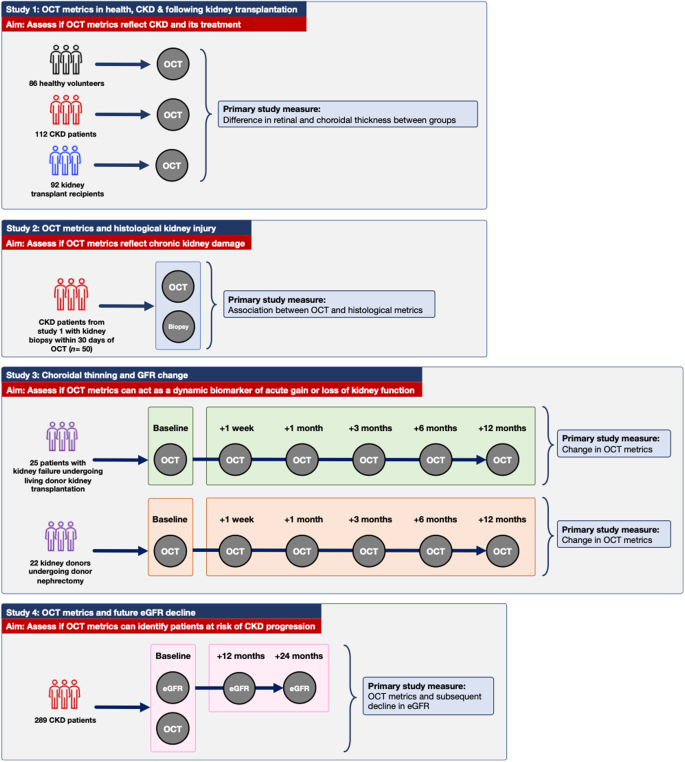
研究グループは、ナイーブ型ヒト多能性幹細胞から着床前の胚盤胞に存在する原始内胚葉を誘導する2つの方法を開発しました。はじめに、原始内胚葉で発現している遺伝子(GATA6、GATA4、SOX17 )をドキシサイクリン(DOX)の添加により過剰発現するナイーブ型ヒト多能性幹細胞を作製しました。その結果、GATA6 を過剰発現するナイーブ型ヒト多能性幹細胞から原始内胚葉に類似した細胞nHyCを効率よく誘導することに成功しました(図1)。
次に、GATA6 の発現誘導により活性の変化したシグナル回路を解析し、その結果をもとに選択した7つの因子(FGF4やBMPなど)をナイーブ型ヒト多能性幹細胞に添加することで原始内胚葉を誘導する方法を考案しました。その結果、GATA6 過剰発現によるnHyCと同様の細胞を誘導することができました(図1)。
さらに、GATA6 過剰発現とシグナル因子によるどちらの方法においても、プライム型では、ナイーブ型で誘導された細胞と遺伝子発現が異なっており、ナイーブ型由来の細胞が生体の原始内胚葉の遺伝子発現パターンとより近いことが確認されました。
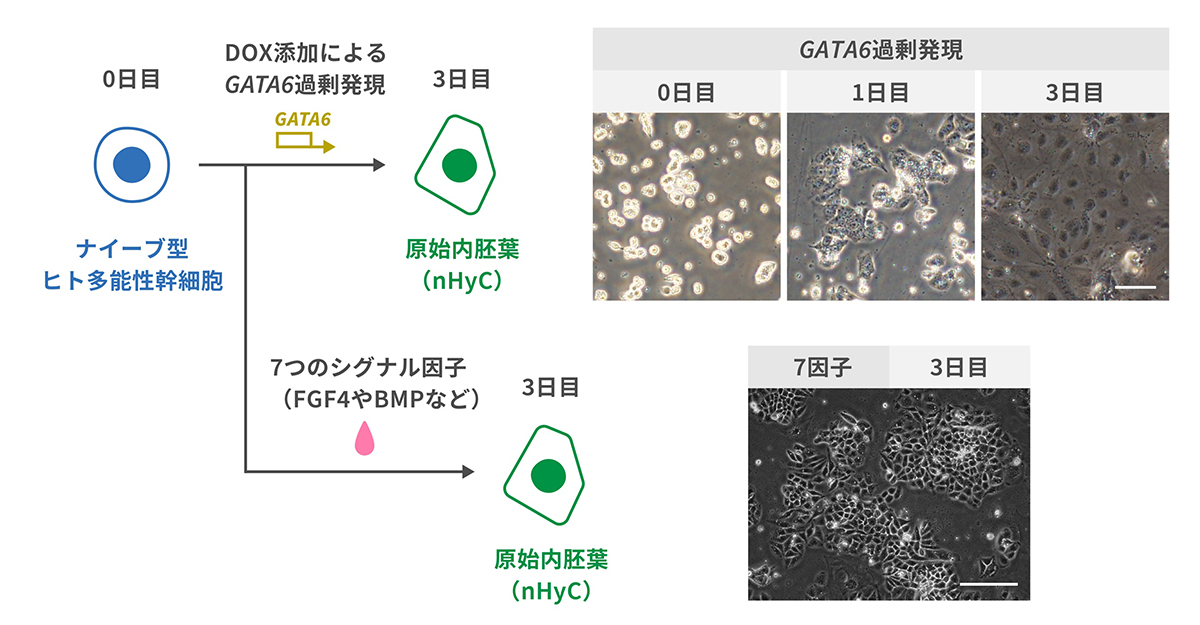 図1 ナイーブ型ヒト多能性幹細胞から原始内胚葉への分化誘導
図1 ナイーブ型ヒト多能性幹細胞から原始内胚葉への分化誘導
2)ナイーブ型ヒト多能性幹細胞由来のエピブラストと原始内胚葉からなるバイラミノイドの形成
次に、遺伝子組み換えをしていない野生型のナイーブ型ヒト多能性幹細胞とDOXによりGATA6の過剰発現を誘導するナイーブ型ヒト多能性幹細胞(GATA6誘導型)とからなる細胞の集合体を培養することで、エピブラストに類似の細胞(naïve hPSC-derived epiblast-like cells; nEpiC)とnHyCをそれぞれ同時に誘導しました(図2左)。培養を始めて2日目には、外周にnHyC、内周にnEpiCが層状に並んだ球体状の構造が形成されました。
この構造は、後期の胚盤胞に類似しており、さらに培養をすすめると4日目には中心部に細胞極性タンパク質のPAR6が集中しnEpiCの層の外周と内周とで極性が形成され、着床後に認められる生体の二層性胚盤に似た構造が誘導されました(図2右)。研究グループは、二層性胚盤(Bilaminar disc)にちなんで、この構造をバイラミノイド(Bilaminoids)と呼ぶことにしました。
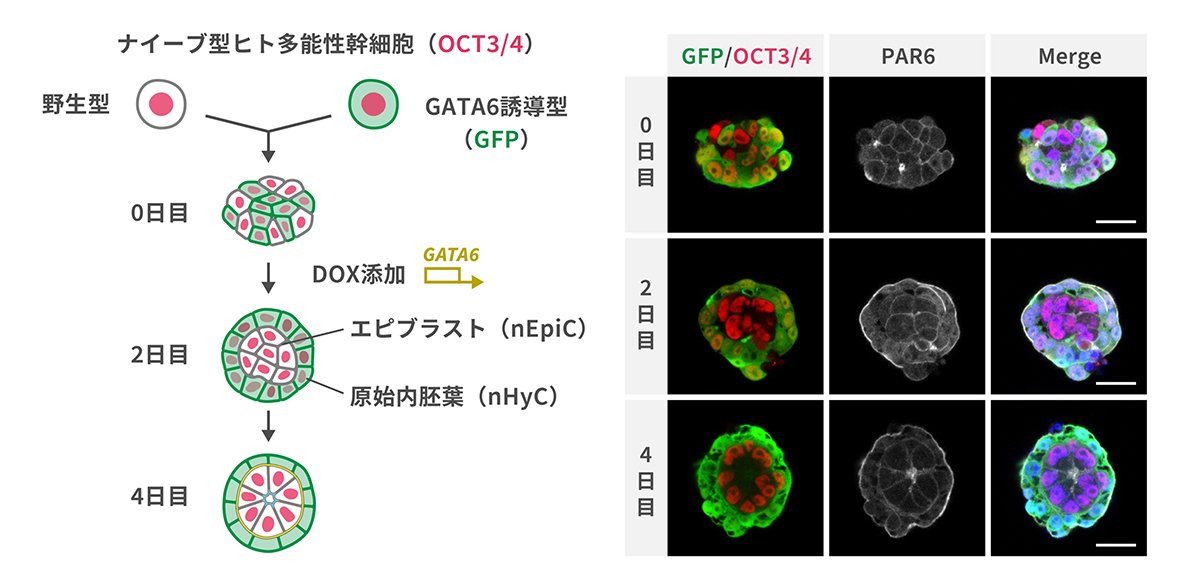 図2 バイラミノイドの形成
図2 バイラミノイドの形成
3)非統合胚モデルの構築とバイラミノイドの形成促進作用の解析
次に、ナイーブ型多能性幹細胞から栄養外胚葉を経由して栄養膜細胞に類似の細胞(naïve hPSC-derived trophoblast-like cells; nTB)を作製しました。そして、バイラミノイドを形成する2種のナイーブ型ヒト多能性幹細胞の細胞集合体の上部に、底面が半透過性のトランズウェルを設置し、トランズウェル上でnTBを培養しました(図3左)。これにより、着床期の胚を構成する3系統の細胞が半透過性の膜で物理的に隔てられながらも同一の環境下で相互作用可能な非統合型の胚モデルを構築しました。その結果、nEpiCの細胞増殖が促進され、バイラミノイドの内部に形成される羊膜腔に類似の空間が形成率が向上し、羊膜腔構造の大きさも増大しました(図3右上)。
研究グループは、このバイラミノイド形成促進について、非統合胚モデルで新たに追加したnTBから分泌される特定の因子が多孔質膜を通過して作用していると考え、生体の栄養膜細胞で産生されるサイトカインの一つであるIL6遺伝子に着目しました。IL6を欠損させたナイーブ型多能性幹細胞からnTBを誘導し、非統合胚モデルを作製したところ、nTBの共培養によるバイラミノイドの形成促進効果が消失しました(図3右下)。このことから栄養膜細胞が産生するIL6はエピブラストの増殖と分化を促進している可能性が示唆されました。
 図3 非統合胚モデルの構築とnTBのIL6産生によるバイラミノイド形成促進
図3 非統合胚モデルの構築とnTBのIL6産生によるバイラミノイド形成促進
4)非統合胚モデルにおける胚形成過程とエピブラスト分化の再現
研究グループは、非統合胚モデルを9日目まで培養し、バイラミノイドの構造や細胞の分化を解析しました。
培養4日目には、nHyCとnEpiCとのあいだにタンパク質のラミニンなどからなる基底膜の形成を確認し、nHyCにおいてラミニンが強く発現していることを見出しました。ラミニン遺伝子LAMB1を欠損させたnHyCを用いて、胚モデルの作製したところバイラミノイド形成が誘導されませんでした(図4左)。これは、原始内胚葉がラミニンを産生し基底膜を形成することで、エピブラストの形態形成に重要な役割を果たしていることを示唆しています。
6日目には、nEpiCの一部から原腸陥入にかかわる遺伝子Tを発現する細胞が出現しました。原腸陥入部位は胚の後方となりますが、T陽性細胞から離れた場所に、前方を規定する遺伝子CER1や、Tを抑制する因子OTXを発現するnHyC由来の細胞がみられました(図4右)。これは、原腸陥入初期にみられる前後軸の形成を再現していると考えられます。また9日目には、nEpiCの一部が、原腸陥入初期にみられる始原生殖細胞や羊膜上皮細胞、血管内皮前駆細胞などに類似した細胞へと分化しました。
以上の結果より、原始内胚葉はエピブラストと共に二層性胚盤を形成するうえで前後軸の形成や基底膜の形成などに寄与するほか、着床後のエピブラストの分化と発生に重要な役割を果たしていることが示唆されました。
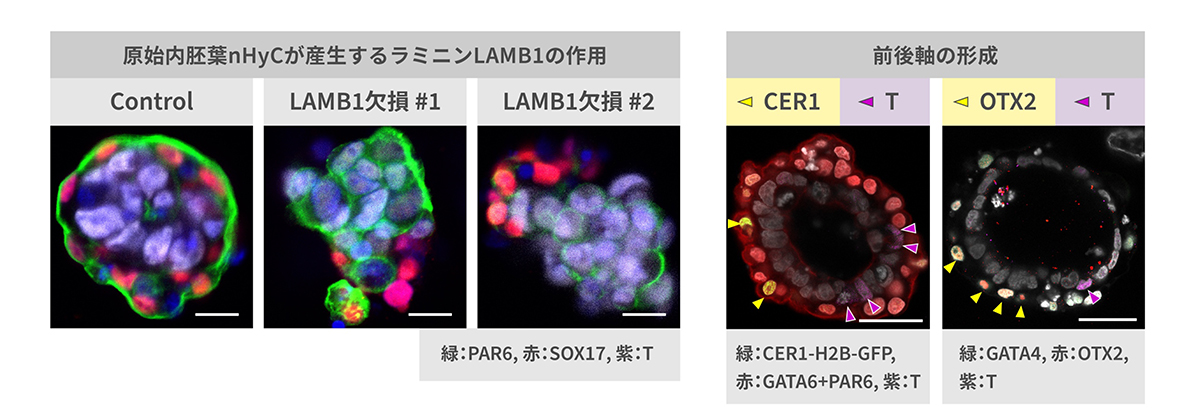 図4 非統合胚モデルにおける胚形成過程の再現
図4 非統合胚モデルにおける胚形成過程の再現
4. まとめと展望
本研究では、ナイーブ型ヒト多能性幹細胞を用いて、ヒトの原始内胚葉に遺伝子発現の似た細胞を新たに誘導し、着床前後の胚を再現したモデルを作製しました。また、胚モデルを構成するnHyCやnTBの遺伝子発現を操作することにより、着床前後のエピブラストの発生と分化において、胚体外組織となる原始内胚葉と栄養膜細胞がどのように寄与しうるかを分子レベルで解析しました。
一方で、現在、国内外では、こうしたヒト幹細胞を用いた胚モデル研究をどのように進めるべきか、倫理的な観点から議論がなされています。今回は非統合胚モデルの培養を行いましたが、今後も、継続的にこうした倫理的な観点の議論をふまえて研究を行う必要があります。
今後は、本モデルがこれまで詳細な解析ができなかったヒト発生の詳細な理解をより深めるためのツールとして貢献するとともに、より自然な発生過程の再現によりヒト多能性幹細胞から組織や臓器を誘導する新たな手法の開発に役立てられることが期待されます。
5. 論文名と著者
- 論文名
Hypoblast from human pluripotent stem cells regulates epiblast development - ジャーナル名
Nature - 著者
Takumi Okubo1, Nicolas Rivron2, Mio Kabata1, Hideki Masaki3,4, Keiko Kishimoto5, Katsunori Semi1, May Nakajima-Koyama1, Haruko Kunitomi1, Belinda Kaswandy1, Hideyuki Sato3,4, Hiromitsu Nakauchi3,4,6, Knut Woltjen1, Mitinori Saitou1,7,8, Erika Sasaki5, Takuya Yamamoto1,7,9,*,
Yasuhiro Takashima1,*
* : 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- オーストリア科学アカデミー 分子生物工学研究所
- 東京大学医科学研究所
- 東京医科歯科大学 高等研究院
- 実験動物中央研究所
- スタンフォード大学 医学部
- 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)
- 京都大学大学院医学研究科 機能微細形態学
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED) 革新的先端研究開発支援事業
[JP17gm1110004, JP19gm1310002, JP21gm1310011] - AMED 再生医療実現拠点ネットワークプログラム
[JP19bm0704032, JP21bm0104001, JP21bm0704035, JP22bm1004002] - AMED 再生・細胞医療・遺伝子治療実現加速化プログラム
[JP23bm1323001] - 日本学術振興会(JSPS)・文部科学省 科学研究費補助金
[JP15H02360, JP16H02465, JP19H05759, JP20H05361, JP20H05762, JP21K19189, JP23K18340] - 科学技術振興機構(JST)
[JPMJFR206C, JPMJCR2023] - 公益財団法人 武田科学振興財団
- 公益財団法人 内藤記念科学振興財団
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 アステラス病態代謝研究会
- iPS細胞研究基金
7. 用語説明
注1)ナイーブ型
細胞の発生段階や分化多能性の程度を表す用語であり、胚盤胞のエピブラストに相当する状態。
注2)原始内胚葉
胚盤胞を構成する細胞のうち、将来、胚体外組織の一つである卵黄嚢となる細胞。内部細胞塊として、エピブラストと共に胚盤胞に存在し、着床後はエピブラストと二層性胚盤を形成する。
注3)エピブラスト
着床前後の胚に存在する細胞のうち、将来、胎児となり、体を構成する細胞。
注4)二層性胚盤
受精後8日目までに形成されるヒト胚の構造。胚盤胞の内部細胞塊を構成するエピブラストと原始外胚葉の細胞が層状に配列することで形成される。英語ではbilaminar discという。
注5)栄養膜細胞
胚盤胞の外周に存在する栄養外胚葉から分化し、将来、胚体外組織の一つである胎盤を構成する細胞に分化する能力をもつ。
注6)非統合胚モデル
胚の発生を部分的に再現するモデル。胚モデルは、非統合型と胚全体の発生を再現する統合型とに大別される。
注7)胚盤胞
受精後5日目から着床前の胚。エピブラスト、原始内胚葉、栄養外胚葉により構成される。