2018-11-13 理化学研究所
理化学研究所(理研)脳神経科学研究センター発生神経生物研究チームの安東英明研究員(研究当時)、御子柴克彦チームリーダーらの研究チーム※は、家族性脊髄小脳失調症[1]の原因遺伝子であるカルシウムチャネル[2]IP3受容体(イノシトール三リン酸受容体)I型[3]の点突然変異[4]の影響を網羅的に解析し、変異によりIP3受容体I型が機能不全に陥る分子機構を解明しました。
本研究成果は、脊髄小脳失調症の発症機構の解明や、その治療のための創薬研究に貢献すると期待できます。
今回、研究チームは、ゲノム編集技術[5]を用いて3種類のIP3受容体遺伝子が全て欠失したヒト細胞株を新たに樹立し、家族性脊髄小脳失調症で見つかった点突然変異を持つIP3受容体I型変異体の活性を網羅的に解析しました。その結果、IP3受容体I型のミスセンス変異[4]により、その活性化機構や、結合タンパク質による制御が正常に機能しなくなり、細胞のカルシウムシグナル[2]に異常をきたすことが明らかになりました。神経細胞内のカルシウム動態の異常が脊髄小脳失調症の発症に関わると考えられます。
本研究は、米国の科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』の掲載に先立ち、オンライン版(11月12日の週)に掲載されます。
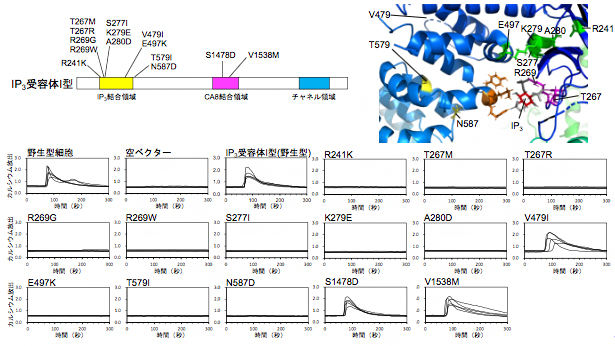
図 家族性脊髄小脳失調症等で同定されたIP3受容体I型の点突然変異とその活性に及ぼす影響
※研究チーム
理化学研究所 脳神経科学研究センター 発生神経生物研究チーム
研究員(研究当時) 安東 英明(あんどう ひであき)
(現 東京大学大学院 医学系研究科 疾患生命工学センター 特任准教授)
テクニカルスタッフI 廣瀬 松美(ひろせ まつみ)
チームリーダー 御子柴 克彦(みこしば かつひこ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究S「シナプス可塑性・神経機能と神経発達制御におけるIP3受容体の役割(研究代表者:御子柴克彦)」、同基盤研究C「細胞内カルシウムチャネルの変異を原因とする神経変性疾患の発症機序解明(研究代表者:安東英明)」による支援を受けて行われました。
背景
家族性脊髄小脳失調症は、主に歩行時のふらつきなどの運動失調症状を示す遺伝性の神経変性疾患です。家族性脊髄小脳失調症は、その原因遺伝子により40以上の型に分類されていますが、そのうち15/16型および29型の原因遺伝子が、細胞内のカルシウムチャネルであるIP3受容体(イノシトール三リン酸受容体)I型であることが最近の臨床研究で明らかになっています注1)。
IP3受容体は、刺激により細胞内に産生される化学物質IP3に結合することにより活性化し、細胞内のカルシウムイオン(以下、カルシウム)濃度を上昇させる働きがあります。IP3受容体には3種類の遺伝子(I型、II型、III型)があり、そのうちIP3受容体I型は、小脳の神経細胞に多く発現し、脳機能に重要な役割を果たしています。家族性脊髄小脳失調症の15/16型が主にIP3受容体I型の大規模な欠失突然変異[6]が原因であるのに対し、29型はIP3受容体I型の点突然変異が原因です。現在までに、家族性脊髄小脳失調症で約20カ所のIP3受容体I型の点突然変異が見つかっています。
しかし、これらの変異がIP3受容体I型の機能にどのような影響を及ぼすかについては、ほとんど解明されていませんでした。その理由として、ほぼ全ての細胞において、3種類のIP3受容体のいずれかが発現していることが挙げられます。すなわち、正常なIP3受容体活性が存在するために、ヒト由来の細胞を用いてIP3受容体の変異体の活性を測定することがこれまで困難でした。
注1)Hisatsune et al. (2018) Ca2+ signaling and spinocerebellar ataxia. Biochim Biophys Acta. Volume 1865, Issue 11, Part B, November 2018, Pages 1733-1744
研究手法と成果
研究チームは、まず3種類のIP3受容体遺伝子をゲノム編集技術で全て欠失させたヒト細胞株を樹立しました(図1)。このIP3受容体欠損細胞を用いることにより、内在性のIP3受容体活性に邪魔されることなく、点突然変異を持つIP3受容体変異体の活性を高精度かつ効率的に測定できました。
次に、IP3受容体欠損細胞を用いて、家族性脊髄小脳失調症等で見つかった点突然変異を持つIP3受容体I型の14種類の変異体(図2左上)のカルシウム放出活性を解析しました。IP3受容体欠損細胞に野生型のIP3受容体I型を遺伝子導入し、カルシウムイメージング[7]によりその活性を測定したところ、アゴニスト刺激[8]によりカルシウム濃度上昇が誘導されることが確認されました。一方、家族性脊髄小脳失調症で見つかった点突然変異を持つ14種類のIP3受容体I型変異体のうち、11種類の変異体(R241K、T267M、T267R、R269G、R269W、S277I、K279E、A280D、E497K、T579I、N587D)は、アゴニスト刺激に対してほとんどカルシウム放出活性を示さないことが明らかになりました(図2下、右上)。
続いて、IP3結合領域に変異のある12種類のIP3受容体I型変異体のIP3結合領域の組換えタンパク質を精製し、IP3との結合活性を測定しました。その結果、カルシウム放出活性を示さなかった11種類の点突然変異体のうち、9種類の変異体(R241K、T267M、T267R、R269G、R269W、S277I、K279E、A280D、E497K)は、IP3結合活性が著しく減少していることが分かりました(図3左)。これらの変異体は、IP3と結合できないために、カルシウム放出活性を失ったと考えられます。
一方、残りの2種類の変異体(T579I、N587D)は、正常なIP3結合活性を示しました。IP3受容体I型のX線結晶構造から得られる情報と総合すると(図3右)、これら2変異体は、IP3に結合はできるが、IP3結合により誘導される構造変化が正常に行われない可能性が考えられます。
最後に、CA8結合領域に変異のある変異体(S1478D、V1538M)とIP3受容体I型を制御するCA8[9]というタンパク質との相互作用について解析しました。その結果、IP3受容体I型のV1538M変異により、CA8との結合が阻害され、CA8による制御が正常に行われなくなることが分かりました(図4)。さらに、CA8は運動失調や精神遅滞を症状とする遺伝性疾患の原因遺伝子であることが最近報告されていますが、CA8の点突然変異により、IP3受容体I型の制御機能が失われることを解明しました。
以上の解析により、家族性脊髄小脳失調症29型で見つかったIP3受容体I型の点突然変異により、①IP3受容体I型のIP3結合活性が欠損する、②IP3結合により誘導されるIP3受容体I型の構造変化が損なわれる、③CA8タンパク質によるIP3受容体I型の制御に異常が生じる、のいずれかの機能異常が生じ、細胞が刺激に対して正常なカルシウム反応性を示さなくなることが解明されました。また、今回解析した中で唯一家族性脊髄小脳失調症15/16型の変異であるV479Iは、IP3受容体I型の活性に影響を及ぼしませんでした。V479Iは疾患の原因となる変異ではない可能性が示唆されましたが、結合タンパク質による制御など、さらなる解析が必要と考えられます。
IP3受容体I型は、小脳のプルキンエ細胞という神経細胞のカルシウムシグナルの制御に重要な役割を果たしています。IP3受容体I型の点突然変異により神経細胞のカルシウムシグナルに異常が生じることが、家族性脊髄小脳失調症の発症に関わると考えられます。
今後の期待
本研究により、家族性脊髄小脳失調症発症の分子メカニズムに重要な知見が得られました。研究チームは、2017年にIP3受容体I型のX線結晶構造の解明に成功しています注2)。今後、立体構造情報に基づきIP3受容体I型の阻害剤や活性化剤を探索することにより、家族性脊髄小脳失調症の治療のための創薬につながる可能性があります。
注2)2017年4月18日プレスリリース「脳の働きに重要なIP3受容体の動作原理を解明」
原論文情報
Hideaki Ando, Matsumi Hirose, and Katsuhiko Mikoshiba, “Aberrant IP3 receptor activities revealed by comprehensive analysis of pathological mutations causing spinocerebellar ataxia 29″, Proceedings of the National Academy of Sciences of the United States of America (PNAS), 10.1073/pnas.1811129115
発表者
理化学研究所
脳神経科学研究センター 発生神経生物研究チーム
研究員(研究当時) 安東 英明(あんどう ひであき)
(現 東京大学大学院 医学系研究科 疾患生命工学センター 特任准教授)
チームリーダー 御子柴 克彦(みこしば かつひこ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 家族性脊髄小脳失調症
- 主に常染色体優性遺伝形式をとる遺伝性疾患で、歩行時のふらつきなどの運動失調症状を中核症状とする神経変性疾患。原因遺伝子により40以上の型に分類される。IP3受容体I型は、成人で発症する15/16型と、乳幼児で発症する29型の原因遺伝子である。
-
- カルシウムシグナル、カルシウムチャネル
- 細胞質内のカルシウムイオン(Ca2+)の濃度(カルシウム濃度)は約10-7Mであり、細胞外液の約10-3Mに対して極端に低く抑えられている。刺激に応じて誘導される細胞質内の急激なカルシウム濃度上昇は、脳神経活動を含む多くの生命現象でシグナル(カルシウムシグナル)として利用される。カルシウムチャネルは、細胞膜や細胞内カルシウム貯蔵庫(小胞体)の膜上にあるカルシウムイオンを透過させるタンパク質である。通常は閉じていてカルシウムイオンを通さないが、活性化するとカルシウムイオンを透過させ、細胞内カルシウム濃度上昇を誘導する。
-
- IP3受容体(イノシトール三リン酸受容体)I型
- 細胞内のカルシウム貯蔵庫(小胞体)の膜上に存在するカルシウムチャネル。神経伝達物質や成長因子などのさまざまな細胞刺激により細胞内に産生される、IP3(イノシトール三リン酸)に結合することで活性化し、細胞内のカルシウム濃度を上昇させる。IP3受容体にはI型、II型、III型の三つの遺伝子があり、IP3受容体I型は特に脳機能に重要な役割を果たす。
-
- 点突然変異、ミスセンス変異
- 点突然変異とは、遺伝子をコードするDNAの1塩基(A、T、G、C)が別の塩基に置換、あるいは欠失、あるいは挿入される突然変異のこと。塩基の置換の結果、遺伝子がコードするタンパク質の1アミノ酸が異なるアミノ酸に置換される変異をミスセンス変異という。例えばR241Kは、点突然変異の結果、IP3受容体I型の241番目のアミノ酸であるアルギニン残基(R)がリシン残基(K)に置換されていることを示す。
-
- ゲノム編集技術
- 配列特異的にゲノムDNAを切断する酵素を用いて、標的遺伝子に変異を導入する技術。本研究では、高効率に変異を導入できるCRISPR/Cas9システムを用いている。
-
- 欠失突然変異
- ゲノムDNAの一部が欠失する突然変異。
-
- カルシウムイメージング
- カルシウムイオンと結合すると明るさが変化する化合物やタンパク質(カルシウム蛍光指示薬)で細胞を標識し、その蛍光強度の変化を、蛍光顕微鏡を用いて観測する手法。細胞内のカルシウム濃度の継時的変化を測定することができる。
-
- アゴニスト刺激
- 細胞外からの生理活性物質(ホルモン、神経伝達物質など)による刺激。細胞膜の受容体に結合することにより、細胞内の情報伝達を活性化する。
-
- CA8
- 小脳のプルキンエ神経細胞に多く発現しているタンパク質。研究チームのこれまでの解析により、CA8はIP3受容体I型と結合し、その機能を抑制することが解明されている。最近海外の研究グループにより、CA8は運動失調や精神遅滞を症状とする遺伝性疾患の原因遺伝子であることが報告されている。
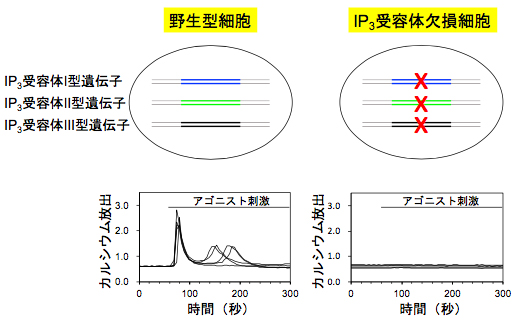
図1 IP3受容体欠損ヒト細胞株の樹立
ヒト培養細胞株であるHeLa細胞において、3種類のIP3受容体遺伝子を全て欠失したIP3受容体欠損細胞をゲノム編集技術で作製した。IP3受容体欠損細胞は、アゴニスト刺激(細胞外からのホルモン、神経伝達物質などによる刺激)によるカルシウム濃度上昇を示さない。
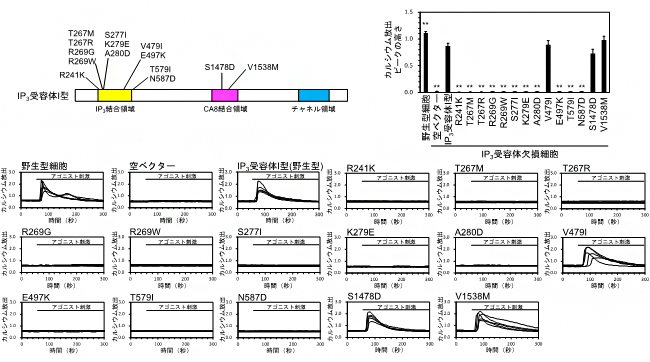
図2 IP3受容体I型の点突然変異体のカルシウム放出活性
(左上)家族性脊髄小脳失調症等で見つかった14種類のIP3受容体I型の点突然変異。R241K、T267M、T267R、R269G、R269W、S277I、K279E、A280D、E497K、T579I、N587D、V1538Mは家族性脊髄小脳失調症29型で見つかった変異。V479Iは家族性脊髄小脳失調症15/16型で見つかった変異。S1478Dは運動失調症状を示す脳性麻痺患者で見つかった変異。
(下)IP3受容体欠損細胞に家族性脊髄小脳失調症等で見つかったIP3受容体I型変異体を遺伝子導入して、アゴニスト刺激に対するカルシウム放出活性を測定した。14種類のうち11種類の変異体(R241K、T267M、T267R、R269G、R269W、S277I、K279E、A280D、E497K、T579I、N587D)は、カルシウム放出活性を全く示さなかった。
(右上)定量化されたIP3受容体I型変異体のカルシウム放出活性のグラフ。
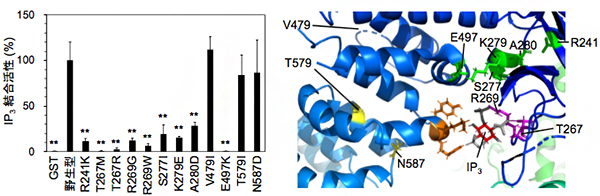
図3 IP3受容体I型の点突然変異体のIP3結合活性
(左)IP3受容体I型の点突然変異体のIP3結合活性。IP3結合領域に変異のある12種類の変異体の中で、カルシウム放出活性を示さなかった11種類のうち9種類の変異体(R241K、T267M、T267R、R269G、R269W、S277I、K279E、A280D、E497K)は、IP3結合活性が著しく減少していた。
(右)IP3受容体I型のX線結晶構造。T267とR269残基(紫)は、IP3と直接結合する。R241、S277、K279、A280、E497残基(緑)は、IP3結合ポケットでクラスターを形成している。T579とN587残基(黄)は、IP3結合ポケットの近傍に位置する。V479は構造が解かれていない領域に位置する。
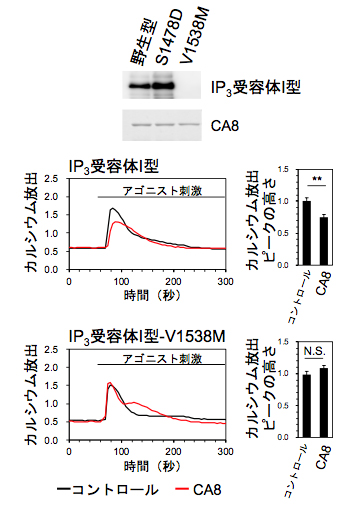
図4 IP3受容体I型の点突然変異体のIP3結合活性
(上段)IP3受容体I型の点突然変異体(S1478D,V1538M)とCA8との結合をプルダウン法で解析。V1538M変異体はCA8と結合できなくなっていた。
(中・下段)IP3受容体I型のV1538M変異がCA8による制御に及ぼす影響を、IP3受容体欠損細胞を用いたカルシウムイメージングで解析。野生型のIP3受容体I型はCA8によりカルシウム放出活性が抑制された(中段)。一方、IP3受容体I型V1538M変異体はCA8により抑制されなかった(下段)。