発達障害や精神疾患の克服に向けた新たな治療戦略に貢献
2019-04-11 理化学研究所
理化学研究所(理研)脳神経科学研究センタータンパク質構造疾患研究チームの田中元雅チームリーダー、ケルヴィン・フイ研究員らの研究グループ※は、細胞内のタンパク質分解に関わる「オートファジー[1]機能」の欠損によるタンパク質恒常性の低下が、自閉症様の行動を誘導することを発見しました。
本研究成果は、自閉症[2]などの発達障害や精神疾患の克服に向けた新たな治療戦略の開発に貢献すると期待できます。
オートファジー機能の制御に重要な遺伝子の変異が自閉症患者の一群に見られることから、それらの遺伝子がさまざまな発達障害や精神疾患に関与していると考えられています。
今回、研究グループは、マウス脳の興奮性神経細胞[3]または抑制性神経細胞[3]において、オートファジー機能に関わる遺伝子を欠損させたところ、欠損マウスが社会性の欠如などの自閉症様の行動を示すことを見いだしました。また、新たに開発したプロテオミクス手法[4]を用いて、オートファジー機能欠損によって蓄積したタンパク質p62[5]と、抑制性の神経伝達物質GABA[6]の受容体に関連するGABARAPタンパク質群[7]が共凝集していることを発見しました。さらに、この共凝集によりGABA受容体の量が減ることで、神経細胞の興奮性と抑制性のバランスが低下すること、この機能不全がより一般的にp62の凝集体形成を通じて生じることが分かりました。したがって、GABARAPタンパク質の凝集化を阻害することは、発達障害などを緩和させる有効な手段であると考えられます。
本研究は、米国のオンライン科学雑誌『Science Advances』(4月10日付け:日本時間4月11日)に掲載されます。
※研究グループ
理化学研究所 脳神経科学研究センター
タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
研究員 ケルヴィン・フイ(Kelvin Hui)
分子精神遺伝研究チーム
チームリーダー 吉川 武男(よしかわ たけお)
神経老化制御研究チーム
チームリーダー 西道 隆臣(さいどう たかおみ)
シナプス可塑性・回路制御研究チーム
チームリーダー 合田 裕紀子(ごうだ ゆきこ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究「新生鎖の生物学(領域代表者:田口英樹)」などによる支援を受けて行われました。
背景
細胞内の不要なタンパク質や脂質、損傷を受けた細胞小器官などを分解するための仕組みの一つとして、「オートファジー」と呼ばれる機能があります。オートファジーの活性を制御する重要な因子として、タンパク質リン酸化酵素mTOR[8]が知られています。mTORシグナルを制御するタンパク質TSC1/2[9]などの遺伝子の変異が、自閉症患者の一群に見られるため、その結果生じるmTOR活性の異常な増加が、さまざまな発達障害や精神疾患に関与していると考えられています。
しかし、mTOR活性の異常な増加によるオートファジー機能の低下が、どのように神経機能を低下させて自閉症様の表現型をもたらすのかについてはよく分かっていません。
また、田中チームリーダーらは2017年と2018年に、精神疾患の危険因子タンパク質の凝集化が神経機能を低下させ、精神疾患をもたらすことを報告しました注1、2)。しかし、もっと一般的に、タンパク質の恒常性の低下や凝集化が精神疾患や発達障害の発現に関与するか否かは、依然として不明でした。
そこで、研究グループは、オートファジー機能の欠損によって細胞内のタンパク質恒常性を全体的に低下させることは、タンパク質恒常性の低下やそれによる凝集化が神経機能や個体の表現型にどのような影響を与えるかをより一般的に調べる上で、理想的な実験系であると考えました。
注1)2017年7月7日 Research Highlight 「Untangling depression in Huntington’s disease(英語ページ)」
注2)2018年6月14日プレスリリース「タンパク質の共凝集化による精神障害の発現」
研究手法と成果
多くの発達障害や精神疾患は、大脳皮質に存在する興奮性神経細胞と抑制性神経細胞の機能不全によって生じます。研究グループはまず、オートファジー機能を欠損させるために、その機能に重要な役割を果たすユビキチン[10]活性化酵素Atg7[11]の遺伝子を興奮性または抑制性神経細胞から欠損させたマウスをそれぞれ作製し、それらのマウスの行動を調べました。その結果、両方の欠損マウスは類似した行動障害を示し、その中で特に共通していたのは社会性の欠如、不安の亢進、巣作り行動の減少でした。これは、欠損マウスの神経細胞において、オートファジー機能の欠損が共通の細胞障害を誘導している可能性を示しています。
次に、これらの行動障害の分子機序を調べるために、オートファジー機能欠損により凝集化が増加したタンパク質を網羅的かつ定量的に解析できる新しいプロテオミクス手法(アグリオーム解析法)を開発しました。その結果、抑制性の神経伝達物質GABAの受容体の一つGABAA受容体の細胞表面への輸送に関わるGABARAPL2というタンパク質の凝集化が著しく増大していることが分かりました。さらに、3種類存在するGABARAPタンパク質群(GABARAP、GABARAPL1、GABARAPL2)の全てが、オートファジー機能が欠損すると著しく増加するタンパク質p62の凝集体と共局在(共凝集)していることが明らかになりました(図1)。
オートファジーは、タンパク質を分解しアミノ酸をリサイクルする工場であり、その際ゴミ収集車の役割を担うp62は自らも分解されます。しかし、オートファジー機能が欠損すると、p62は行き場を失って凝集体を形成します。その凝集体に他のさまざまなタンパク質も巻き込まれて共凝集し、それが細胞障害を引き起こすことが示唆されています。
このことから、GABARAPタンパク質群はp62凝集体に巻き込まれることで、GABAA受容体の細胞表面への輸送機能が果たせなくなったと考えられます。実際に、Atg7欠損神経細胞表面におけるGABAA受容体調べたところ、その量が低下していることが分かりました(図2)。
また、Atg7欠損神経細胞では、GABAからの入力を適切に受け取ることができないため、過活動になることが電気生理実験からも明らかになりました。さらに重要なことに、野生型の神経細胞にp62を過剰発現させて凝集体を形成させたときにも、神経細胞表面におけるGABAA受容体の量が低下しました。これらの結果から、可溶・凝集性p62の量がGABARAPタンパク質群の凝集状態に影響を与え、神経細胞表面におけるGABAA受容体の量を制御していることが明らかになりました。
次に、Atg7欠損神経細胞において、p62と共凝集しないようにしたGABARAPL2変異体を発現させたところ、細胞表面におけるGABAA受容体の量が回復しました。この結果は、p62とGABARAPタンパク質群との共凝集化が、細胞表面におけるGABAA受容体量の減少、ひいては神経細胞における興奮性と抑制性のバランスが低下したことを示しています。
さらに、mTORシグナルを負に制御し、かつ自閉症様の行動を示すことが知られている結節性硬化症[12]の原因でもあるTSC2の遺伝子発現量を低下させました。その結果、p62の凝集形成とともに、GABARAPタンパク質群がその凝集体に巻き込まれ、神経細胞表面のGABAA受容体量も減少したことが分かりました。これらの結果から、TSC2機能の低下によって抑制性のシグナル入力を受け取る受容体が減り、神経細胞の興奮性が高まる理由を分子レベルで明らかにすることができました。
最後に、ヒト自閉症患者の死後脳を用いて関連タンパク質の定量を行ったところ、凝集したGABARAPタンパク質群およびp62の量が増大しており、またそれは、TSC2の発現量と負の相関が見られました。この結果は、頻度は低いものの、Atg7やGABARAPタンパク質群の遺伝子欠損が自閉症や知的障害に関わるという遺伝学的な報告とも合致し、GABARAPタンパク質群の凝集化による機能不全が自閉症様の行動を誘導する一因になっていることを示唆しています。
今後の期待
本研究で、mTOR-オートファジーとGABAシグナルが深く関連すること、およびその機能障害によって社会性などの行動異常が現れることを示しました。本成果は、これらのシグナルの異常が関与する発達障害や精神疾患に対して、GABARAPタンパク質の凝集化を阻害することが症状を緩和させるための有効な手段を提供するものと考えられ、新たな治療法の開発へ向けた波及効果をもたらしました。
また、神経系の疾患にとどまらず、がんや糖尿病などの他の疾患においても、mTORシグナルやGABAシグナルの関与が示唆されているため、本研究で得られた知見は、これらの研究への波及効果も期待できます。
原論文情報
Kelvin Kai-Wan Hui, Noriko Takashima, Akiko Watanabe, Thomas E. Chater, Hiroshi Matsukawa, Yoko Nekooki-Machida, Per Nilsson, Ryo Endo, Yukiko Goda, Takaomi C. Saido, Takeo Yoshikawa, Motomasa Tanaka, “GABARAPs dysfunction by autophagy deficiency in adolescent brain impairs GABAA receptor trafficking and social behavior”, Science Advances, 10.1126/sciadv.aau8237
発表者
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
研究員 ケルヴィン・フイ(Kelvin Hui)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- オートファジー
- 細胞が自らの細胞内成分を分解する主要メカニズム。細胞内のオルガネラ(細胞小器官)や安定なタンパク質などの細胞質成分をオートファゴソーム(小胞)へ取り込み、リソソームで分解する。
-
- 自閉症
- コミュニケーションなどの社会性の障害や興味や行動の偏りという特徴を示す発達障害の一つ。多様な表現型があるため、自閉症スペクトラム障害ともいわれる。
-
- 興奮性神経細胞、抑制性神経細胞
- 興奮性神経細胞は、軸索末端からグルタミン酸を放出し他の神経細胞を興奮させる神経細胞。抑制性神経細胞は、主にガンマアミノ酪酸を放出し、他の神経細胞の活動を抑制する神経細胞。
-
- プロテオミクス手法
- タンパク質の機能や構造の解明を目指した網羅的な解析を行うタンパク質実験手法の総称。
-
- p62
- ユビキチン結合領域とLC3(Atg8)結合領域を併せ持つタンパク質で、ユビキチン化されたタンパク質をオートファゴソームへと運ぶ役割を果たす。オートファジーが阻害されたときに著しく増加する。
-
- GABA
- アミノ酸の一つで、脳神経細胞の興奮を抑える抑制性の神経伝達物質。神経細胞のシナプス前部から放出され、シナプス後部の膜上に存在するGABA受容体(A型、B型、C型)と結合し作用する。
-
- GABARAPL2、GABARAPタンパク質群
- オートファゴソームの形成に関わるLC3のホモログであり、GABAA受容体を細胞表面まで運ぶ役割を果たす。マウスにはGABARAP、GABARAPL1、GABARAPL2の三つのホモログが存在する。
-
- mTOR
- エネルギーや栄養、増殖因子などの環境シグナルに反応して、活性化が調節されるタンパク質リン酸化酵素。
-
- TSC1/2
- 結節性硬化症に関わるタンパク質であり、TSC1とTSC2のヘテロ二量体は、mTORを介したシグナル伝達を阻害し、細胞の成長と増殖の調節に関わる。
-
- ユビキチン
- タンパク質分解、DNA修復などさまざまな生命現象に関与する76残基のアミノ酸で構成されるタンパク質。
-
- Atg7
- ニつのユビキチン様タンパク質を活性化するユビキチン活性化酵素であり、細胞のオートファジー機能において重要な役割を担っている。
-
- 結節性硬化症
- TSC1/2の遺伝子異常によって引き起こされ、mTOR活性の抑制が効かなくなるために過活性になり、その結果として、てんかんや自閉症様の症状などが現れる疾患。
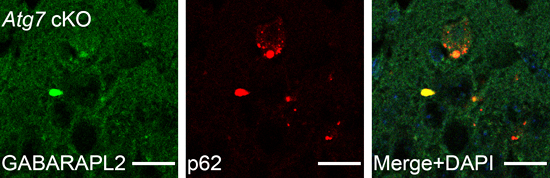
図1 Atg7欠損マウスの海馬の興奮性神経細胞におけるGABARAPL2とp62の共凝集
左(緑)はGABAA受容体の細胞表面への輸送に関わるGABARAPL2の凝集で、中(赤)はオートファジー欠損マーカーp62の凝集。右は二つの画像を合体させたもので、GABARAPL2とp62が共凝集(黄色)していることが分かる。
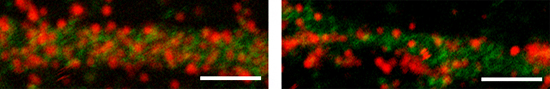
図2 正常およびAtg7欠損マウス脳の神経細胞における細胞表面のGABAA受容体の減少
左は正常マウス脳、右はAtg7遺伝子を欠損させたマウス脳の神経細胞。赤色はGABAA受容体、緑色は抑制性神経細胞を示す。欠損マウス脳の神経細胞(右)でGABAA受容体が減少していることが分かる。