2023-12-08 国立がん研究センター,大阪医科薬科大学
発表のポイント
- 大規模膀胱がんコホート解析により、「FGFR3遺伝子の変異をもつ症例(以下、FGFR3変異症例)」の中には「腫瘍免疫微小環境の多様性」がみられること、その一部に免疫チェックポイント阻害薬が効きやすいタイプがあることを突き止めました。
- 比較的早期の表在性膀胱がんと、より進行した筋層浸潤性膀胱がんとでは、FGFR3変異による予後への影響が異なり、筋層浸潤性膀胱がんのFGFR3変異症例では「基底上皮細胞系の遺伝子パスウェイ」が活性化しているとわかりました。
- 本研究の成果応用として、「膀胱がんの分子サブタイプ」と「FGFR3変異」の有無を組み合わせて検討することで、膀胱がんに対する免疫チェックポイント阻害薬の奏効率をより正確に予測できるようになると考えられます。
- 分子サブタイプとFGFR3変異の有無を組み合わせることで、膀胱がんの治療標的候補の同定や、組み合わせに応じた免疫複合療法の開発が可能になると期待できます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野博行)がんRNA研究分野(分野長:吉見昭秀)、大阪医科薬科大学(学長: 佐野浩一、大阪府高槻市)泌尿器科学教室(教授:東治人、研究チームリーダー:小村和正)らの研究チームは、膀胱がんの臨床検体389例を対象に次世代シーケンシング、病理組織解析、臨床予後情報の包括的解析を行い、日本人集団における膀胱がんのFGFR (fibroblast growth factor receptor) 遺伝子変異(融合遺伝子(注1)を含む)の割合と、変異症例における腫瘍免疫微小環境(注2)の変化について調べました。
その結果、まず、FGFR3変異をもつ症例が、表在性膀胱がんの約45%、筋層浸潤性膀胱がんの約15%に達するとわかりました。このうち、筋層浸潤性膀胱がんにおけるFGFR3変異症例でのみ、基底上皮細胞系の遺伝子パスウェイが活性化していました。この知見は、これまでの報告とは異なるものです。一方、FGFR3変異症例のなかにも、「腫瘍組織への免疫細胞の浸潤が多い、あるいは少ない」といったように腫瘍免疫微小環境の多様性がみられることがわかりました。さらに、「膀胱がんの分子サブタイプ(注3)のうち管腔乳頭サブタイプ(Luminal papillary;LumP)に分類され、FGFR3変異を合わせもつ症例」では、免疫チェックポイント阻害薬(注4)の奏効率が特に高いことを突き止めました。
これらの成果応用として、膀胱がんの「分子サブタイプ」と「FGFR3遺伝子変異の有無」の両者を組み合わせて検討することで、免疫チェックポイント阻害薬のより正確な奏効率予測や、個別化された高精度な医療(precision medicine)の実現に寄与することが期待できます。
本研究成果は、2023年11月18日付で英国科学雑誌 「Molecular Cancer」 に掲載されました。
背景
FGFR遺伝子の変異(融合遺伝子を含む)は、膀胱がんの予後を左右する主要なドライバー遺伝子として知られています。FGFR変異頻度については、欧米での大規模シーケンスデータ解析による報告がありましたが、本邦では大規模な解析は行われていませんでした。欧米の報告では、FGFR3変異症例では腫瘍への免疫細胞(Tリンパ球細胞)の浸潤が少ない傾向にあることを根拠に「免疫チェックポイント阻害薬の効果は限定的である」と推測されていましたが、近年、この推測に否定的な前向き無作為比較試験の結果が報告され、見解が定まっていませんでした。
研究方法
膀胱がん389例、正常膀胱組織35例の全エクソームシーケンスおよびRNAシーケンス(注5)、ティッシュマイクロアレイ(注6)を用いた免疫染色、臨床的な治療成績や予後のデータを用いた包括データ解析を行いました。本研究は、国立がん研究センター研究倫理審査会No. 2020-486(承認日2021年2月09日)、大阪医科薬科大学研究倫理委員会No. 2305-11(承認日2017年11月24日)、No. 2344-10(承認日2017年11月24日)、No. 2523-3(承認日2018年07月27日)、No. 2808-2(承認日2020年01月10日)、大阪医科薬科大学医学研究専門部会No. 2571-6(承認日2018年11月07日)において承認を受けています。
研究結果
1.表在性膀胱がんと筋層浸潤性膀胱がんでは、FGFR3変異による予後への影響が異なる
124例の表在性膀胱がんのうち、FGFR3変異は44%(アミノ酸置換変異:46例、融合遺伝子:9例)にみられました。一方、265例の筋層浸潤性膀胱がんでは、FGFR3変異は15%(アミノ酸置換変異:31例、融合遺伝子:8例)にみられました。予後をくらべると、表在性膀胱がんのFGFR3変異症例では病勢非進行生存期間(progression free survival)が長い傾向にあり、筋層浸潤性膀胱がんではFGFR3変異の有無による全生存率(overall survival)に差はみられませんでした(図1)。
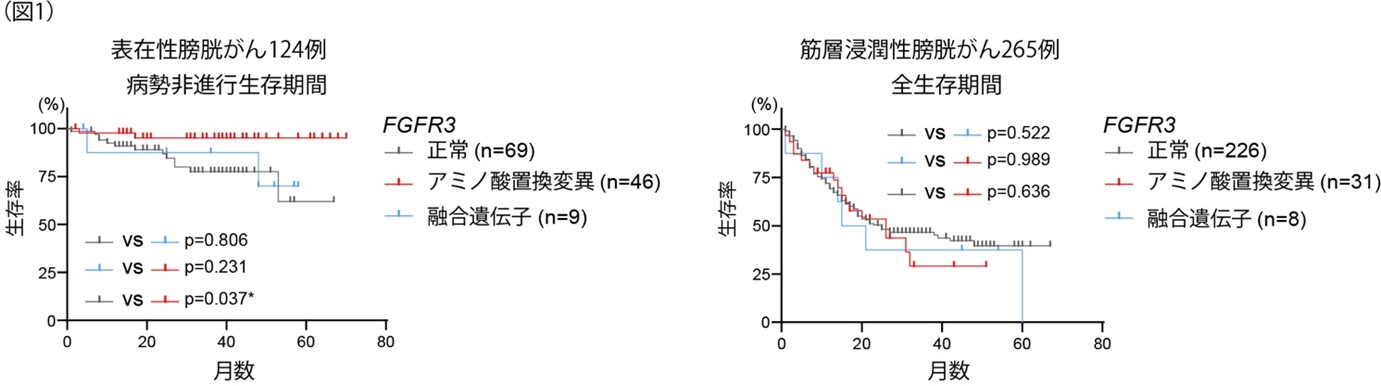
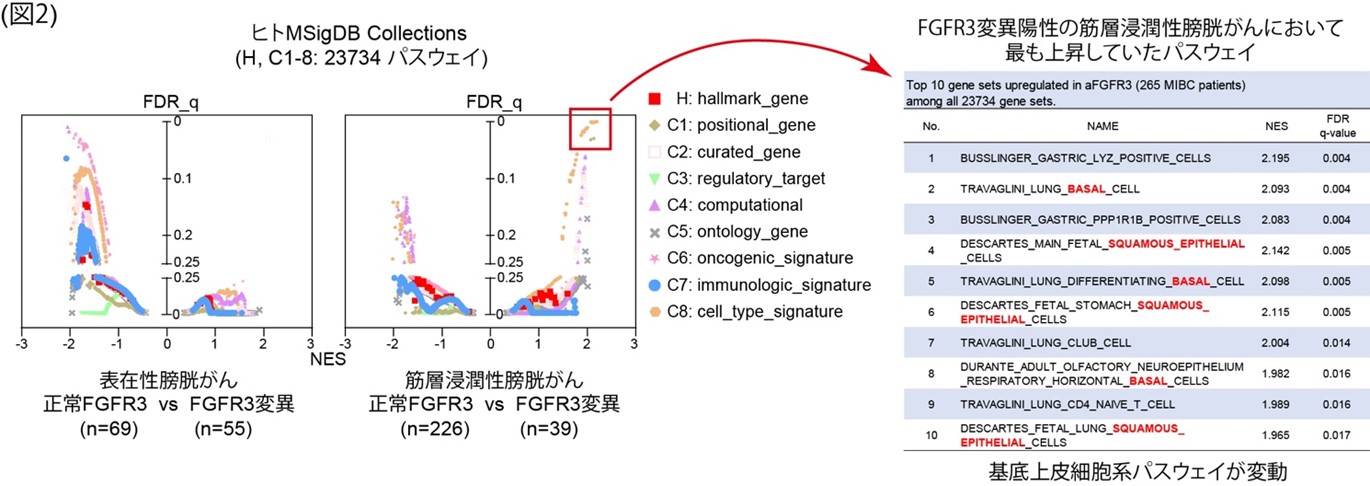
Gene Set Enrichment Analysis (GSEA) (注7)においてFGFR3変異症例における遺伝子発現解析を網羅的に解析したところ、表在性膀胱がんと筋層浸潤性膀胱がんとでは大きく異なることがわかり、特に筋層浸潤性膀胱がんではFGFR3変異により「基底上皮細胞系の遺伝子パスウェイ」が有意に活性化していました(図2)。このことは、「FGFR3変異はLuminal系の遺伝子パスウェイに影響を与える」という従来の説だけではなく、基底細胞系の遺伝子パスウェイにも影響を与えることを示唆しています。
2.FGFR3変異症例のなかにも腫瘍免疫微小環境の多様性が存在し、免疫チェックポイント阻害薬の治療効果を左右する
腫瘍免疫微小環境にFGFR3変異がどのように影響しているかを解析するために、シーケンスデータからのデコンボリューション解析(注8)を行いました。まず、がん組織を細胞タイプとその細胞状態まで細分化し、デジタルに篩分けをおこなうことで10種類の「がん組織ごとのエコタイプ(注9)(CE1-CE10)」を得ました。その上で、FGFR3変異の有無を調べたところ、FGFR3変異はCE2, CE7, CE8のエコタイプによくみられることがわかりました(図3)。特にFGFR3変異をもつ筋層浸潤性膀胱がんにおいては、CE2とCE8が多くみられました。この2群間では、線維芽細胞などの状態を規定する遺伝子群の発現に差が認められました。
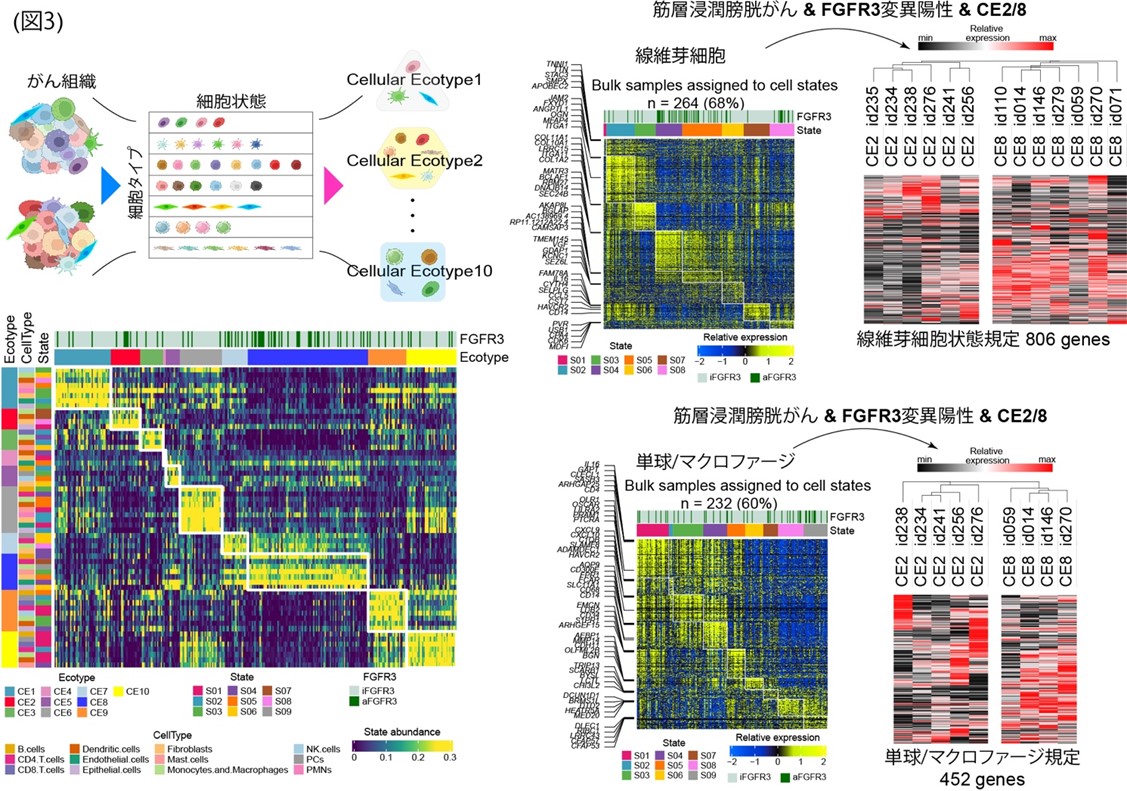
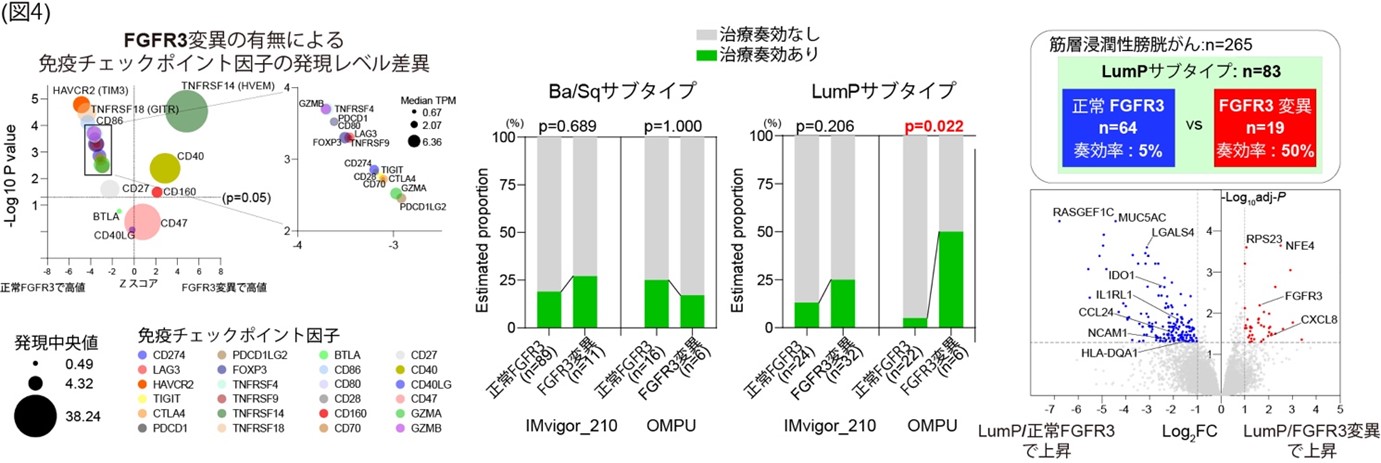
FGFR3変異の有無と免疫チェックポイント因子の発現差異について調べたところ、正常FGFR3症例群ではTIM3等の疲弊リンパ球マーカー(注10)が上昇し、FGFR3変異群ではHVEM, CD40などの因子が上昇していました(図4)。今回、解析対象とした389例中72例が経過観察中に免疫チェックポイント阻害薬で治療されていることから、その治療奏効について解析しました。その結果、FGFR3変異症例群での奏効率は31%と、正常FGFR3症例群の20%よりも高いことが示され、欧米のIMvigor210試験でのデータセットを用いた解析でも同様の傾向を確認しました。最後に、膀胱がんの分子サブタイプと遺伝子変異の有無を組み合わせた治療奏効率について解析しました。FGFR3変異症例では、基底/扁平サブタイプ(Ba/Sq)と管腔乳頭サブタイプ(LumP)が多くみられますが、LumP/FGFR3変異症例群とLumP/正常FGFR3症例群を比較したところ、治療奏効率に大きな違いがみられることがわかりました。例えば、LumP/FGFR3変異症例群では奏効率50%、LumP/正常FGFR3群では奏効率5%などとなり、奏効率の低いLumP/正常FGFR3の症例では、IDO1, CCL24, IL1RL1, LGALS4, NCAM (CD56)などの因子が治療標的となる可能性が示されました(図4)。
展望
従来、FGFR3変異をもつ症例は一様に「管腔(Luminal)系サブタイプ」と関連付けられ、免疫チェックポイント阻害薬の効果が低いと考えられていました。しかし、今回、日本人の大規模膀胱がんデータを用いた解析を行い、FGFR3変異症例における免疫チェックポイント阻害薬の効果が必ずしも一様に低いわけではないことや、FGFR3変異症例内に腫瘍免疫微小環境の多様性がみられることなどが明らかになりました。さらに、膀胱がんの分子サブタイプと遺伝子変異を固定的に関連付けるのではなく、分子サブタイプと遺伝子変異を細かく組み合わせることによって、より正確な治療奏効率の予測が可能になることを示し、分子サブタイプごとの治療標的候補を同定しました。本研究の成果応用として、症例ごとのprecision medicineや免疫複合療法の実現が期待されます。
論文情報
雑誌名
Molecular Cancer
タイトル
The Impact of FGFR3 Alterations on the Tumor Microenvironment and the Efficacy of Immune Checkpoint Inhibitors in Bladder Cancer
著者
Kazumasa Komura#,*, Kensuke Hirosuna#, Satoshi Tokushige#, Takuya Tsujino, Kazuki Nishimura, Mitsuaki Ishida, Takuo Hayashi, Ayako Ura, Takaya Ohno, Shogo Yamazaki, Keita Nakamori, Shoko Kinoshita, Ryoichi Maenosono, Masahiko Ajiro, Yuki Yoshikawa, Tomoaki Takai, Takeshi Tsutsumi, Kohei Taniguchi, Tomohito Tanaka, Kiyoshi Takahara, Tsuyoshi Konuma, Teruo Inamoto, Yoshinobu Hirose, Fumihito Ono, Yuichi Shiraishi, Akihide Yoshimi*, Haruhito Azuma
(#equal contribution; *corresponding)
DOI
10.1186/s12943-023-01897-6
掲載日
2023年11月18日
URL

研究費
<吉見昭秀>
- 日本学術振興会 科学研究費補助金(21H04828、課題名:スプライシング変異がんの統合的理解と画期的治療法開発)
- 国立研究開発法人日本医療研究開発機構(AMED)(医療分野国際科学技術共同研究開発推進事業戦略的国際共同研究プログラム (SICORP)日・カナダ共同研究、課題名:急性骨髄性白血病の多層的なエピゲノム・エピトランスクリプトームの理解に基づく治療標的探索)
- 国立研究開発法人日本医療研究開発機構(AMED)(先端的バイオ創薬等基盤技術開発事業、課題名:核酸医薬への応用を目指した非環状型人工核酸の開発)
- 国立研究開発法人日本医療研究開発機構(AMED)(橋渡し研究プログラム、課題名:がん抑制遺伝子を標的とした非臨床試験シーズ)
- 国立がん研究センター研究開発費(2020-A-2および2023-S-6)
- 武田科学振興財団 武田報彰医学研究助成
<小村和正>
- 日本学術振興会 科学研究費補助金(21H03070、課題名:がん化学放射線療法再発症例における腫瘍合成致死誘導治療法の確立)
- 日本泌尿器科学会がんトランスレーショナル研究助成
- 内藤記念次世代育成支援研究助成金
- 鈴木謙三記念医科学応用研究財団助成金
- SGHがん研究助成
用語解説
(注1)融合遺伝子
融合遺伝子は、通常は異なる染色体上に別々に存在する2つの遺伝子が、何らかの原因で結合し、新しい組み合わせを作る現象を指します。この現象によって本来とは機能の異なる新たな遺伝子ができて、異常な細胞増殖やがんの原因となることがあります。
(注2)腫瘍免疫微小環境
腫瘍免疫微小環境は、がん細胞が存在する組織や部位周辺の環境を指します。がんは、周囲の組織や免疫と相互作用し、成長や転移を進めるために微小環境を活用します。免疫細胞や炎症、血管などが含まれ、これらの要素ががんの進行に影響を与えることがあります。
(注3)分子サブタイプ
分子サブタイプは、分子レベルでの遺伝子発現の特徴や生物学的性質に基づいて、患者さんをサブグループに細分化するための分類の一種です。これにより、同じ疾患であっても、異なる分子サブタイプの患者群が異なる治療応答や予後を示すことが判明することがあります。分子サブタイプの理解は、治療戦略の最適化や患者さんに対する個別化された治療法の開発に役立つ可能性があります。
(注4)免疫チェックポイント阻害薬
免疫チェックポイント阻害剤は、がん治療の一形態で、がん細胞を排除しようとする免疫系の働きを活性化させるための薬物です。がん細胞は一般に免疫攻撃を回避し用とする傾向があり、免疫チェックポイント阻害薬はそのような働きを解除して、免疫攻撃を活性化させることを目的とします。
(注5)全エクソームシーケンスおよびRNAシーケンス
ゲノムはDNAで構成され、遺伝子はDNAからRNAに転写され、その後蛋白質に翻訳されます。エクソンは主に蛋白質の設計図となる部分のDNA情報を指します。全エクソームシーケンスは、遺伝子に関連する変異や異常を調査するためにエクソンの配列を調べる手法です。また、RNAシーケンスは、どの遺伝子がどれだけRNAとして発現しているかなどを調査し、細胞内の様々な生物学的プロセスを解析する手法です。
(注6)ティッシュマイクロアレイ
ティッシュマイクロアレイ(Tissue Microarray, TMA)は、多数の組織サンプルを小さなマイクロアレイに配置し、同時に複数の組織や細胞サンプルを処理・解析するための手法です。これにより、大量の組織サンプルを同時に調査することが可能となります。
(注7)Gene Set Enrichment Analysis (GSEA)
GSEAは高次元の遺伝子発現データから生物学的な意味を導き出すための統計的手法の一つです。個々の遺伝子というよりは、複数の遺伝子の発現の変動に着目し、遺伝子発現の変動パターンが特定の生物学的な過程やシグナル伝達経路に関連しているかどうかを調べるのに使用します。
(注8)デコンボリューション解析
デコンボリューション解析は、複雑なデータや信号から元の成分や構造を抽出する数学的な手法を指します。今回の研究では、がん細胞と腫瘍免疫微小環境の様々な種類の細胞を含むデータをまとめて解析した後に、どのような細胞のどのような状態のものが、どのくらいいるのか、ということを解きほぐして有用な情報を取り出すために使用しています。
(注9)エコタイプ
同じ細胞の種類であっても、異なる部位や環境によって異なる生物学的特性を持つことがあり、ここではそれをエコタイプと呼んでいます。
(注10)疲弊リンパ球マーカー
リンパ球などの免疫系の細胞は体を守るために働きますが、外部からの刺激やがん細胞に対する反応でリンパ球は疲労してしまうことがあり、そのようなリンパ球を疲弊リンパ球と呼びます。こうした疲弊リンパ球はTIM3などのいわゆる疲弊リンパ球マーカーを発現することが知られています。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所
研究所 がんRNA研究分野 分野長 吉見昭秀
大阪医科薬科大学 医学部
泌尿生殖・発達医学講座 泌尿器科学教室 講師 小村和正
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
大阪医科薬科大学
総務部企画・広報課