2023-12-14 岩手医科大学,東京大学
岩手医科大学泌尿器科学講座の田村大地大学院生と小原航教授、医歯薬総合研究所医療開発研究部門の西塚哲特任教授らの研究グループは、東京大学大学院新領域創成科学研究科メディカル情報生命専攻生命システム観測分野の鈴木穣教授らと共同で、血液中、尿中に存在する患者特有のがん由来DNAの追跡検査により上部尿路上皮癌術後の再発検出が可能であることを明らかにしました。
研究成果のポイント
◆上部尿路上皮癌は術後再発しやすい癌ですが、現在は侵襲性の高い検査もしくは感度の低い検査で術後フォローアップを行っていることから、患者特有のがん由来DNA検査がバイオマーカーとなりうるかを検証しました。
◆上部尿路上皮癌において、血中・尿中がん由来DNA検査が術後再発を高感度に検出可能であることを示した世界で初めての研究です。
発表内容
【背景】
上部尿路上皮癌(腎盂癌、尿管癌)は全尿路上皮癌(膀胱癌、腎盂癌、尿管癌)の約5%と比較的稀な癌ですが、術後再発や転移をきたしやすく予後不良とされています。しかし、術後の検査はCTや膀胱鏡、尿細胞診等の感度が低いもしくは侵襲性の高い検査を行っており、再発や転移を鋭敏に検出しうる低侵襲のバイオマーカーが望まれています。
腫瘍循環DNA(ctDNA)は体液中に存在する腫瘍細胞由来のDNAであり、近年癌に対するバイオマーカーとしての妥当性が報告されています。ctDNA解析のためのサンプルは血液を用いることが多いですが、尿路上皮癌は尿に接するため、尿はサンプルとして有用と考えられます。これまでに上部尿路上皮癌におけるctDNAに関する研究は少なく、血液と尿の両者を用いて解析を行った研究はこれまでにありません。
本研究の目的は、上部尿路上皮癌の術後経過における血中及び尿中ctDNAの変異遺伝子量の変化が術後再発を検出しうるかを検証することです。
【方法】
上部尿路上皮癌に対して手術を施行した症例23例を対象とし、手術検体の腫瘍組織からDNAを抽出し、次世代シークエンサー(next generation sequencing; NGS)による全エクソームシークエンスとTERTプロモーターに対する変異解析を行いました。
まず、手術前後に血漿及び尿上清を採取しDNAを抽出しました。腫瘍の遺伝子変異解析結果をもとに、症例毎に追跡する症例特異的遺伝子変異を選択し、デジタルPCR(digital polymerase chain reaction; dPCR)を用いて変異アリル頻度(variant allele frequency: VAF)を術後2年間モニタリングしました。dPCRで解析するためのプライマープローブセットは主に岩手医科大学医歯薬総合研究所医療開発研究部門で開発したライブラリーから選択しました。既存の検査法(CT,膀胱鏡,尿細胞診)と比較し術後モニタリングにおけるバイオマーカーとしての妥当性を検証しました。さらに、ctDNAのVAFやその変化が術後再発と関連するかを検証しました。
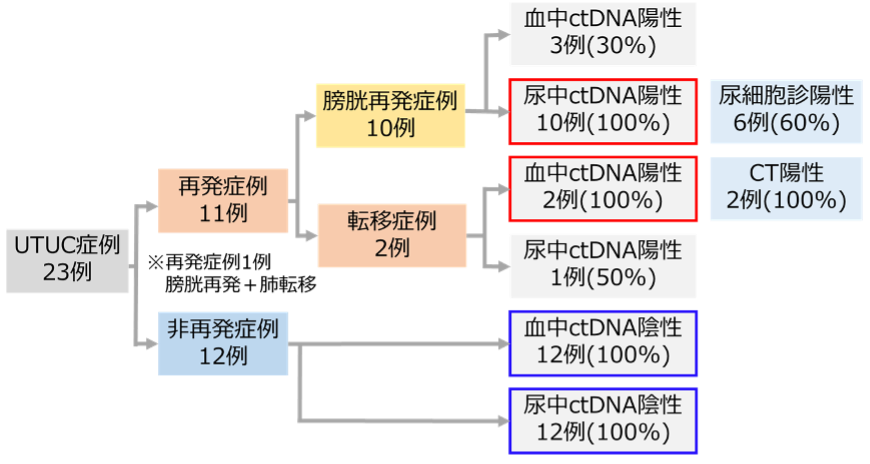
図1.ctDNAモニタリング結果
ctDNAモニタリングにより、膀胱再発では全例で尿中ctDNAが陽性となり、転移再発では全例で血中ctDNAが陽性となりました。なお、転移症例のうち1例は膀胱再発、転移再発を同時に認めております。一方、非再発症例では全例でctDNAは陰性を維持していました。
【結果】
各症例において追跡する症例特異的遺伝子変異を選択した結果、83%の症例でOTS-1000exに含まれる変異を有していました。残りの症例も新規にプローブを合成することで、全例でctDNAモニタリングが可能でした。術前に採取した血漿および尿を用いてdPCRを行ったところ、96%の症例で症例特異的変異が検出されました。
術後再発を来した症例において、膀胱再発では全例で再発時に尿中ctDNAが陽性となり、尿細胞診よりも高感度に再発を検出可能でした。転移再発では全例で血中ctDNAが陽性でした。特に膀胱再発症例では尿中ctDNAが既存の検査よりも約2カ月早く陽性となりました。術後無再発症例では、全例で既存のフォローアップが始まる術後3カ月以降はctDNA陰性を維持していました。
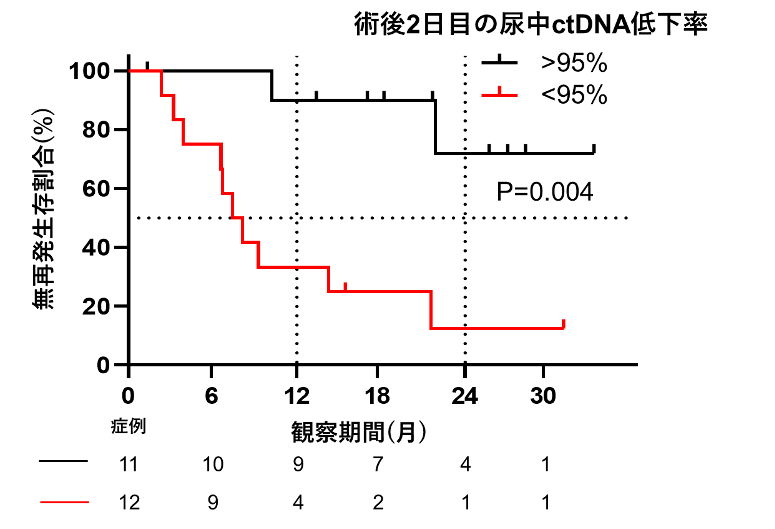
術後再発症例と非再発症例において、手術前後のVAFの低下率を比較したところ、尿における術前と術後2日目のVAF低下率が再発症例において有意に低いことがわかりました。術後再発におけるリスク因子を検討した結果、尿中ctDNAにおける術後2日目のVAF低下率が低い群で有意に無再発生存期間が短いことがわかりました。
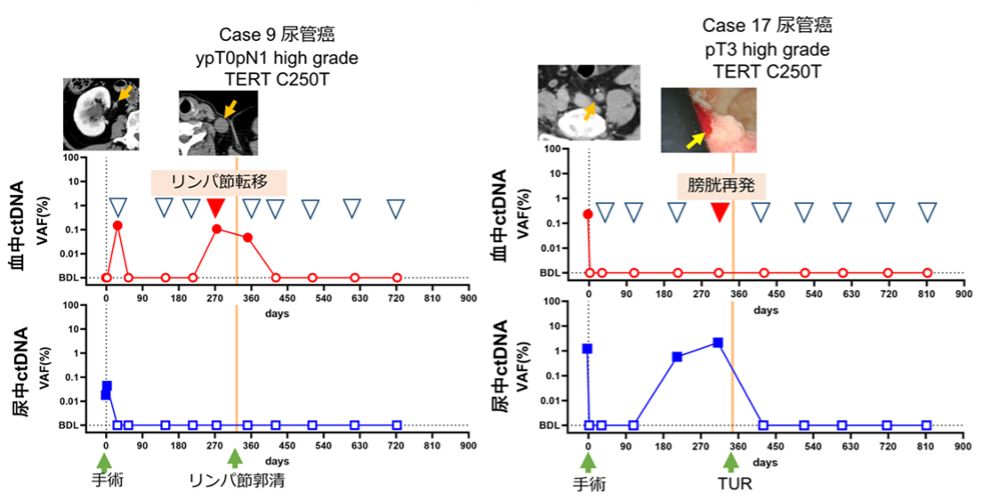
図2.再発症例のctDNAモニタリング
白の矢頭は臨床的無再発、赤の矢頭は臨床的再発を表しています。リンパ節転移を来した症例は血中ctDNAが陽性となり、膀胱再発を来した症例では尿中ctDNAが陽性となりました。特に膀胱再発症例の方では、臨床的再発よりも早期に尿中ctDNAが陽性となりました。
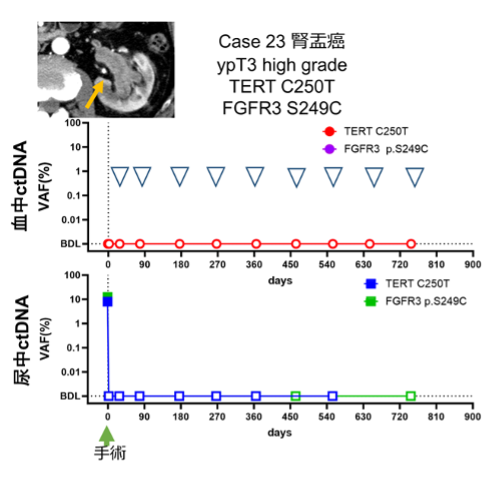
図3.無再発症例のctDNAモニタリング
この無再発症例では術前尿中ctDNAが陽性でしたが、術後陰性となり、そのまま陰性を維持しています。
図4.術後2日目の尿中ctDNA低下率と生存曲線
術後2日目に尿中ctDNAのVAFが95%以上低下しなかった患者は低下した患者と比較し再発までの期間が短い結果となりました。
【結論】
本研究において、全ての症例に対してdPCRを用いたctDNAによる術後モニタリングが可能であり、術後モニタリングの結果、再発症例全例で症例特異的変異が検出可能であったため、バイオマーカーとして妥当であることが示唆されました。さらに、尿におけるVAF低下率が術後再発のリスク因子として同定され、ctDNAは術後再発予測に有用である可能性が示唆されました。
【今後の展望】
◆ctDNA検査は再発検出や無再発の確認を行うことができるため、膀胱鏡等の侵襲的検査を減少させることができる可能性があります。
◆術後再発リスクを予測できる可能性があり、術後補助療法の治療適応に有用である可能性が考えられます。
◆がんに対する血液を用いたctDNAモニタリングは現在岩手医科大学で「OTS-アッセイ」として自由診療を開始しております。
用語解説
- 上部尿路上皮癌:腎盂、尿管をまとめて上部尿路と呼び、上部尿路に発生した腫瘍のうち、最も多い組織型である尿路上皮癌を上部尿路上皮癌と呼びます。
- バイオマーカー:血液や尿などの体液や組織に含まれる、たんぱく質や遺伝子などの生体内の物質で、病気の変化や治療に対する反応に相関し、指標となるもの。
- ctDNA:血中循環腫瘍DNA (circulating tumor DNA)は、がん細胞のDNAが細胞死などにより血液中に漏れ出したもので、短く断片化されやがて体外に排出されます。がん細胞がもつDNAの異常を血液で調べることができるため、がん診断への利用が期待されています。しかし、進行がんでも血液中の全遊離DNAに含まれるがん由来のDNAは1%以下と微量であることが多く、高感度の検出技術が必要です。
- 次世代シークエンサー:DNAを構成する塩基の結合順を表したものが塩基配列であり、塩基配列を決定することをシークエンシングと呼びます。シークエンスを行う装置をシークエンサーと呼び、次世代シークエンサーの登場により同時に大量のシークエンスを行うことが可能となり、遺伝子変異解析が飛躍的に進歩しました。
- 全エクソームシークエンス:DNAの塩基配列の中でたんぱく質合成の情報をもつエクソン領域のみを全てシークエンスすること。全ての塩基配列をシークエンスするよりも低コストで効率的に疾患関連遺伝子変異が検出できます。
- デジタルPCR(dPCR):デジタルPCRはサンプル中に含まれる個々の分子の数をカウントして定量を行う新しい技術で、従来のPCR法に比べ正常サンプル中に01%程度のレベルでわずかに含まれる希少な分子を同定・定量することが可能な手法です。
- 変異アリル頻度(VAF):同じ位置にある遺伝子に複数の種類がある場合、その個々の遺伝子をアリルと呼び、遺伝子変異をもつアリルを変異アリルと呼びます。組織全体の中での変異アリルの頻度を変異アリル頻度(VAF)と呼び、ctDNAにおけるVAFは体内の腫瘍量と相関します。
原著論文
発表雑誌名:Cancer Science
(DOI : https://doi.org/10.1111/cas.16025)
論文タイトル:Postoperative recurrence detection using individualized circulating tumor DNA in upper tract urothelial carcinoma
著者:Daichi Tamura1, Masakazu Abe1,2, Hayato Hiraki2, Noriyuki Sasaki2, Akiko Yashima-Abo2, Daiki Ikarashi1, Renpei Kato1, Yoichiro Kato1, Shigekatsu Maekawa1, Mitsugu Kanehira1, Ryo Takata1, Kazuhiro Maejima3, Shota Sasagawa3, Masashi Fujita3, Yutaka Suzuki4, Hidewaki Nakagawa3, Takeshi Iwaya5, Satoshi S. Nishizuka2, Wataru Obara1
所属
- Department of Urology, Iwate Medical University School of Medicine, Yahaba, Japan
岩手医科大学 泌尿器科学講座
- Division of Biomedical Research & Development, Iwate Medical University Institute for Biomedical Sciences, Yahaba, Japan
岩手医科大学 医歯薬総合研究所 医療開発研究部門
- Laboratory for Cancer Genomics, RIKEN Center for Integrative Medical Sciences, Yokohama, Japan
理化学研究所 生命医科学研究センター がんゲノム研究チーム
- Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo, Kashiwa, Japan
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻生命システム観測分野
- Department of Clinical Oncology, Iwate Medical University School of Medicine, Yahaba, Japan
岩手医科大学 臨床腫瘍学講座
Corresponding author: Daichi Tamura, Wataru Obara
研究代表者: 田村 大地