2024-01-02 量子科学技術研究開発機構
発表のポイント
- セロトニン1)低下による意欲低下には、「報酬効果の低下」と「億劫感の出現」の2つの要因があることを見出した。
- これらの要因に関与する2種類のセロトニン受容体2)を特定。
- うつなど意欲低下や意欲障害の原因理解やその改善法を理解する上で重要な手がかり。
概要
量子科学技術研究開発機構(理事長 小安重夫、以下「QST」)量子生命・医学部門 量子医科学研究所 脳機能イメージング研究部 南本敬史次長、堀由紀子研究員らは、セロトニンシステムの不調がやる気を低下させる仕組みを特定しました。
セロトニンは気分や覚醒リズムに関わる重要な脳内の神経伝達物質で、セロトニンの不足はうつ病などで不安や意欲低下が生じる原因のひとつと考えられています。しかし、セロトニンの不足によって意欲低下が生じる詳しい仕組みは分かっていませんでした。
当研究グループは以前の研究で、PET3)を用いて決めた量の薬剤をサルに投与して、意欲に関わるドーパミンの伝達を調節し、ドーパミンによる意欲生成の仕組みを突き止めました[出典1]。今回、同様の手法をセロトニンに適用し意欲低下の要因を探りました。その結果、サルの脳内セロトニンレベルを下げると➀報酬期待による意欲生成(報酬効果)が低下し、➁報酬の大小に関わらず「行動をしたくない」(億劫)という反応が増えることを発見しました。さらに、この意欲低下の2要因には2種類のセロトニン受容体(5-HT1Aと5-HT1B)が関係し、5-HT1A受容体は特に報酬を得るために必要なコストを多く見積る「コスト感の増大」に作用することを発見しました(図1)。
これらの知見は、うつなどの精神疾患の患者でよく見られる「よりコストを感じて行動することが億劫になる」といった意欲障害の脳メカニズムを理解する上で重要な手がかりであり、新しい治療法の開発につながることが期待されます。
本研究は、生物学全般の論文をあつかうオープンアクセス国際雑誌PloS Biologyに2024年1月1日にオンライン掲載されました。本研究は、科学技術振興機構(JST)ムーンショット型研究開発事業「逆境の中でも前向きに生きられる社会の実現」(JPMJMS2295)、およびJSPS科研費(JP22K07339, JP26120733, JP18H04037, JP20H05955)の支援を受けました。
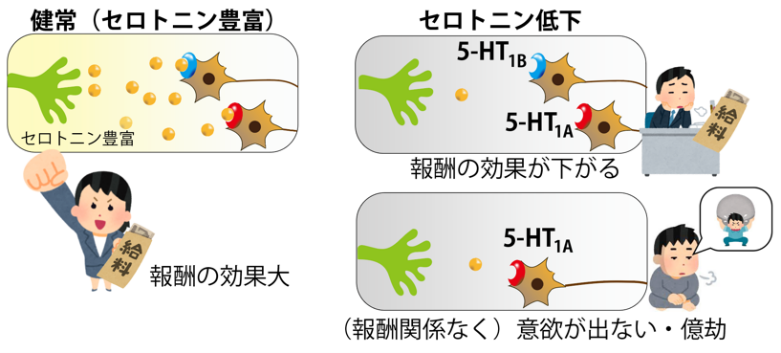
図1.本研究で明らかとなったセロトニン低下による意欲低下の2要因と受容体の関係
研究の背景と目的
セロトニンは気分や覚醒リズムに関わる重要な脳内の神経伝達物です。セロトニンを増やす薬がうつ病などの不安や意欲低下の治療薬として用いられており、セロトニンの低下とうつ病態が深く関わると考えられています。セロトニンの不足は、ヒトや一部の動物において、行動のコストに対して敏感になることや、イラつきなど行動面で様々な障害に関わることが報告されています。
しかし、セロトニンの低下が意欲生成の仕組みにどのように影響し、やる気の低下につながるのか、また脳内に10種類を超えるとされる受容体のうちどれが関係するかなど、その詳しい仕組みはわかっていません。現状の治療薬は即効性が低いなどの問題点もあり、これらの仕組みの理解はその改善においても重要です。
本研究では上記課題を解決すべく、➀報酬の大小による意欲レベルを測定する行動課題を用いて、セロトニン低下による意欲レベルの低下に関わる報酬の効果を定量し、➁4種類の主要なセロトニン受容体に対して、セロトニン伝達の阻害を同程度に揃えた上で、報酬の大小、2種類のコスト(労力・時間)の大小による意欲レベルを測定する行動課題を用いて、意欲の低下におけるセロトニン受容体サブタイプの特定の役割を調べる、という2つのステップで実験を行いました。
研究の手法と成果
1. セロトニン低下は報酬効果の低下とコスト感受性の上昇を伴い意欲を低下させる
行動した「ご褒美」としてもらえると期待される報酬が大きいほど意欲は高まります。このような報酬期待による意欲がセロトニン低下によってどのような影響を受けるかを調べました。
サルにセロトニンの合成を阻害する薬剤を2日間連続で投与して、脳脊髄液のセロトニン濃度を正常状態(コントロール)に比べて30%程度低下させました。次に、サルに縞模様の絵の上に現れる信号の色が変わったら握っているバーを放すという簡単な課題を訓練し、報酬としてジュースを与えました。ジュースの量は4段階あり、縞模様の数と対応しています(図2A)。
学習済みのサルはジュースが8滴貰えるとわかると熱心にバーを放す行動をしますが、1滴しか貰えないときは、バーを放さない不成功試行の割合(エラー率)が増えます。報酬量が1滴から2、4、8滴と増えると、エラー率は1/2、1/4、1/8というように反比例的に減っていき(図2B、コントロール)、意欲が上昇することがわかります。一方、セロトニン濃度が30%低下した状態では、どの報酬量でもコントロールと比べてエラー率が増加し、意欲が低下することがわかりました(図2B)。数理モデル解析により、このエラー率の増加は、報酬期待との反比例の関係からどの程度やる気がでるかを導き出した係数(報酬変数)の低下に加え、報酬量と関係のないエラー率が増加することがわかりました(図2C)。報酬変数の低下は、報酬効果の低下として、そして報酬の大小に関係なくエラー率が増加したことは、一連のバー放し行動のコストに対して敏感になるコスト感受性の上昇(億劫感の出現)として解釈できます。
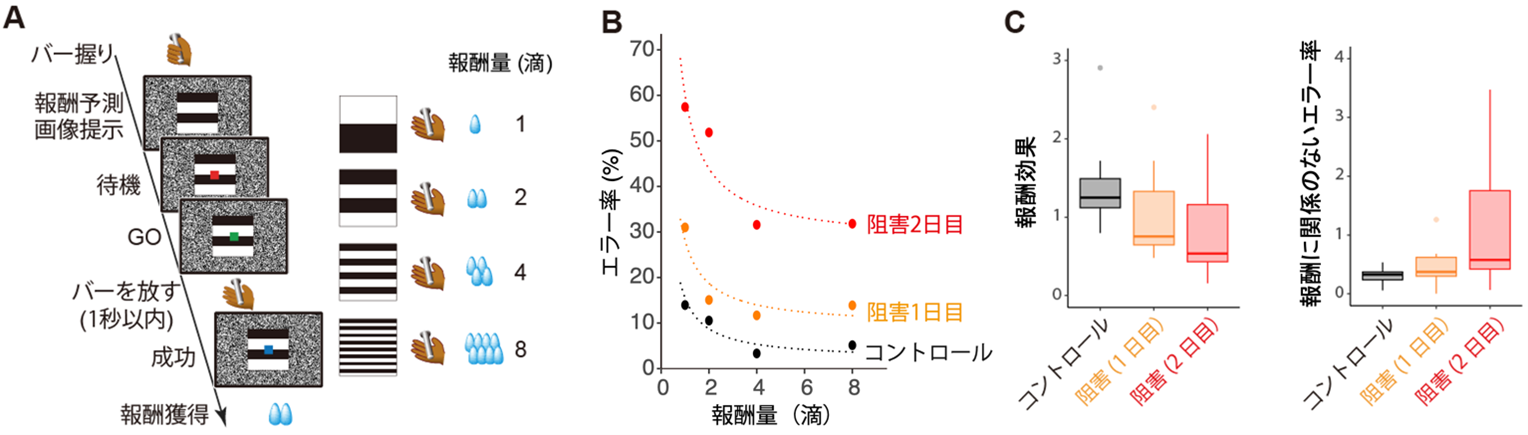
図2:報酬期待に基づく意欲を評価する課題とセロトニン低下による意欲の変化
A:報酬量予測に基づくバー放し行動課題。
B:バー放し行動のエラー率の一例。コントロール(黒)と5-HT合成阻害薬投与1日目(オレンジ)、2日目でのエラー率(赤)。
C:報酬期待から意欲が生じる作用(報酬変数)と報酬量に関係のないエラー率の変化。11例のデータをまとめたもの。
2. セロトニン低下による意欲の低下には5-HT1Aと 5-HT1B受容体が関与する
脳内のセロトニン受容体は10種類以上のサブタイプが存在し、また分布の特異性を持ちながら様々な脳領域に発現しています。主要な4種類の受容体サブタイプ(5-HT1A、5-HT1B、5-HT2A、5-HT4)に特異的に結合するPET薬剤を用いてサルのセロトニン受容体の脳内分布をPETで可視化しました(図3)。例えば5-HT1A受容体は前帯状回や扁桃体、海馬に分布するというように、受容体ごとに分布パターンが異なり、これはヒトのデータともよく一致していました。
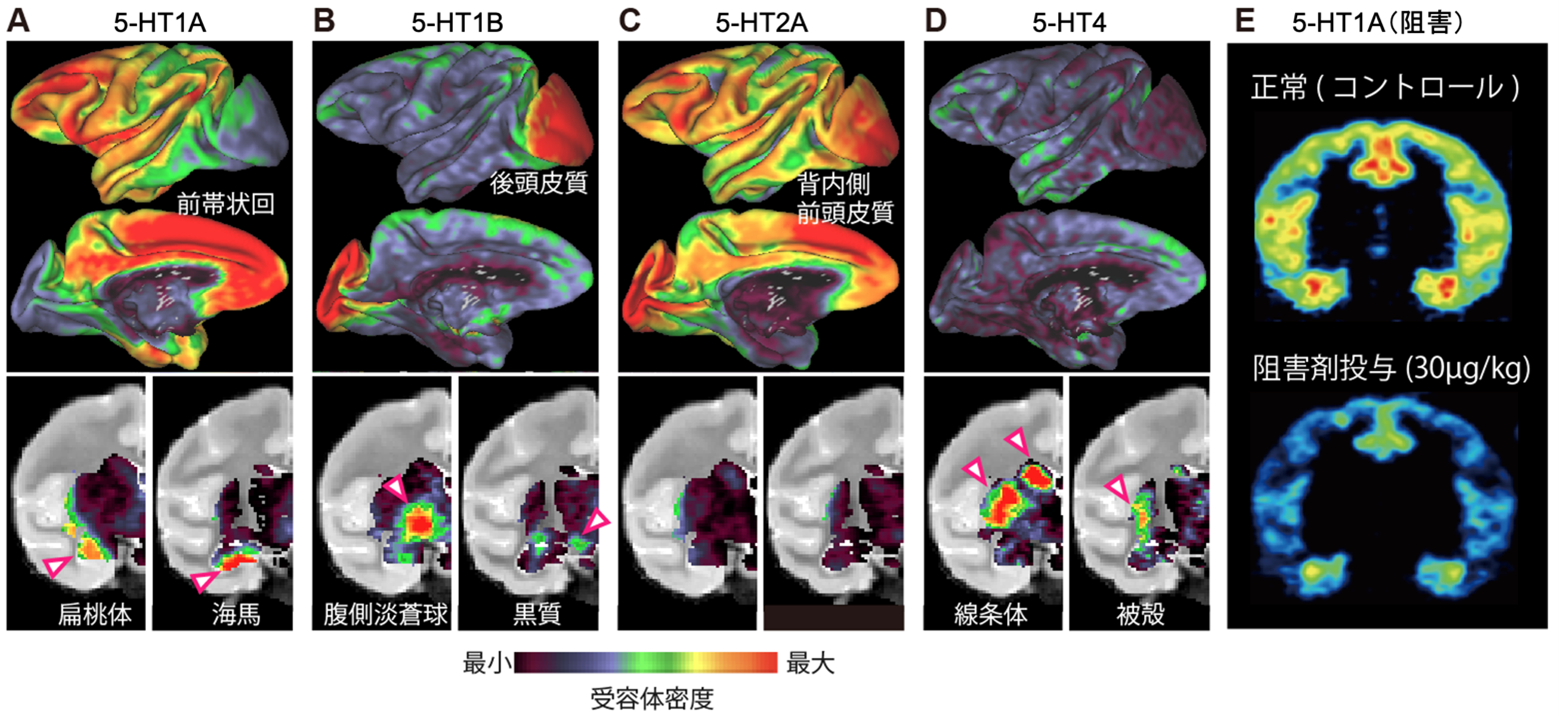
図3:PETイメージングによる受容体サブタイプの発現分布比較(A-D)と阻害剤による受容体伝達遮断薬の効果定量(E)
A:5-HT1A受容体 B:5-HT1B受容体 C:5-HT2A受容体 D:5-HT4受容体。E:正常時(上)と5-HT1A受容体の阻害剤(WAY100635)投与した時の5-HT1A受容体PET画像。PETシグナルの低下の程度から阻害剤が受容体を塞ぐ割合(占有率)を計測できる。
セロトニン低下による意欲低下が4種類の受容体のどれを介したセロトニン伝達低下により生じるかを調べました。セロトニン合成が正常な状態のサルを対象に、4種類の受容体におけるセロトニン伝達を30%程度阻害されるようにセロトニン受容体阻害剤4)の薬量をPETで割り出しました。例えば図3Eのように5-HT1A阻害剤を体重1kgあたり30µg投与すると5-HT1A受容体が阻害剤で占有され、PETシグナルが約30%低下します。すなわちこの薬量で5-HT1A受容体を介したセロトニン伝達が3割程度低下すると考えられます。
このように4種類の受容体のいずれかを30%程度阻害したところ、5-HT1A阻害剤を投与した場合でのみエラー率が上昇し、セロトニン欠乏でみられた報酬効果の低下と報酬量に関係しないエラー率の増加が再現されました(図4)。また、5-HT1B阻害でも弱いながら報酬効果の減少を生じました。
これらのことから、1.で示された報酬効果の低下とコスト感受性の上昇という2つの異なる要因による意欲の低下が、5-HT1Aと5-HT1B受容体を介したセロトニン伝達の低下によって引き起こされることがわかりました。
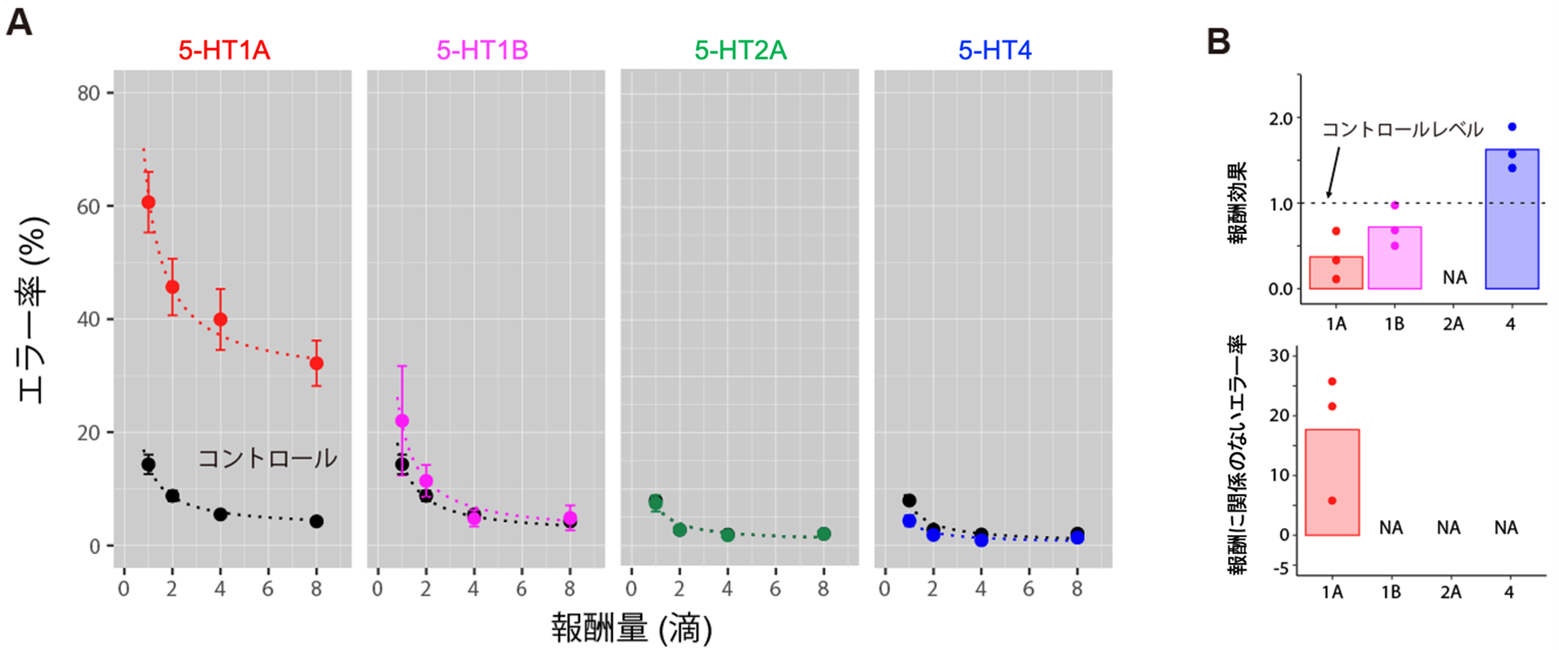
図4:5-HT受容体サブタイプの伝達阻害による報酬期待に基づく意欲低下
A: バー放し行動のエラー率。正常時(コントール、黒)と、5-HT1A受容体(赤)、5-HT1B受容体(ピンク)、5-HT2A受容体(緑)、5-HT4受容体(青)をそれぞれ阻害した時のエラー率を表示。
B:受容体阻害剤投与による影響について、報酬期待から意欲が生じる報酬効果の変化(上)と報酬量によらないエラー率増加(下)を表示。NAは有意な影響がなかったことを示す。
3. 5-HT1A受容体の伝達阻害はコスト感を増大させて意欲を低下させる
ある行動をして報酬を得る際には、その行動自体が大変だったり、時間がかかったりというコストの予測が意欲に関わり、同じ報酬でも見込まれるコストが大きいと意欲は低下してしまいます。1.や2.でみられた報酬の大小に関係なくエラー率が増加するのはこのコスト感が増加するためではないかと考え、2.の方法で4種類の受容体を介したセロトニン伝達を阻害し、各受容体を介した伝達とコスト感の増大を伴う意欲低下に関係があるかを調べました。
サルは先程と同じようにバーを放すと報酬のジュースがもらえますが、報酬は全て同じで、代わりにサルは最大3回バーを放すか、1回バーを放したあと最長で2回分の時間待ちが要求されました。労力と時間コストの情報をあらかじめ試行の開始時に色や模様でサルにわかるようにしました。
その結果、サルは報酬獲得までに予想される労働量・待ち時間のいずれもコストが増えると、その増加分に従ってエラー率が増加し、意欲が下がることが確認できました(図5B、コントロール(黒))。5-HT1A受容体を阻害すると、労力コスト、時間コストの条件いずれでも、コスト増加にしたがってエラー率が増加する割合が上昇しました。(図5B、赤)。これは5-HT1A受容体を介したセロトニン伝達低下がコスト感を高めることで意欲を低下させる働きがあると解釈できました。
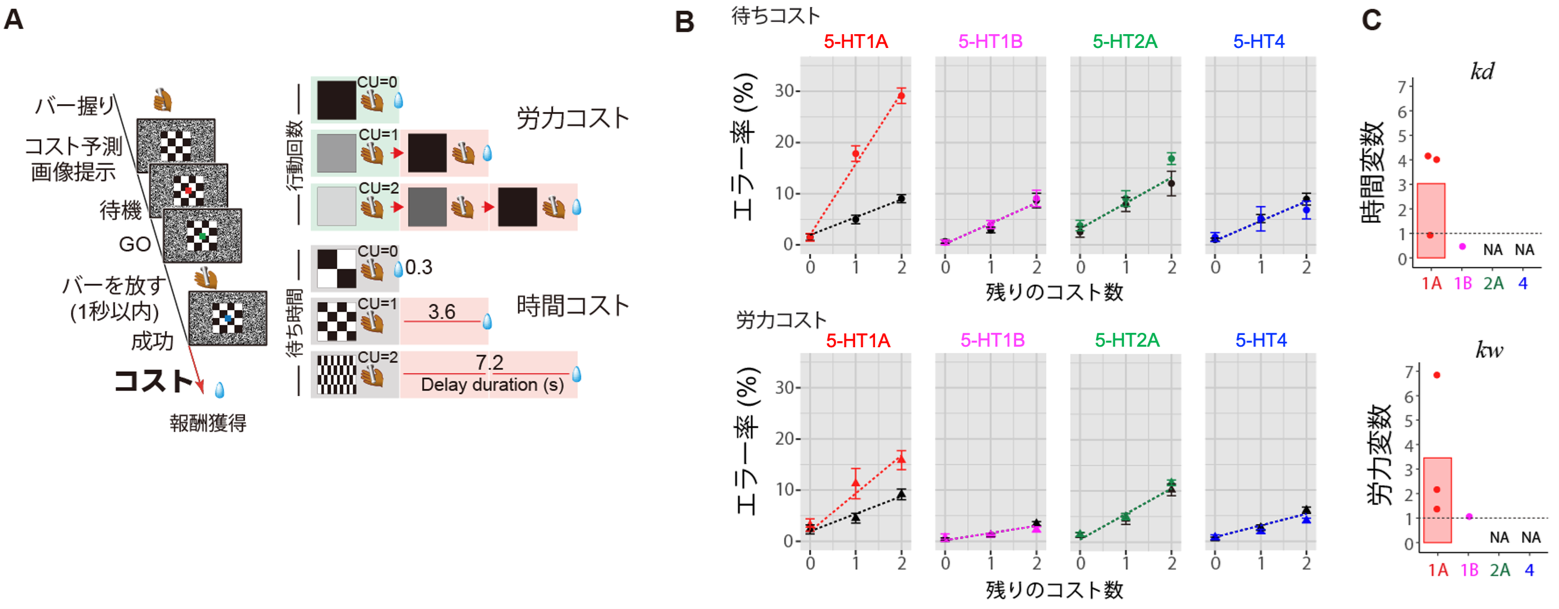
図5: 労働力・待ち時間のコストで判断されるやる気を評価する課題とセロトニン伝達阻害による意欲の変化
A:労力コストと時間コストによるバー放し行動課題。それぞれ1-3段階の残りのコスト数(CU)バー放しの回数と待ち時間で設定。
B:時間コスト試行、労力コスト試行におけるエラー率。黒は正常時のコントール、赤は5-HT1A受容体阻害剤、ピンクは5-HT1B受容体阻害剤、緑は5-HT2A受容体阻害剤、青は5-HT4受容体阻害剤を投与した時のデータ。
C:時間変数と労力変数の受容体間比較。NAは効果が検出されなかったことを示す。
以上の3つの実験結果より、セロトニンやセロトニン伝達の低下により生じる意欲低下の仕組みについて、次のことがわかりました。
- セロトニンやセロトニン伝達の低下によって生じる意欲低下には、報酬量の期待による報酬効果の減少と、予想されるコスト感の上昇の2つの異なる要因が関与している
- 報酬効果の減少の要因には5-HT1A、1B受容体の両者のセロトニン伝達の低下が関係している
- 予想されるコスト感上昇の要因には5-HT1Aを介したセロトニン伝達の低下が関係している
今後の展開
本研究で示したように、セロトニン受容体はサブタイプごとに存在する脳領域に違いがあり、今回セロトニン低下で顕著に引き起こされたコスト感の増大による意欲低下は5-HT1A受容体の密度が高い扁桃体や海馬、前頭前野の領域でのセロトニン伝達の異常を反映している可能性が考えられます。
本研究の成果は、ヒトと同じ霊長類モデル動物であるサルで得られた知見であることから、うつ病などの精神・神経疾患で見られるセロトニン伝達の変調で生じる意欲低下の病態の解明にむけ、重要な手がかりを示すことが期待されます。今後もさらに意欲調節とその障害の脳メカニズムの理解を深めることで、ヒトにおける診断・治療法の確立にむけた臨床応用研究にも大きく貢献することが期待されます。
用語解説
1)セロトニン
脳内の伝達物質の一つ。セロトニン神経細胞が軸索と呼ばれる長い突起を大脳皮質や辺縁系を含む多くの領域に伸ばし、末端から放出されたセロトニンがセロトニン受容体に結合することで神経活動を調節する。5-ヒドロキシトリプタミン(5-hydroxytriptamine: 5-HT)とも呼ばれる。
2)セロトニン受容体
セロトニンにより活性化されて情報伝達を行う。セロトニン受容体は10種類以上のサブタイプを持つ。本研究では、5-HT1A、5-HT1B、5-HT2A、5-HT4の4種類の受容体に着目した。セロトニン神経細胞が豊富に情報を送っている脳領域は、受容体サブタイプごとに異なっている(図3)。
3)PET
陽電子断層撮影法(Positron Emission Tomography)の略称。ポジトロン核種(11C、13N、15O、18F等)で標識したPET薬剤を体内に投与し、特定の体の部位に集積したり体内物質に結合したりするPET薬剤から放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量を測定して画像化する方法。
4)セロトニン受容体阻害剤
特定のサブタイプの受容体に選択的に結合し、セロトニンの作用を阻害して情報伝達を遮断する薬。
出典
1.QSTプレスリリース「「ご褒美がもらえる」と「大変だけど頑張ろう」の2つの『やる気』システムを解明
〜うつ病の仕組みとその改善法を知る上で重要な手がかり〜」2021.7.1
https://www.qst.go.jp/site/press/20210702.html
論文について
雑誌名:PloS Biology
DOI: https://doi.org/10.1371/journal.pbio.3002445
タイトル:Reduced serotonergic transmission alters sensitivity to cost and reward via 5-HT1A and 5-HT1B receptors in monkeys (セロトニン伝達の減少が5-HT1Aおよび5-HT1B受容体を介してコストと報酬に対する感受性を変化させる)
著者: Yukiko Hori1, Koki Mimura1, Yuji Nagai1, Yuki Hori1, Katsushi Kumata2, Ming-Rong Zhang2, Tetsuya Suhara1, Makoto Higuchi1, and Takafumi Minamimoto1*
所属:
- Department of Functional Brain Imaging, National Institutes for Quantum and Radiological Science and Technology
- Department of Advanced Nuclear Medicine Sciences, National Institutes for Quantum Science and Technology, Chiba, 263-8555, Japan.
*Corresponding author