2024-01-27 理化学研究所
理化学研究所(理研)脳神経科学研究センター 分子精神病理研究チームの中村 匠 研究員、上田 順子 テクニカルスタッフⅠ、水野 翔太 特別研究員、髙田 篤 チームリーダーらの研究チームは、世界最大規模の自閉スペクトラム症(ASD)家系全ゲノムシーケンス[1]データを用いて、患者本人からは検出されるがその両親からは検出されない、新生の変異である「デノボ変異[2]」を包括的に解析しました。その結果、遺伝子の上流でその発現を制御する「プロモーター領域」のデノボ変異が、ゲノムの三次元構造(TAD)[3]内の相互作用変化による遺伝子発現異常を引き起こし、疾患リスクに寄与することを明らかにしました。
本研究成果はASDの病態理解を進め、病態に基づく診断・治療法開発の基礎的知見になると期待されます。
今回、研究チームは、ASD患者のゲノム全領域を対象としたデノボ変異研究としては世界最多の5,044家系のデータを解析しました。その結果、プロモーター領域デノボ変異のうち、変異を含むTAD内にASDの関連遺伝子が存在するとASDリスクが上昇する一方、それ以外のプロモーター領域デノボ変異は疾患リスクとの統計的関連を示さないことを明らかにしました。さらに、ヒトiPS細胞への変異導入実験により、この種のプロモーター領域デノボ変異が、近傍のASD関連遺伝子の発現異常を引き起こすだけでなく、細胞全体で他のASD関連遺伝子や神経発達関連遺伝子の発現変動を誘発するという、「バタフライエフェクト」のような現象を起こしていることが分かりました。
本研究は、科学雑誌『Cell Genomics』オンライン版(1月26日付:日本時間1月27日)に掲載されました。
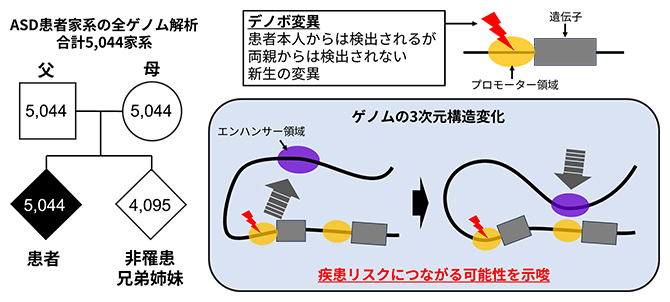
ASD患者5,044家系の全ゲノム解析により、新たな遺伝的リスク機構を解明
背景
自閉スペクトラム症(ASD)は、社会的コミュニケーションの問題と、限局された行動・興味・活動を主な症状とする神経発達障害の一群です。最近のアメリカでの疫学調査では、およそ2%の子どもがASDと診断されると報告されています注1)。ASDは遺伝的要因が強く関与する疾患であり、大多数の患者では多様な遺伝子変異が複雑に組み合わさることで発症に至ると考えられています。
遺伝子変異の中でも、患者本人からは検出されるが両親からは検出されない新生の変異(デノボ変異)は、進化の過程において自然選択をほとんど受けないため、発症に大きく関連する変異が含まれると考えられています。
これまでの患者のデノボ変異研究では、タンパク質をコードする領域だけでなく、遺伝子の発現を制御する領域(プロモーター領域)におけるデノボ変異がASD患者で多く見られることが示されていました。しかし、その変異が発症に関与する具体的なメカニズムは明らかになっていませんでした。
注1)アメリカ疾病予防管理センター(2023)”A Snapshot of Autism Spectrum Disorder in 2020″
研究手法と成果
研究チームは、既報の1,902家系に加え、Simons Powering Autism Research(SPARK)[4]で公開されている3,142家系の全ゲノムデータを用いてデノボ変異を解析し、プロモーター領域デノボ変異が疾患リスクに寄与するメカニズムの解明に挑みました。3,142家系のデノボ変異解析を実施したところ、これまでの研究結果と同様、ASD患者と罹患していない兄弟姉妹とではデノボ変異の発生頻度に全体として相違がありませんでした。
プロモーターは、エンハンサー[5]と近接して互いに作用することによって、プロモーター直下の遺伝子の発現を制御することが知られています(図1上)。そのため、プロモーター領域デノボ変異は、直下流の遺伝子発現に影響を与える可能性が高く、ASDと関連する遺伝子の上流に位置するプロモーター領域デノボ変異がASDリスクと特に強く関連することが推測されます。
そこで、ASDと関連する可能性のある遺伝子が登録されたデータベースSFARI gene[6]から、特に関連性が強いと考えられている遺伝子をASD関連遺伝子として選択し、それらの上流に位置するプロモーター領域のデノボ変異がASDリスクと統計的に有意[7]な関連を示すかどうかを、オッズ比[8]により評価しました。しかし予想に反して、ASD関連遺伝子群の上流プロモーター領域のデノボ変異は、リスクとの有意な関連を示しませんでした(図1下)。この結果は、プロモーター領域デノボ変異とASDリスクの関連は、直下流の遺伝子発現への影響だけでは説明されないことを示しており、異なるメカニズムの関与が考えられました。
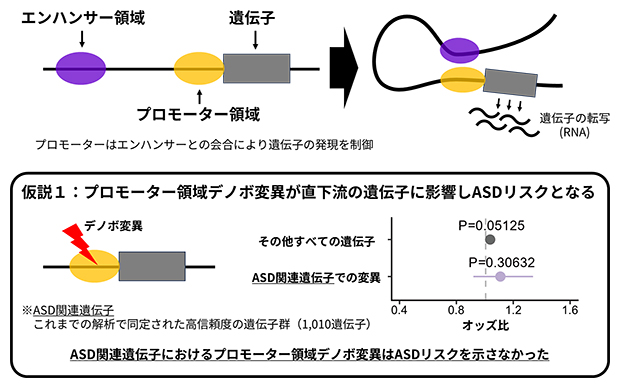
図1 プロモーター領域デノボ変異の直下流遺伝子におけるASDリスク評価
上:プロモーターは遺伝子の直上流に位置し、遠く離れたエンハンサーと会合することで機能する。
下:プロモーター領域デノボ変異のすぐ下流の遺伝子に着目した解析ではASDリスクは示されなかった。
そこで研究チームは、近年報告された新たな遺伝子制御機構である「エンハンサーリリースアンドリターゲティング(ERR)」に着目しました(図2上)。ERRとは、プロモーターが破壊されたとき、近接していたエンハンサーがそのプロモーターを離れるだけでなく、他のプロモーターを再標的とする現象です。これにより同じゲノムの三次元構造(TAD)に属する他の遺伝子の発現活性化が生じます。この機構を考慮すると、プロモーター領域デノボ変異は直下流の遺伝子だけではなく、同じTAD内の別の遺伝子の発現にも影響を与える可能性が考えられます。
この考えに基づき研究チームは、ヒト背外側前頭前皮質[9]におけるTAD区分を用いて、プロモーター領域デノボ変異を、変異が存在するTAD内にASD関連遺伝子を含むか否かで分類し、これらの変異が示すオッズ比を解析しました。その結果、ASD関連遺伝子を含むTADに存在するプロモーター領域デノボ変異が疾患リスクと有意に関連し、それ以外のプロモーター領域デノボ変異は有意な関連を示さないことが明らかになりました(図2下)。
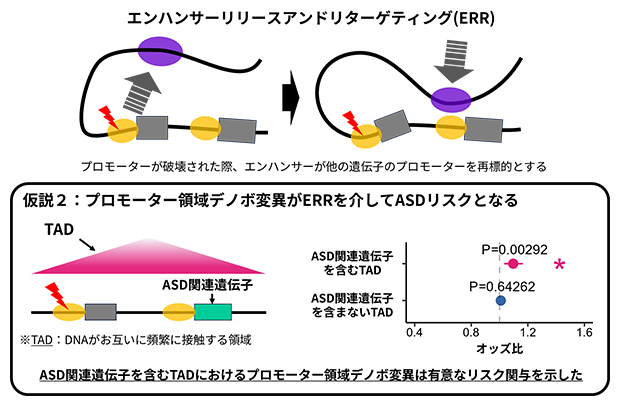
図2 プロモーター領域デノボ変異のTADを考慮したASDリスク評価
上:ERRの概念図。元のプロモーターと乖離(かいり)したエンハンサーは他のプロモーターと会合することで異常な遺伝子発現を誘導する。
下:TAD情報を組み合わせた解析により、ASD関連遺伝子を含むTADにおけるプロモーター領域デノボ変異が有意なASDリスクを示すことが明らかになった。
次に、ASDと特に関連するTADの有無を探索するべく、ASD患者特異的にプロモーター領域デノボ変異が集積するTADを解析しました。その結果、多重検定の補正[10]を行わない基準で有意な154カ所のTADと、多重検定の補正後も有意な二つのTADが同定されました(図3上)。同定した計156カ所のTADについて、それらのプロモーター領域にASDリスクと関与するありふれた一塩基多型(SNP)[11](集団頻度1%以上の変異)が集積しているかどうかを、既報のゲノムワイド関連解析(GWAS)[12]のデータを用いて統計的に評価しました。その結果、156カ所のTADでは有意なASD関連SNPの集積を認める一方、その他のTADではこのような集積は認められませんでした(図3下)。この結果は、特定のTADにおけるプロモーター領域が、デノボ変異とSNPの双方でASDリスクにおいて重要であることを示しており、遺伝学的には性質の異なるSNPとデノボ変異が、この領域で統合的に疾患リスクに寄与している可能性が示唆されます。
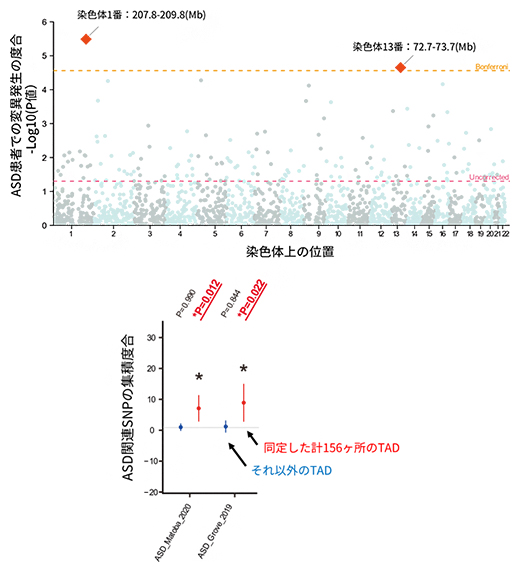
図3 ASD患者特異的に変異が集中するTADのゲノムワイドな解析
上:ASD患者と罹患していない兄弟姉妹における各TADのプロモーター領域デノボ変異の発生数を比較し、多重検定の補正を行わない基準で有意な154カ所のTAD(ピンク破線より上)と、多重検定の補正後も有意な二つのTAD(オレンジ破線より上)が同定された。
下:計156カ所のTADのプロモーター領域には、ASD関連SNPが有意に集積していた。
最後に、ASD患者から同定されたプロモーター領域デノボ変異が、TAD内の遺伝子発現に実際に影響するかを調べるため、ヒトiPS細胞[13]を用いた変異導入実験を行いました。CRISPR/Cas9システム[14]による導入が可能な、染色体7番におけるプロモーター領域デノボ変異を導入し、RNA-seq[15]により遺伝子発現を解析しました。
その結果、プロモーター領域デノボ変異の直下流の二つの遺伝子(HNRNPA2B1およびCBX3)が有意に発現上昇し、同一TAD内のASD関連遺伝子NFE2L3が有意に発現低下しました(図4左)。さらに、TAD内の遺伝子だけでなく、TAD外の多数の遺伝子の発現にも変動が引き起こされ、それらの中にはASD関連遺伝子や神経発達に関わる遺伝子が有意に多いことが示されました(図4右)。
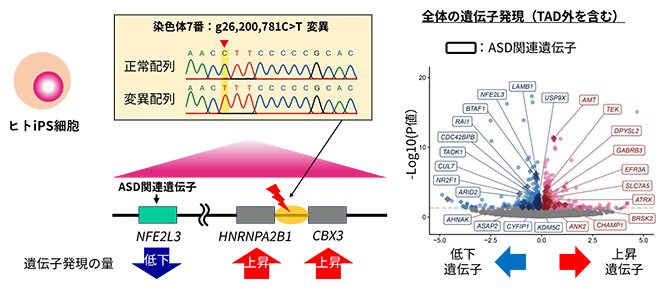
図4 ヒトiPS細胞へのプロモーター領域デノボ変異導入による遺伝子発現の変化
左:ヒトiPS細胞へ染色体7番g26200781C>T変異を導入した。TAD内において、変異のあるプロモーターの直下流の遺伝子(HNRNPA2B1およびCBX3)が有意に発現上昇し、同一TAD内だが遠くの位置に存在するASD関連遺伝子(NFE2L3)が発現低下した。
右:細胞全体で多数の遺伝子が有意に発現変化し(グレー破線より上)、それらには多数のASD関連遺伝子が含まれていた(枠線で示す遺伝子)。
今後の期待
今回の研究の成果をまとめると、(1)デノボ変異によりプロモーターが傷害されるとエンハンサーとの結合が変化する (2)その結果、同じTAD内の、変異とは離れた位置にあるASD関連遺伝子の発現が変化する (3)同じTAD内のASD関連遺伝子の発現変化の下流にあるゲノム中のさまざまな場所の多数のASD関連遺伝子の発現も変動する (4)その結果ASDリスクが上昇する、という、ゲノムの「バタフライエフェクト」とも表現できるような一連の現象が存在することが示されました。
さらに、iPS細胞への変異導入実験から、たった1塩基の変異が近傍遺伝子の発現変化のみならず、多数のASD関連遺伝子群の発現変動を誘発し得ることが示され、これらの変異を標的とした効率的な遺伝的治療法の発展につながることが期待されます。
今回の研究は、ASDのデノボ変異研究としては、世界最大規模の5,044家系の解析を行いました。より確実で深い知見を得るためには、さらに多くの家系や患者のゲノム解析を行う必要があります。そのような研究を推進し、ゲノム解析の知見を病態理解につなげ、病態理解から新たな診断・治療・予防法の開発へと展開することが期待されます。
補足説明
1.全ゲノムシーケンス
次世代シーケンサーと高機能コンピュータを使って、個人の全てのゲノム情報(約30億塩基)を解析し、それぞれの配列の違いや変化を同定するゲノム解析技術。全ゲノムシーケンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、プロモーターを含むすべての領域の変異を解析することができる。
2.デノボ変異
“de novo”は、「新たに」という意味のラテン語。子供は両親から半分ずつゲノム配列を受け継ぐが、DNA複製時のエラーなどが原因となって、子のゲノムに親が持たない新たな変異が生じる場合がある。これを「デノボ変異」という。通常、有害な変異は世代を経ることで淘汰されるが、デノボ変異は自然選択をほとんど受けないため、疾患の発生において重要な変異が多く含まれていると考えられている。
3.ゲノムの三次元構造(TAD)
ゲノム上で近くの配列同士が物理的に相互作用し合っている領域。TAD内の高頻度な相互作用は遺伝子発現などの制御機構に関与する。TADはtopologically associated domainの略。
4.Simons Foundation Powering Autism Research(SPARK)
Simons Foundation Autism Research Initiative(SFARI)が運営する、ASD研究の推進を目的とする団体。米国の30以上の主要な医学部やASD研究センターが参画し、患者とその家族に関連した臨床情報、DNAサンプルおよびデータを提供する。詳細はSPARKのウェブページ(英語)![]() を参照。
を参照。
5.エンハンサー
主に遺伝子の上流や下流に位置し、遺伝子の転写量を増加させるDNA配列の一つ。
6.SFARI gene
ASD感受性を示す遺伝子のデータベース。各遺伝子は疾患との関連性を裏付ける研究結果を基に評価され、確からしい関連性が示唆される遺伝子にはスコアが付与される。
7.統計的に有意
統計的解析において、観察された影響をその確実性について評価し、偶然によって生ずる確率が低い場合には統計的に有意とされる。
8.オッズ比
ある事象の起こりやすさについて二つの群で比較したときの違いを示す統計学的尺度の一つ。
9.背外側前頭前皮質
大脳皮質のうち、前頭部に位置する前頭前野の背外側に当たる領域で、高次認知機能に関与する。
10.多重検定の補正
一度に複数の統計的仮説検定を行った際には、統計的に有意とされる所見が偶然観察される可能性が上昇するため、それに対して補正を加えること。今回の研究ではBonferroni法による補正を行った。
11.ありふれた一塩基多型(SNP)
ゲノム配列中で見られる個人間での一塩基の違い(SNP)のうち、集団内で1%以上の頻度で認められる遺伝子多型の一つ。SNPはsingle nucleotide polymorphismの略。
12.ゲノムワイド関連解析(GWAS)
ゲノム中の数十万から数百万のSNPを網羅的に調べ上げ、疾患の有無や、身長・体重などの形質と関連するゲノム領域を同定する研究手法。GWASはgenome-wide association studyの略。
13.iPS細胞
皮膚や血液などから採取した細胞に特定の遺伝子などを導入することで得られる、多様な細胞に分化できる分化多能性と自己複製能を獲得した細胞。
14.CRISPR/Cas9システム
ゲノム編集技術の一つ。標的ゲノム領域を認識する配列を含むガイドRNAと、DNA切断酵素のCas9タンパク質から構成され、ゲノム中の任意の領域を切断できる。細胞がゲノムを修復する際、ゲノムの欠失、挿入が起こるほか、相同組換えによって切断部位に外来遺伝子配列をノックインできる。
15.RNA-seq
組織や細胞で発現している全RNAを解析する手法。次世代シーケンサーによりRNAの配列断片情報を網羅的に取得し、遺伝子発現量の定量を行う。
研究チーム
理化学研究所 脳神経科学研究センター 分子精神病理研究チーム
チームリーダー 髙田 篤(タカタ・アツシ)
研究員 中村 匠(ナカムラ・タクミ)
特別研究員 水野 翔太(ミズノ・ショウタ)
テクニカルスタッフⅠ 上田 順子(ウエダ・ジュンコ)
テクニカルスタッフⅠ 本田 久楽々(ホンダ・クララ)
テクニカルスタッフⅠ 数野 安亜(カズノ・アンア)
客員研究員 原 伯徳(ハラ・トモノリ)
大学院リサーチ・アソシエイト(研究当時)山本 明那(ヤマモト・ヒロナ)
研究支援
本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム「トリオサンプルのシーケンス解析による、遺伝子型によって定義される双極性障害の一群の同定(研究代表者:髙田篤)」、同ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究開発:GRIFIN)「オリゴジェニックモデルに基づくヒト疾患の遺伝的構造の解析(研究代表者:髙田篤)」、同戦略的国際脳科学研究推進プログラム「双極性障害に対する体細胞変異の意義の解明と神経ゲノム病理学的手法の開発(研究代表者:西岡将基)」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(B)「クラスタ/ハブ細胞を決定する遺伝子・鍵分子経路の特定およびヒト疾患との関連解析(研究代表者:髙田篤)」、同基盤研究(B)「双極性障害大規模シーケンス解析による稀な生殖細胞系列変異と体細胞変異の包括的研究(研究代表者:髙田篤)」、同若手研究「エピジェネティック制御機能を有するメチル基転移酵素に着目した自閉症病態の解明(研究代表者:中村匠)」、同研究活動スタート支援「大規模家系ゲノムデータ解析によるDenovo遺伝子変異の父年齢効果関連遺伝子座の同定(研究代表者:水野翔太)」による助成を受けて行われました。
原論文情報
Takumi Nakamura*, Junko Ueda*, Shota Mizuno*, Kurara Honda, An-a Kazuno, Hirona Yamamoto, Tomonori Hara, and Atsushi Takata *These authors contributed equally to this work, “Topologically associating domains define the impact of de novo promoter variants on autism spectrum disorder risk”, Cell Genomics, 10.1016/j.xgen.2024.100488
発表者
理化学研究所
脳神経科学研究センター 分子精神病理研究チーム
チームリーダー 髙田 篤(タカタ・アツシ)
研究員 中村 匠(ナカムラ・タクミ)
テクニカルスタッフⅠ 上田 順子(ウエダ・ジュンコ)
特別研究員 水野 翔太(ミズノ・ショウタ)
報道担当
理化学研究所 広報室 報道担当