2024-03-13 国立がん研究センター
発表のポイント
- 国内81施設による前向き観察試験に参加された再発・難治性多発性骨髄腫患者さん261名の臨床検体を用いた遺伝子解析を実施しました。
- 骨髄の形質細胞と循環腫瘍DNAにおける遺伝子変異頻度を明らかにし、それぞれの解析において認めやすい変異を明らかにしました。さらに、両者の予後予測能を比較することで、TP53変異やKRAS変異などの循環腫瘍DNA変異は無増悪生存率の予測能が優れていることを示しました。
- 循環腫瘍DNAの変異数と血漿DNA濃度、前治療レジメン数を組み込んだ効率的な予後予測モデル(ctRRMM-PI)を開発しました。
- 循環腫瘍DNAの変異プロファイリングは、再発・難治性多発性骨髄腫患者さんに最適な治療を選択するための基盤となる可能性を示しました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野 博行) 分子腫瘍学分野 木暮 泰寛 研究員、同 片岡 圭亮 分野長(慶應義塾大学医学部内科学(血液) 教授)らの研究グループは、再発・難治性多発性骨髄腫における遺伝子異常の全体像や予後へ与える影響を探索するために、国内81施設が参加した『再発又は難治性の多発性骨髄腫患者を対象としたイキサゾミブとレナリドミド及びデキサメタゾン併用療法の多施設共同前向き観察研究』に参加された261名の患者から採取した骨髄液および循環腫瘍DNAを解析し、遺伝子異常と治療効果との関連を検討しました。その結果、骨髄の形質細胞と循環腫瘍DNAにおける変異プロファイルが異なること、特に循環腫瘍DNAにおいてTP53変異の頻度が高いことを明らかにしました。さらに、両者の予後予測能を比較することで、TP53変異やKRAS変異などの循環腫瘍DNA変異は無増悪生存率の予測能が優れていることを示しました。さらに、循環腫瘍DNAの変異数(TP53、KRAS、DIS3、BRAF、ATM、NRASの6遺伝子が対象)と血漿DNA濃度、前治療レジメン数を組み込んだ効率的な再発・難治性多発性骨髄腫患者の予後予測モデル(ctRRMM-PI)を開発しました。これらの結果は、循環腫瘍DNA変異の遺伝学的な特徴のみならず、その臨床的な有用性を示しています。今後の研究により、再発・難治性多発性骨髄腫患者さんに最適な治療を選択するための新たな指針となることが期待されます。
本研究結果は2024年3月1日(米国東部標準時)に米科学誌「Blood」に掲載されました。
背景
多発性骨髄腫(multiple myeloma, MM)は、感染や病気から体を守る血液細胞の一つである「形質細胞」ががん化することで起こるがんであり、日本においても毎年10万人あたり約6人が発症する血液がんです。近年、多くの新規治療法が開発されているにもかかわらず、いまだに難治性の疾患であり、精力的な研究が続けられています。同じ「多発性骨髄腫」と診断された腫瘍であっても、進行の早さ、治療の効きやすさ、患者さんの予後等に違いがあることが分かっています。具体的には、腫瘍における特定の遺伝子異常(IGH遺伝子座に関連した染色体の再構成や、染色体の高二倍化、1q増幅、17p欠失など)が影響していることが知られています。また、最先端の次世代シークエンシング技術を用いた研究からは、RAS経路(KRAS, NRAS, BRAF)、DNA修復経路(TP53, ATM)、NF-κB経路等の遺伝子変異注1を有する様々なMMの存在が明らかになってきました。その一方で、これらの個々の遺伝子の予後予測能は限定的であり、TP53を除くほとんどの遺伝子変異では患者予後との関連は証明されていませんでした。
また、多くのMM患者は、最終的に治療に対して抵抗性を示し、再発します。再発・難治性MM(relapsed/refractory MM, RRMM)の患者では、RAS経路遺伝子、TP53、CRBN遺伝子の変異がより高頻度に見られますが、これらの変異の全体像や、変異が予後に与える影響については、まだ十分に解明されていませんでした。
近年、MMにおけるリキッドバイオプシー注2の臨床応用が研究され、中でも循環腫瘍DNA(circulating tumor DNA, ctDNA注3)の解析が脚光を浴びています。ctDNA解析は、患者の血液から検体を得ることができるため、低侵襲であるという特徴を有します。また、MMでは患者の体内の異なる部位に異なる遺伝子変異を持つ複数のクローンが存在する可能性が知られています。これまでの多くの研究では、骨髄形質細胞(bone marrow plasma cell, BMPC)の解析注4に重点が置かれてきましたが、サンプリング部位が限局しているため、体内のすべての変異クローンを把握することは難しい場合がありました。一方、血液を検査するctDNA解析では、これらの異なるクローンから放出されたDNA断片を一挙に解析可能であり、体内に存在する全腫瘍細胞の状態を俯瞰することができるとされています。したがって、ctDNA解析はBMPCの検査だけでは得られない情報を提供し、MMの診断と治療戦略の決定に役立つ可能性が示唆されています。しかし、ctDNAの変異プロファイルが病気の重症度、治療応答、または再発のリスクをどのように反映しているかについては、これまで詳細に解明されていませんでした。また、BMPCとctDNAの比較研究も大規模には行われていませんでした。
研究方法・成果
検体収集
新規プロテアソーム阻害剤であるイキサゾミブとレナリドミド/デキサメタゾンの併用療法(IRd療法)は、高リスクの細胞遺伝学的異常を有する症例を含むRRMM患者において無増悪生存率(PFS)を延長させることが示されています。最近、日本での日常臨床におけるIRd療法の有効性と安全性を検討するために、国内81施設から295名のRRMM患者が参加した非介入・多施設・前向き観察試験である『再発又は難治性の多発性骨髄腫患者を対象としたイキサゾミブとレナリドミド及びデキサメタゾン併用療法の多施設共同前向き観察研究(C16042試験, https://clinicaltrials.gov/study/NCT03433001)』が施行され、実臨床に近い多様な患者集団の解析においてもIRd療法が有効かつ安全であることが示されました。
この試験に参加した患者のうち、同意を頂いた261名についてIRd療法開始時・終了時にBMPCとctDNAを採取し、遺伝子解析しました(図1)。
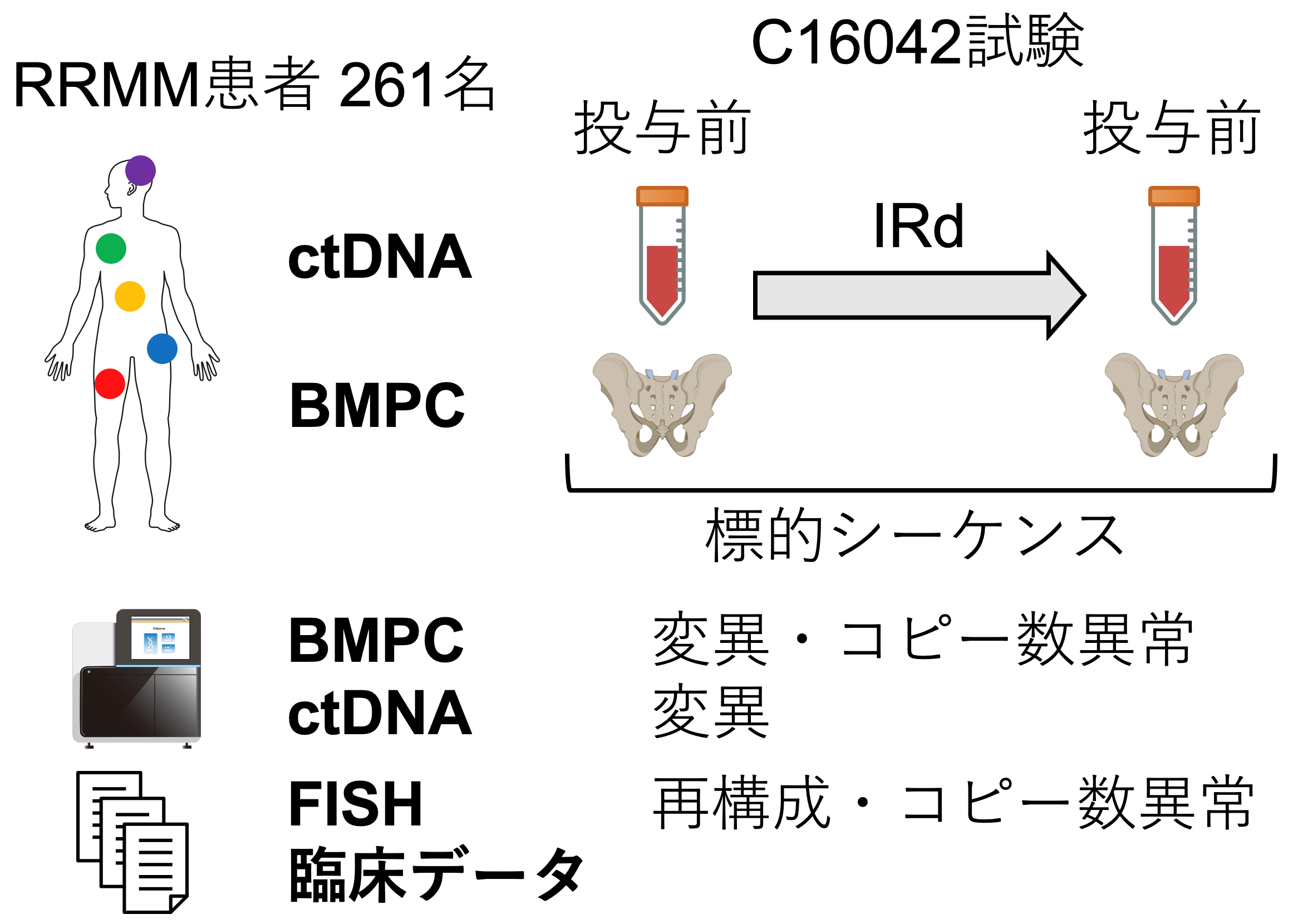
図1 本研究の全体像。
BMPC-seqおよびctDNA-seqによる遺伝子異常の全体像
BMPCおよびctDNAに対して標的シーケンス注5による遺伝子解析を実施しました。BMPC解析(BMPC-seq)では、1,192個の遺伝子変異が同定されました。また、3症例以上で変異を検出した遺伝子を24遺伝子認めました。その中でもKRASが最も頻度が高く(21.5%)、次いでNRAS(14.1%)、TP53(12.9%)、BRAF(8.0%)、DIS3(8.0%)の順で高頻度に変異を認めました(図2A)。
一方、ctDNA解析(ctDNA-seq)では、580個の遺伝子変異が同定されました。また3症例以上で変異を検出した遺伝子を47遺伝子認めました。ctDNA-seqでは、特にクローン性造血注6に関連する遺伝子変異が含まれ、DNMT3A(22.0%)、TET2(15.8%)、PPM1D(5.8%)、ASXL1(3.9%)などが高頻度に変異していました。さらに、MMのドライバー遺伝子注7としてはTP53が最も多く(21.6%)、次いでKRAS(10.0%)、BRAF(5.4%)、ATM(5.0%)、NRAS(5.0%)、DIS3(4.6%)などの遺伝子に変異を認めました(図2B)。
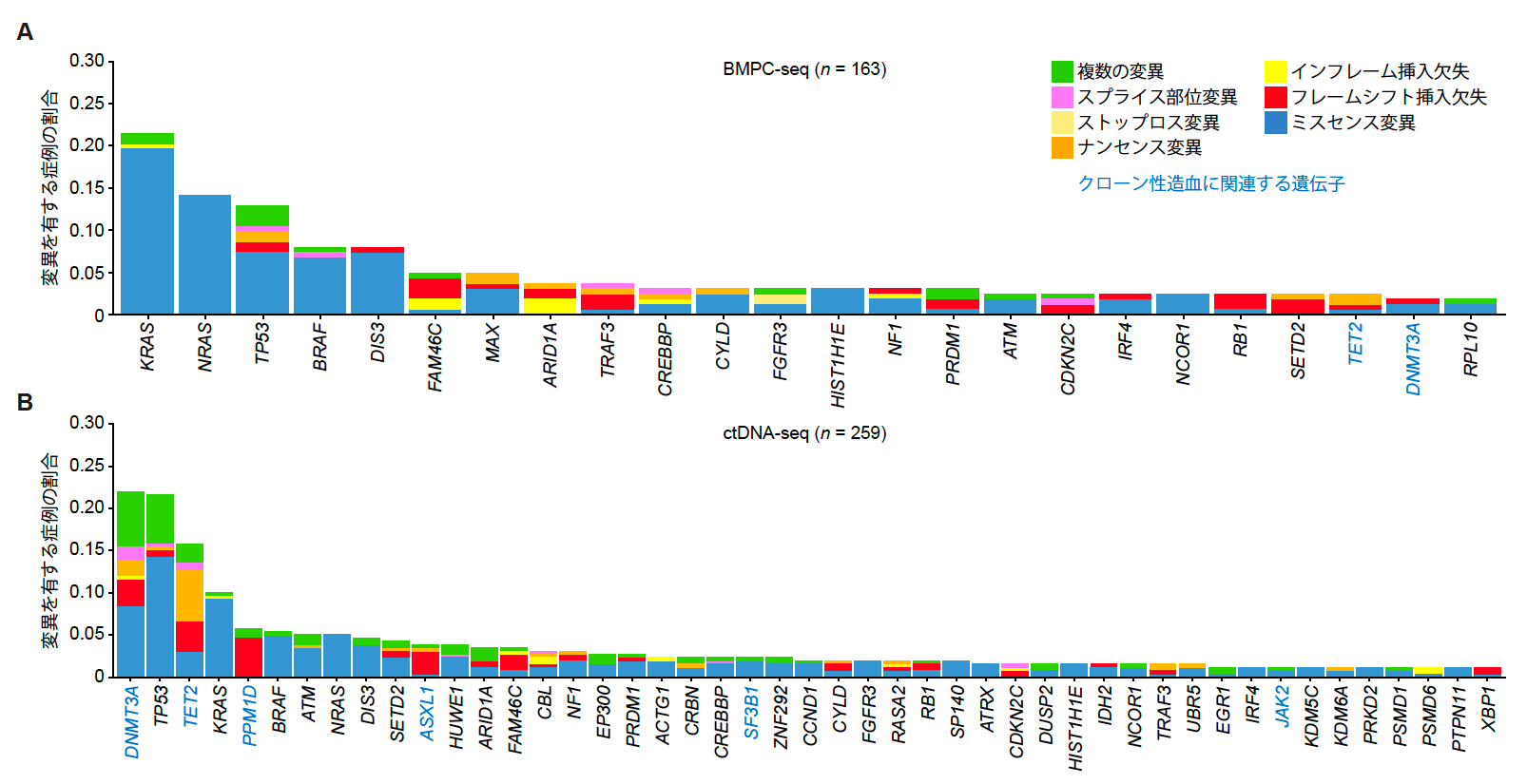
図2 3症例以上で変異を認めたRRMMのドライバー遺伝子の一覧。BMPC-seq (A) では24遺伝子、ctDNA-seq (B) では47遺伝子を同定した。
BMPCとctDNAで同定される変異の特徴
BMPC-seqとctDNA-seqの結果を比較すると、一部の遺伝子で異なるパターンを認めました(図3A)。特に、クローン性造血と関連するDNMT3A, TET2, PPM1D, ASXL1, SF3B1, EP300の変異の70%以上はctDNA-seqによってのみ検出されました。また、TP53変異を有する症例のうち59.2%もの患者ではctDNA-seqのみで変異を認めました。一方で、KRASやNRASの遺伝子変異などでは、全ての変異がBMPC-seqで認められ、その一部がBMPC-seq とctDNA-seqの両方で検出されました。平均すると、BMPCで同定された変異の60.6%がctDNA-seqでも同定されました。加えて、ctDNA-seqでは、TP53やDNMT3Aにおいて、複数の変異を認める症例が多く認められました(図3B)。
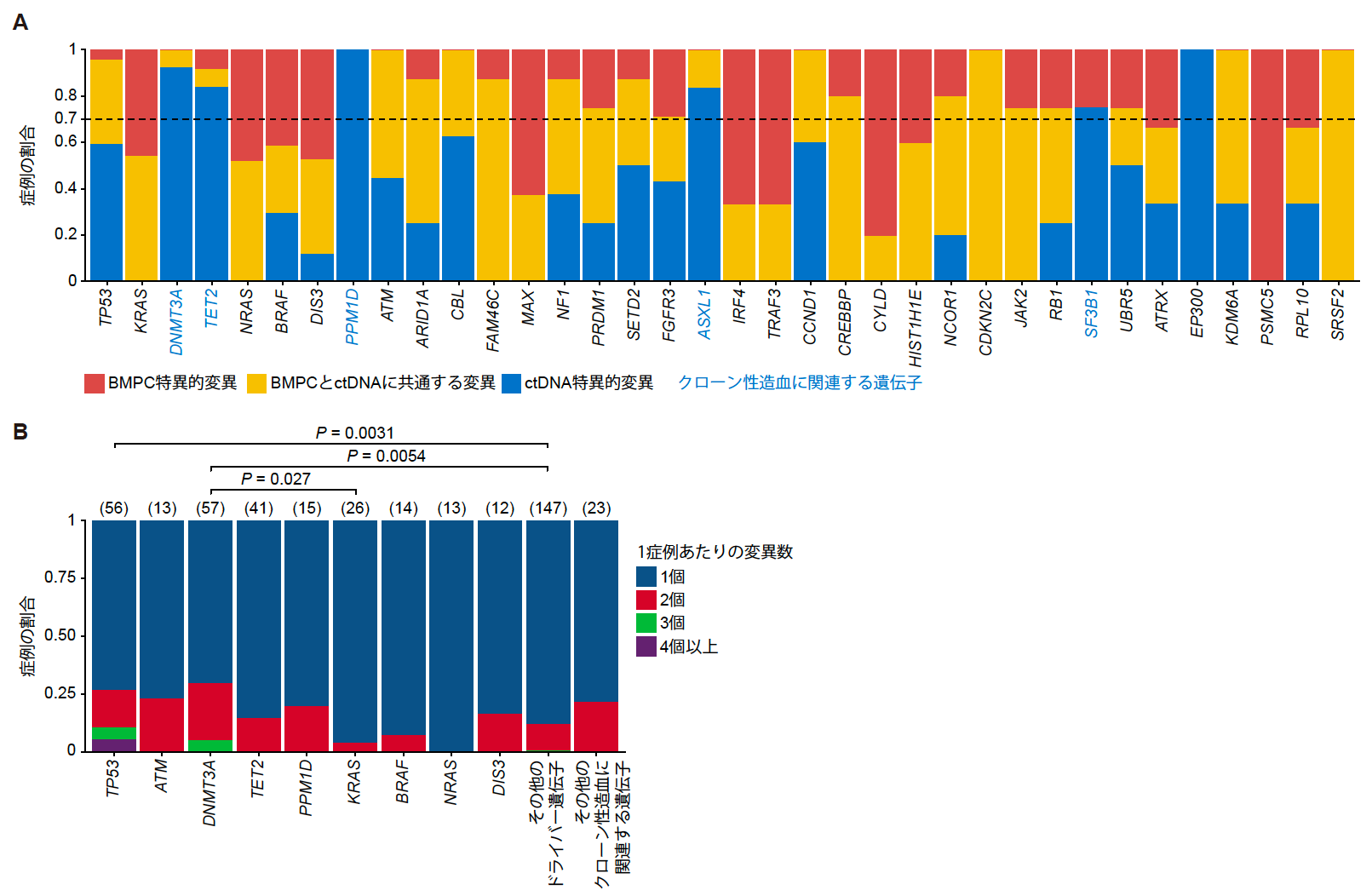
図3 (A) BMPCに特異的な変異変異を有する症例、ctDNAに特異的な変異を有する症例、およびBMPCとctDNAに共通して認める変異を有する症例の割合。(B) ctDNA-seqで同定された症例あたりの遺伝子変異の個数の分布。
ctDNA変異はBMPC変異より強力な予後予測能を持つ
次に、BMPC-seqおよびctDNA-seqで同定された遺伝子異常が予後に及ぼす影響を検討しました。まず、BMPC-seqでは、TP53およびKRAS変異がPFSの低下と有意に関連していることが示されました。これは、未治療MMにおいてKRAS変異が予後に影響を与えないことと対照的な結果でした。また、17p欠失もPFSに対する不良因子であることが示されました。
一方、ctDNA-seqによる分析では、TP53、KRAS、DIS3、BRAF、ATM、NRASの6遺伝子はPFSの低下と有意に関連しました(図4)。中でもKRAS変異はBMPC-seq(ハザード比2.4)よりもctDNA-seq(ハザード比4.0)で検出した場合に予後への影響が著しく高いことが示されました。
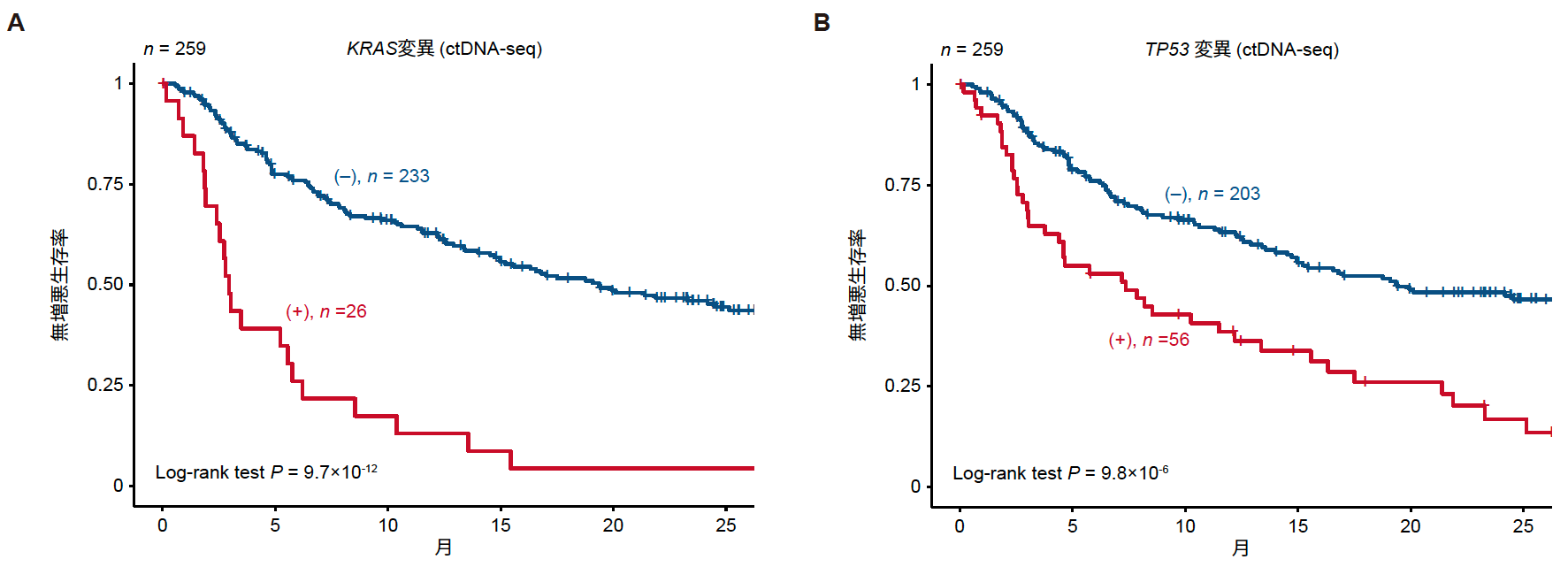
図4 ctDNA-seqで同定されたKRAS変異(A)、TP53変異(B)の有無によるPFS。
さらに、161症例のRRMM症例におけるBMPC-seqとctDNA-seqデータを詳細に比較検討しました。注目すべきことに、KRAS変異のない症例(両方陰性)と比べて、BMPCとctDNAの両方でKRAS変異がある症例では生存率が著しく低下していました。しかし、BMPCのみにKRAS変異を持つ症例は、変異がない症例と同様の生存率を示しており、ctDNAにおけるKRAS変異検出の重要性が示されました。一方で、TP53変異については、変異がない症例(両方陰性)と比較して、BMPCとctDNAの両方に異常がある症例でPFSが低下していました。さらに、BMPCまたはctDNAのいずれかのみでTP53異常が検出された場合でもPFSが低下していました。この結果は、ctDNA-seqがRRMMにおける患者予後に関連するTP53のサブクローン変異を検出する能力を持つことを示しています。
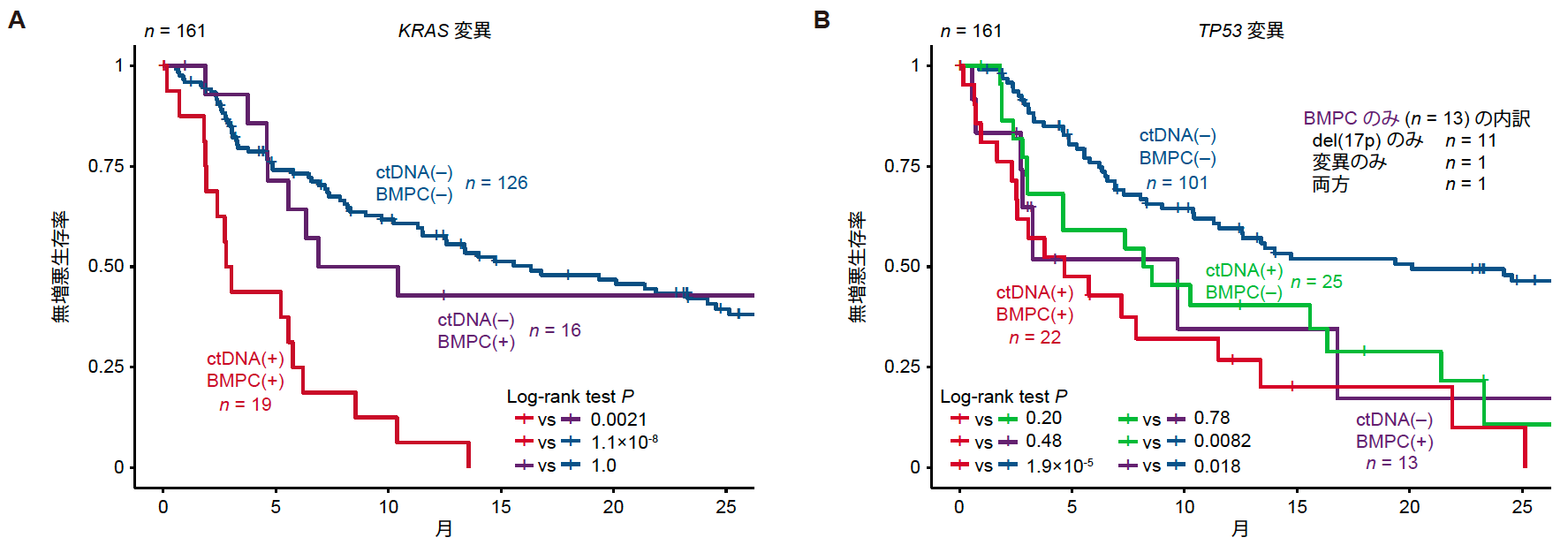
図5 BMPC-seqとctDNA-seqによってBMPCのみ、ctDNAのみ、その両方にKRAS変異 (A)、TP53変異 (B) が同定された患者のPFS。
最後に、予後に関連するこれら6遺伝子のctDNA変異の総数が患者の予後に及ぼす影響を評価しました。症例のうち162症例(62.5%)で変異なし、64症例(24.7%)で1遺伝子に変異あり、33症例(12.7%)で2遺伝子以上に変異が見られました。ctDNA変異のない症例の2年PFS率は57.3%であり、1遺伝子に変異がある症例では22.7%、2遺伝子以上の変異がある症例では0%でした。このように、ctDNA-seqによって臨床的に有用な遺伝子変異を検出可能であることが示されました。
ctDNA変異を用いた予後予測モデルの作成
以上の知見に基づき、Cox比例ハザードモデルを使用して、遺伝子異常と臨床情報を組み入れた多変量解析を行いました。その結果、(1)単変量解析で有意であった6つの遺伝子のうち3遺伝子(KRAS、TP53、ATM)の変異、(2)t(11;14)再構成(IGH遺伝子座に関連した染色体の再構成)、(3)前治療レジメン数の増加、(4)高い血漿DNA濃度がPFSの低下と独立して関連していることを明らかにしました。特に、KRASのctDNA変異は最も強い予測因子であることが判明しました。また、個別の遺伝子の代わりに、(1)予後に関連する6遺伝子の変異総数(2個以上または1個)用いた解析でも、変異総数と他の臨床因子がともに予後不良因子であることが示されました。
次に、BMPCの体細胞異常(すなわち、17p欠失とFISH検査の情報)を含まない多変量解析を行いました。このモデルでも、(1)予後に関連する6遺伝子うちの変異総数(2個以上または1個)、(2)前治療レジメン数の増加、(3)高い血漿DNA濃度がPFSの低下と独立して関連することが明らかになりました。さらに、これらの変数の相対リスクに基づいて、ctDNA情報と臨床情報を用いた新しい予後予測モデル注8であるctRRMM-PIを開発しました(図6)。ctRRMM-PIはRRMM患者を3つのリスクカテゴリー(2年PFS率:57.9%、28.6%、0%)に分類することが可能でした。これらの結果は、RRMMの予後予測において、ctDNA変異が非常に重要な役割を果たすことを示しています。
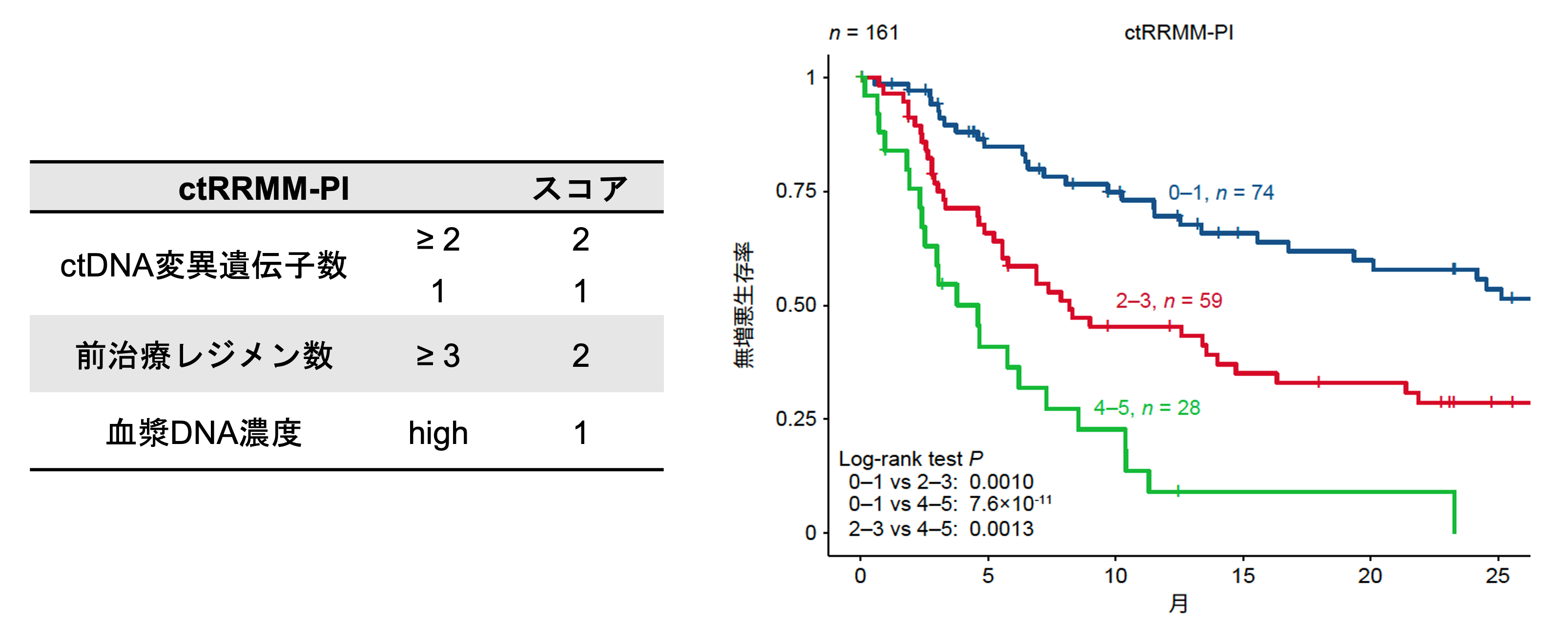
図6 ctRRMM-PIのスコア(左)と、それに基づくRRMM患者のPFSの層別化(右)。
IRd療法前後におけるBMPCとctDNAのクローン構造の変化
さらに、IRd療法終了時に得られた、25名の患者からのBMPCと、94名からのctDNA検体を用いて標的シーケンスを実施しました。IRd療法前後のBMPCとctDNAの変異アレル頻度注9を比較することにより、同一症例内でのクローンの変化を検討しました。治療後に新たに出現した変異は43症例で観察され、一方で41症例では変異が消失しました。新たに出現した変異の中で最も多かったのはTP53で、次に多いのはKRAS変異でした(図7)。対照的に、クローン性造血に関連する遺伝子(DNMT3AやTET2)やTP53の変異が治療後に消失する場合が多く見られました。これらの結果は、RRMMにおいてTP53およびKRAS変異が予後不良因子であることと一致すると考えられました。
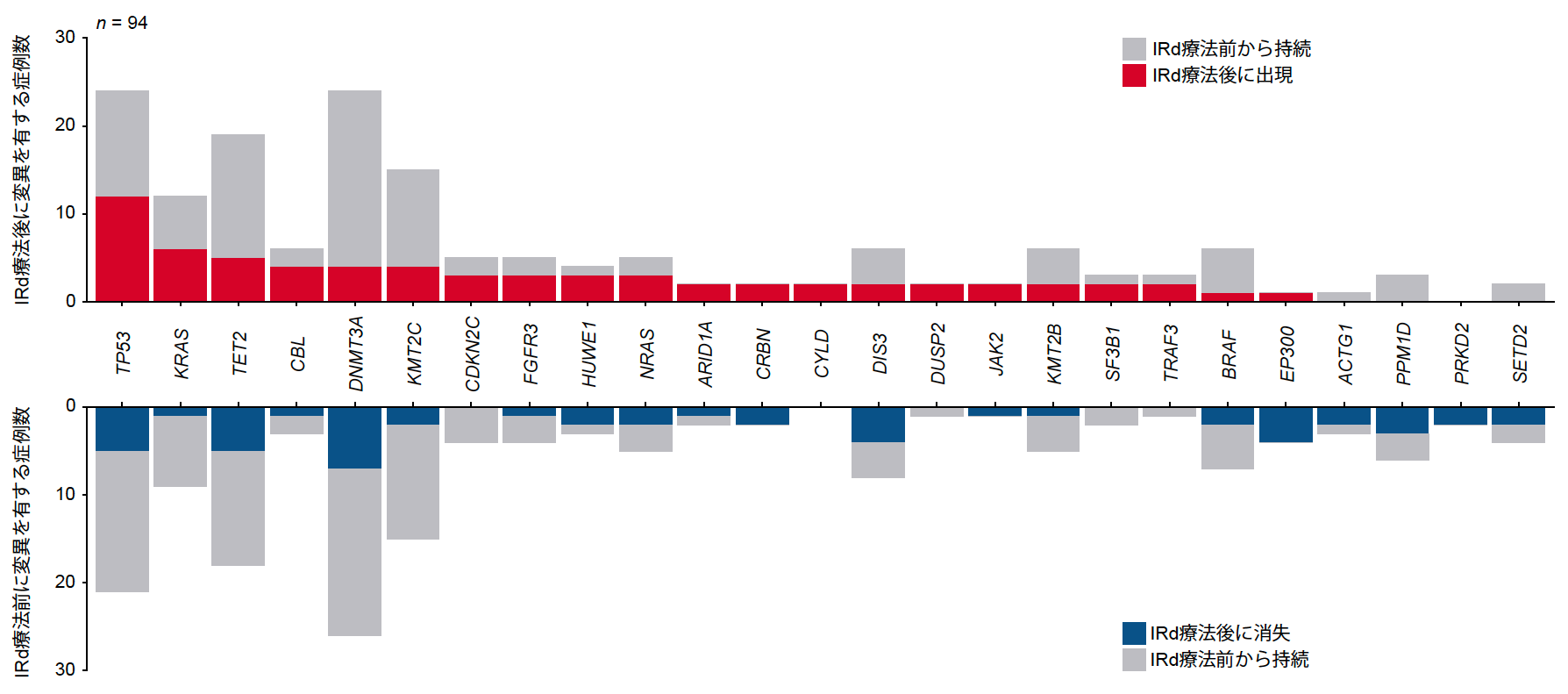
図7 ctDNAにおいて、IRd治療前後で出現または消失した変異を有する症例数の分布。
展望
この研究では、RRMMにおけるctDNAの遺伝的特性を明らかにし、ctDNA変異の予後予測能力がBMPCの変異の予後予測能力を上回ることを示しました。また、この知見をもとに、ctDNA変異数・血漿DNA濃度・前治療レジメン数を組み入れた新しい予後予測モデルを開発しました。ctDNAに基づく分子プロファイリングが利用可能となれば、低リスクの患者(すなわち、IRd療法などの現行治療法で効果が期待できる)と、高リスクの患者(すなわち、臨床試験の候補として適している)をより正確に特定できるようになり、RRMM患者の治療戦略を大きく改善することが期待されます。
この研究はIRd療法を受けた再発・難治患者を対象としていたため、ctDNA変異の予後への影響が、抗CD38抗体を含む他の治療を受ける患者にも適用できるか、あるいは未治療の患者にも適用可能かどうか明らかにすることは今後の重要な課題であり、MMにおけるctDNA変異のさらなる検討が必要です。また、今回構築した予後予測モデルctRRMM-PIを臨床で実施するには、血漿DNAの定量方法や、ctDNA変異解析方法などの分析手法の最適化も必要です。
MM患者さんの治療選択肢を最適化し予後を改善していくために、私たちは今後もゲノム解析技術の革新を図り、得られた知見を臨床現場に応用できるよう努めてまいります。
謝辞
C16042試験に参加された患者さんとご家族の皆様、またご尽力頂いた医師・看護師・コーディネーターをはじめとする研究スタッフの皆様に、心から感謝申し上げます。
発表論文
雑誌名
Blood
タイトル
ctDNA improves prognostic prediction in relapsed/refractory MM receiving ixazomib, lenalidomide, and dexamethasone
著者
木暮 泰寛、半田 寛、伊藤 勇太、李 政樹、堀米 佑一、飯野 昌樹、原崎 頼子、小林 敬宏、安倍 正博、石田 禎夫、伊藤 薫樹、岩崎 浩己、黒田 純也、柴山 浩彦、角南 一貴、高松 博幸、田村 秀人、林 敏昭、赤木 究、篠崎 智大、吉田 孝寛、森 郁生、飯田 真介、前田 高宏、片岡 圭亮
掲載日
2024年3月1日
DOI
https://doi.org/10.1182/blood.2023022540
研究費
本研究は武田薬品工業株式会社主導臨床研究の一部として実施されました。
用語解説
注1 変異
DNAに生じる異常の一種で、1~十数塩基対程度の短い挿入・欠失や一塩基置換からなる。
注2 リキッドバイオプシー
血液や尿、涙、唾液、乳汁、脳脊髄液、胸水、腹水等の体液の検体中に含まれているがん細胞や、がん細胞由来の物質(ctDNAを含む)を解析する技術のこと。
注3 循環腫瘍DNA(ctDNA)
がん細胞由来のDNAで、細胞死などにより漏れ出して血液中を循環しているDNAのこと。採血によりがん細胞のDNAの異常を調べることができるため、様々ながんにおいて診断、遺伝子異常のプロファイリング、治療効果判定等に有用であることが示されつつある。
注4 BMPCの検査
多くの造血器腫瘍において実施される骨髄穿刺は、通常、患者の腰の骨(腸骨)からその中にある骨髄液を吸引する検査である。本研究においては、骨髄液から得られた細胞のうち、MMの発生起源である形質細胞を選択的に濃縮して解析に使用した。
注5 標的シーケンス
ヒトのDNAの全体(ゲノム)を解析するのではなく、重要な遺伝子や領域(ドライバー遺伝子注7など)に限定してDNA配列を解析する技術のこと。解析に用いる資源を集中できるため、標的領域において精度の高い解析が可能となる。
注6 クローン性造血
遺伝子変異を獲得した特定の造血細胞(クローン)によって、血液細胞の多くを産生するようになった状態のこと。一般的な血液検査の異常は認められないが、白血病をはじめとする造血器腫瘍や冠動脈疾患のリスク状態となることが知られている。65歳以上の高齢者では10%以上と高頻度にクローン性造血が認められる。
注7 ドライバー遺伝子
異常をきたすことで、がんの発生・進行などの直接的な原因となる遺伝子のこと。がん遺伝子とがん抑制遺伝子からなる。
注8 予後予測モデル
様々な因子(本研究においては、遺伝子変異の有無や患者の臨床情報)を組み合わせて、患者の経過や治療結果を予測するために用いられる。
注9 変異アレル頻度
その変異が全体の中でどれくらいの比率で存在するかを示したもの。具体的には特定の部分が解析された回数(配列情報の数)のうち変異がある割合であり、高い変異アレル頻度は、その変異が多く存在していることを意味する。
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター研究所
分子腫瘍学分野 木暮 泰寛
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室