オートファジーに必要なユニークな両親媒性αヘリックスの発見
2023-06-24 東京大学,科学技術振興機構
ポイント
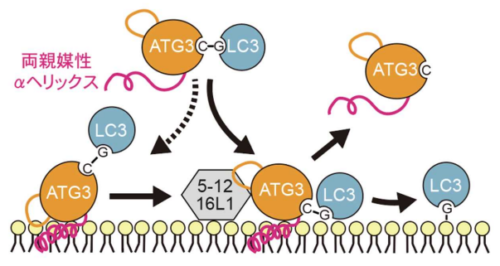
- オートファジー関連(ATG)分子が構成する細胞内高次構造体の1つであるATG3~LC3複合体が、オートファジー機能を発揮するために膜と相互作用する詳細な分子メカニズムは不明でした。
- ATG3の両親媒性αヘリックスはユニークな物理化学的な性質を持っており、単なる膜結合だけではなく、オートファジー誘導時に生じるLC3分子の脂質化反応に必要な膜上でのATG3~LC3複合体のダイナミックな動態制御に関わっていることを明らかにしました。
- 細胞内の動的高次構造体と膜が相互作用する複雑な分子メカニズムを解析するための新たな方法論を提示するものであり、他の分子の制御機構解明への貢献が期待されます。
東京大学 大学院医学系研究科の西村 多喜 特任講師と水島 昇 教授らの研究グループは、オートファジー関連(ATG)分子が構成する細胞内高次構造体の1つであるATG3~LC3複合体が膜と相互作用する詳細な分子メカニズムを明らかにしました。膜相互作用に関与する領域として両親媒性αヘリックスが知られていましたが、ATG3の両親媒性αヘリックスが一般的なものと比べてユニークな物理化学的な性質があることを、教師なし機械学習を用いた解析により見いだしました。また、全原子分子動力学シミュレーションや生細胞イメージング観察により、ATG3~LC3複合体が膜上でオートファジーにおける効率的なLC3分子の脂質化反応に必要なダイナミックな挙動を示す動的な高次構造体であることや、ATG3の両親媒性αヘリックスのユニークな性質がその動態制御に重要であることを明らかにしました。本研究成果は細胞内の動的高次構造体と膜が相互作用する複雑な分子メカニズムを解析するための新たな方法論を提示するものであり、他の分子の制御機構解明への貢献が期待されます。
なお、本研究成果は米国時間6月23日に学会誌「Science Advances」に掲載されます。
本研究は、科学技術振興機構(JST) さきがけ「動的なオルガネラコンタクトネットワーク制御機構の解明(JPMJPR20EC)」、学術変革領域B「ポストリソソームシグナルを駆動する脂質因子の解析(21H05146)」、JST-ERATO「水島細胞内分解ダイナミクスプロジェクト(JPMJER1702)」、特別推進研究「膜構造の分解を基軸とした細胞内分解の研究(22H04919)」、日本応用酵素協会研究助成の支援により実施されました。
<プレスリリース資料>
- 本文 PDF(568KB)
<論文タイトル>
- “Unique Amphipathic α-helix Drives Membrane Insertion and Enzymatic Activity of ATG3”
- DOI:10.1126/sciadv.adh1281
<お問い合わせ先>
<研究に関すること>
西村 多喜(ニシムラ タキ)
東京大学 大学院医学系研究科 特任講師
<JST事業に関すること>
保田 睦子(ヤスダ ムツコ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
東京大学 医学部医学系研究科 総務チーム
科学技術振興機構 広報課


