2024-05-10 理化学研究所
理化学研究所(理研)バイオリソース研究センター 遺伝工学基盤技術室の的場 章悟 専任研究員、小倉 淳郎 室長らの共同研究グループは、化合物を胚の培養液に加えるだけで体細胞クローンマウスの作出効率を大幅に改善する手法を開発しました。
本研究成果は、バイオリソースとして貴重なマウス系統の保存・復元や新規疾患モデルマウスの作製などに貢献すると期待できます。
今回、共同研究グループは、理研環境資源科学研究センターのケミカルゲノミクス研究グループで2023年に開発された新規ヒストンメチル化[1]酵素阻害剤RK-701でクローン胚を処理したところ、クローンマウスの作出効率を約5倍まで上昇させることに成功しました。さらに、既に効果があることが知られている別の化合物(ヒストン脱アセチル化酵素阻害剤)と併用することで、クローンマウスの作出効率は約20倍まで上昇しました。これまで開発されてきた他の手法と比べて、今回開発した手法は非侵襲的で非常に簡単なため、今後、マウスだけでなく幅広い動物のクローン技術への応用が期待されます。
本研究は、科学雑誌『Stem Cell Reports』オンライン版(5月9日付:日本時間5月10日)に掲載されます。
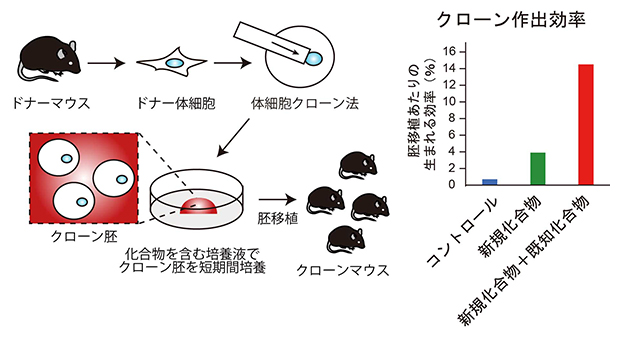
化合物処理による簡便なクローン作出効率改善法とその効果
背景
核移植クローン技術は、1個の体細胞から遺伝的コピー動物を作出することが可能です。現在まで、畜産や再生医療[2]、疾患モデル動物の作製など多くの領域でクローン技術の応用が進んでいます。ただし、どの動物種においてもクローン胚移植当たりの生まれる効率(作出効率)が非常に低いことが大きな欠点でした。
これまでさまざまなグループが、クローン動物の作出効率が低い原因の解析を進めてきました。中でも、共同研究グループでは、クローンマウスの胚発生異常と遺伝子発現およびエピゲノム[3]の関連性を長く研究してきました注1)。その中で、胚発生のごく初期にクローン胚で発現が抑制されている遺伝子群があり、それはドナーの体細胞から引き継がれたヒストンメチル化修飾、特にヒストンH3タンパク質の9番目リジンのトリメチル化(H3K9me3[4])が原因であることを発見しました注2)。H3K9me3をターゲットとするヒストン脱メチル化酵素のKdm4dのmRNAをクローン胚で人為的に発現させることでH3K9me3を取り除くことができ、その結果クローンマウスの作出効率を10倍近く改善することに成功しています。ただし、このアプローチは、mRNAを個々のクローン胚に物理的に注入する必要があるため、侵襲性が高く、一気に処理できないという問題がありました。また、クローン胚でH3K9me3を減らす非侵襲的なアプローチとしては、H3K9me3を導入するヒストンメチル化酵素であるSuv39h1/2に対する阻害剤が考えられますが、現時点でSuv39h1/2に対する特異性が高く効果的な阻害剤は存在しないため、他のアプローチを検討する必要がありました。
注1)2018年7月20日プレスリリース「クローン胚の新たなエピゲノム異常を発見」
注2)Matoba S, Liu Y, Lu F, Iwabuchi KA, Shen L, Inoue A, Zhang Y.”Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation.” Cell. 2014 Nov 6;159(4):884-95.
研究手法と成果
これまで他のグループの研究から、一般に細胞内でのヒストンH3K9のメチル化の導入はH3K9me1からH3K9me2、H3K9me3へと段階的に起こることが示唆されています注3)。そこで、Kdm3aという脱メチル化酵素のmRNAを胚発生開始直後の1細胞期のクローン胚に注入してH3K9me3の前段階と考えられるH3K9me1およびH3K9me2の修飾を消去する実験を行いました。その結果、H3K9me1とH3K9me2はKdm3a mRNAの注入から数時間後には完全に消失しましたが、H3K9me3は残っていました。ところが、それからさらに1日ほど経って卵割をして2細胞期に到達した胚を観察すると、H3K9me1/2だけでなく、H3K9me3も二次的に消失することが分かりました(図1)。すなわち、H3K9me1/2の産生自体を阻害すれば、H3K9me3も低下することが分かりました。
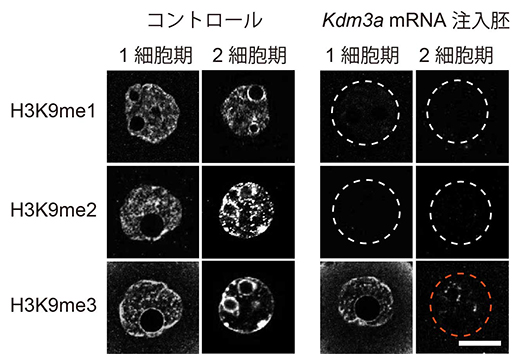
図1 ヒストン脱メチル化酵素Kdm3aによるクローン胚のH3K9メチル化への影響
Kdm3aはH3K9me1とH3K9me2を消去することができる酵素である。これをクローン胚に注入したところ、1細胞期では予想通りH3K9me1/2のみが消去されたが、2細胞期を見ると、二次的にH3K9me3も消失していた(赤点線丸)。スケールバーは、5μm。
次に、H3K9me1/2を減少させることを目的として、ヒストンのメチル化酵素、特にH3K9me1/2を導入する酵素であるG9aに着目しました(図2)。G9aに対する非常に特異性の高い阻害剤であるRK-701をクローン胚の培養液に添加したところ、予想通りH3K9me1/2だけでなくH3K9me3も低下しました。この培養液に既知のクローンマウスの作出効率を改善する効果があるヒストン脱アセチル化酵素(HDAC)の阻害剤(トリコスタチンA:TSA)を加えると、それぞれの阻害剤が相乗的に効果を発揮して、H3K9me3レベルはさらに低下しました。RK-701は理研の環境資源科学研究センターのケミカルゲノミクス研究グループで2023年に開発されたものです注4)。
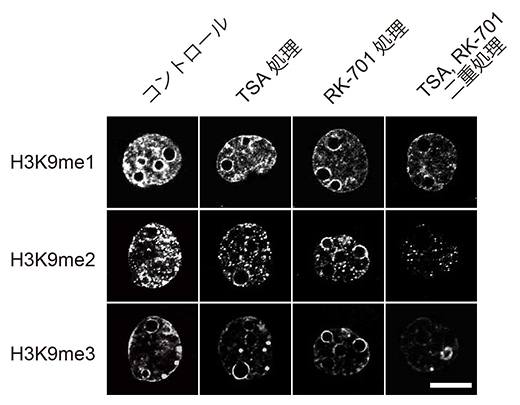
図2 二つの阻害剤の単独・同時処理による2細胞期のクローン胚のH3K9メチル化への影響
ヒストン脱メチル化酵素G9aの阻害剤であるRK-701とヒストン脱アセチル化酵素阻害剤(TSA)はそれぞれ単独処理でH3K9me1/2/3を減少させたが、同時に処理をするとH3K9me3はさらに低下した。スケールバーは、5μm。
次にこのG9aに対する阻害剤であるRK-701処理の影響を遺伝子発現と胚発生について解析しました(図3)。遺伝子発現をRNAシークエンシング法[5]によって解析したところ、H3K9me3によって抑制されている遺伝子の発現がRK-701処理によって改善しており、その結果クローンマウスの作出効率も3.9%とコントロールの0.7%と比べて5倍程度まで高まりました。さらにRK-701をTSAと組み合わせると、クローンマウスの作出効率は14.5%と約20倍まで向上しました。こうして生まれたクローンマウスは出生後も発育して交配によって子孫を残したことから個体として正常であるといえます。
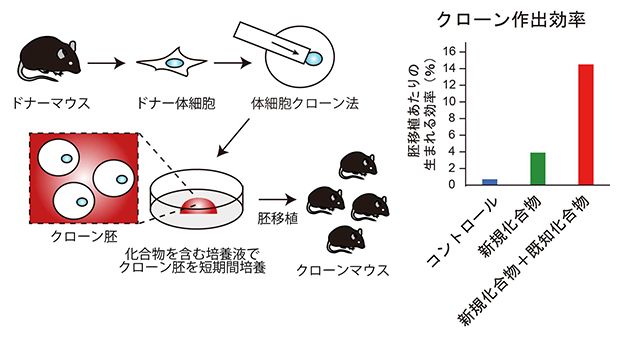
図3 二つの阻害剤の同時処理によるクローンマウスの出生への影響
ヒストン脱メチル化酵素G9aの阻害剤であるRK-701とヒストン脱アセチル化酵素阻害剤(TSA)を同時に処理(二重処理)するとクローンマウスの作出効率は20倍以上に改善した。
注3)Pinheiro I, Margueron R, Shukeir N, Eisold M, Fritzsch C, Richter FM, Mittler G, Genoud C, Goyama S, Kurokawa M, Son J, Reinberg D, Lachner M, Jenuwein T. “Prdm3 and Prdm16 are H3K9me1 methyltransferases required for mammalian heterochromatin integrity.” Cell. 2012 Aug 31;150(5):948-60.
注4)2023年1月12日プレスリリース「鎌状赤血球症の新しい治療薬候補を開発」
今後の期待
今回開発したアプローチは、阻害剤を培養液に添加するだけという簡便な手法です。大量のサンプルを同時に処理できることから、今後のマウスクローン研究のスタンダードの手法となる可能性があります。また、ヒストンメチル化のH3K9me3を取り除くKdm4d法は霊長類など他の動物でも有効であることが示されているため、G9a阻害剤による今回のアプローチも、より広範な動物種で効果がみられる可能性があります。
補足説明
1.ヒストンメチル化
ヒストンはH1、H2A、H2B、H3、H4の5種類から成り、DNAを巻き付かせて核内に高密度にパッキングさせる役割を担っている。ヒストンのN末端のリジン残基やアルギニン残基に生じるメチル化は、遺伝子発現制御やクロマチンの高次構造の形成に関わっていると考えられている。
2.再生医療
機能障害や機能不全に陥った生体組織・臓器に対して、細胞や人工的な材料を積極的に利用して、損なわれた機能の再生を図ること。最近、ブタの臓器をヒトへ移植するという報告がされているが、そこで移植用臓器のドナーとして使われているブタは免疫原性や内在性ウィルスなどの移植リスクに関わる遺伝子を数十個変異させた個体である。このような個体は全て、細胞レベルで変異を導入した上で体細胞クローンによって作製されている。
3.エピゲノム
細胞の核内にあるゲノムDNAはヒストンというタンパク質に巻き付いてパッケージングされている。これらのゲノムDNA自体や周囲のヒストンタンパクにはメチル化やアセチル化などの化学修飾が付いていて、その情報に従って、その領域の遺伝子が発現するか否かが制御されている。こういったゲノムDNAやヒストンへの化学修飾の総体をエピゲノムという。
4.H3K9me3
ヒストンH3タンパク質の9番目のリジン(アミノ酸の一つ)がトリメチル化(3個のメチル基が修飾)されたものをH3K9me3という。H3K9me3は遺伝子発現が抑制されたゲノム領域に多い化学修飾として知られている。
5.RNAシークエンシング法
サンプルの中に含まれる全てのRNAの配列を次世代シークエンサーで配列決定することで、遺伝子発現を網羅的に調べる方法。
共同研究グループ
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(マトバ・ショウゴ)
(JST創発研究者)
特別研究員(研究当時)四方 大樹(シカタ・ダイキ)
大学院生リサーチ・アソシエイト 建部 貴輝(タテベ・タカキ)
テクニカルスタッフⅡ 廣瀬 美智子(ヒロセ・ミチコ)
大学院生リサーチ・アソシエイト(研究当時)渡邉 奈緒美(ワタナベ・ナオミ)
テクニカルスタッフⅡ 長谷川 歩未(ハセガワ・アユミ)
室長 小倉 淳郎(オグラ・アツオ)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員、筑波大学大学院 生命環境科学研究科 教授)
環境資源科学研究センター
創薬化学基盤ユニット
上級研究員 白井 文幸(シライ・フミユキ)
創薬シード化合物探索基盤ユニット
テクニカルスタッフⅡ 中田 明子(ナカタ・アキコ)
ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(ヨシダ・ミノル)
(理事、開拓研究本部 本部長、東京大学特別教授)
東京薬科大学 生命科学部 細胞情報科学研究室
教授 伊藤 昭博(イトウ・アキヒロ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「マウス核移植技術の開発による正常クローン胚・胎盤の構築(研究代表者:小倉淳郎)」、同基盤研究(B)「胎盤アミノ酸輸送系の破綻が引き起こす胎児代謝プログラム異常の解明(研究代表者:的場章悟)」、日本医療研究開発機構(AMED)革新的技術による脳機能ネットワークの全容解明プロジェクト「マーモセット体細胞クローン個体作出技術に関する研究開発(研究代表者:的場章悟)」、科学技術振興機構(JST)創発的研究支援事業「胎盤による胚発生の保護メカニズムとその破綻(研究代表者:的場章悟)」による助成を受けて行われました。
原論文情報
Shogo Matoba, Daiki Shikata, Fumiyuki Shirai, Takaki Tatebe, Michiko Hirose, Akiko Nakata, Naomi Watanabe, Ayumi Hasegawa, Akihiro Ito, Minoru Yoshida and Atsuo Ogura, “Reduction of H3K9 methylation by G9a inhibitors improves the development of mouse SCNT embryos”, Stem Cell Reports, 10.1016/j.stemcr.2024.04.003
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(マトバ・ショウゴ)
室長 小倉 淳郎(オグラ・アツオ)
報道担当
理化学研究所 広報室 報道担当