2024-05-27 大阪大学
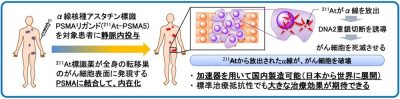
図1. アスタチン標識PSMAリガンド(211At-PSMA5)を用いた標的アルファ線治療
研究成果のポイント
- 医理核連携研究により、前立腺特異的膜抗原(PSMA)※1を標的とした革新的な放射性治療薬を開発し、臨床試験に進めることに成功
- 標準治療抵抗性の前立腺がん患者を対象とした医師主導治験を間もなく開始
- 静脈内投与で体内からアルファ線※2を照射することで、全身の転移巣に対する治療が可能
概要
大阪大学 大学院医学系研究科の渡部直史 講師、富山憲幸 教授(放射線医学)、波多野 浩士 講師、野々村祝夫 教授(泌尿器科学)らの研究チームは、大阪大学医学部附属病院において、標準治療抵抗性の前立腺がんを対象とした新たな医師主導治験を2024年6月より開始します(図1)。大阪大学大学院医学系研究科では同核物理研究センターおよび理化学研究所からα線放出核種のアスタチン(At-211) ※3の供給を受け、大阪大学放射線科学基盤機構のチームと連携し、前立腺特異的膜抗原(PSMA : Prostate Specific Membrane Antigen)を標的とした新たなアルファ線治療薬([At-211]PSMA-5)の標識製造に成功し、既に動物モデルでの有効性を報告しました(プレスリリース参照:2022/11/14『難治性前立腺がんをアルファ線で攻撃』)。
現在、前立腺がんは世界的に増加傾向にあり、国内男性で新規罹患数の最も多いがんとなっており、2019年に国内で前立腺がんと診断されたのは94,748人でした(国立がん研究センターがん情報サービス)。前立腺がんには様々な治療が実施されますが、標準治療抵抗性で多発転移を伴う場合、非常に予後不良です。
今回、国立研究開発法人日本医療研究開発機構(AMED)の橋渡し支援研究プログラム(シーズF)※4において、治験開始までに必要な非臨床試験を全て完了させ、大阪大学医学部附属病院 核医学診療科内の短寿命放射性薬剤製造施設において治験薬GMP基準※5で安定的に治験薬を製造できることを確認しました(担当:同病院薬剤部 仲定宏 薬剤師)。また同病院 未来医療開発部によるプロジェクト支援により、本年4月に治験審査委員会の承認が得られ、医薬品医療機器総合機構(PMDA) ※6に治験計画届を提出しました。これから被験者のエントリーを開始し、2024年6月開始の医師主導治験において、本治療薬の安全性・有効性を検証してまいります。
研究の背景
近年、狙った標的に結合する化合物に、標識する核種を変えることで、がんの診断から治療まで一貫して実施するセラノスティクス(Theranostics)※7が注目を集めています。前立腺特異的膜抗原(PSMA)はPETを用いた画像診断※8から核医学治療まで展開可能なセラノスティクスの革新的な標的として注目されています。
研究チームはこれまで独デュッセルドルフ大学(Frederik Giesel教授ら)との共同研究を行い、PSMAを標的としたPET画像診断の臨床研究を実施してきました(図2)。また海外ではβ線核種※9のルテチウム(Lu-177)を用いたPSMA治療が既に承認されていますが、Lu-177は国内製造ができないことや、Lu-177治療抵抗性の患者がいることがわかっています。アスタチンは従来の放射線よりもエネルギーの高いα線を放出する核種であり、β線治療抵抗性であっても治療効果が期待できるだけでなく、加速器を用いた国内製造が可能です。理化学研究所では、重イオン加速器施設「RIビームファクトリー」の加速器を用いて、本研究に必要とされるアスタチン原料を大量製造する技術開発を行い、大阪大学への安定供給を実現しました。
大阪大学医学部附属病院では既にアスタチン化ナトリウムを用いた難治性甲状腺がんに対する医師主導治験※10が実施されています。今回、国内で患者数が多く、アンメットニーズが強い難治性前立腺がんに対して、アスタチン標識薬([At-211]PSMA-5)を用いた2つ目の医師主導治験を開始する運びとなりました。
本治験(Alpha-PS1試験)の概要
本医師主導治験は、標準治療の実施・継続が困難である去勢抵抗性前立腺がん患者を対象として、アスタチン標識薬([At-211]PSMA-5)を投与した後の忍容性、安全性、薬物動態及び有効性を確認するための第Ⅰ相治験になります。今回、本治療薬は世界で初めてヒトに投与され、抗がん剤の治験として低用量から開始して、徐々に用量を増量していく用量漸増デザインとなっています。
【試験名】去勢抵抗性前立腺癌患者を対象とした新規α線核医学治療の第Ⅰ相医師主導治験
・対象:標準治療の実施・継続が困難である去勢抵抗性前立腺癌の患者
・治験薬:PSW-1025(化合物名:[211At]PSMA-5)
・実施期間:2024年6月〜2027年3月(予定)
・予定症例数:15 例
・治験責任医師:渡部直史(阪大病院 核医学診療科)
・治験分担医師:
(核医学診療科)礒橋佳也子、松永恵子、片山大輔、渡邊美玲、加藤弘樹、
(放射線診断・IVR科)富山憲幸、(放射線部)巽光朗、
(泌尿器科)野々村祝夫、福原慎一郎、河嶋厚成、角田洋一、波多野浩士、加藤大悟、竹澤健太郎、山本致之、林拓自、中澤成晃、上田倫央、石津谷祐。

図2. PSMAを標的とした臨床研究PET画像:多発リンパ節転移(赤矢印)を伴うホルモン療法抵抗性前立腺がんの存在を確認
本研究が社会に与える影響(本研究成果の意義)
多発転移を伴う去勢抵抗性前立腺がんの患者さんには化学療法等が実施されますが、副作用が少なくなく、早期に治療抵抗性となってしまうこともあります。一方、核医学治療では重篤な副作用を認めることは稀であり、かつ飛程の短いアルファ線を用いた治療では専用の病室への入院が不要です。アスタチンは加速器を用いた国内製造が可能であり、製造拠点を整備することで、多くの患者さんに外来治療として実施できることが見込まれます。将来的には日本発の治療方法として、世界中の前立腺がんの患者さんに用いられることが期待されます。
研究者のコメント
<渡部 直史 講師(治験責任医師)>
先行するアスタチンを用いた難治性甲状腺がんに対する医師主導治験を実施する中で、本治験の準備を進めてきました。今回の治験においては反復投与が予定されていることから、多くの新たなハードルがありましたが、数多くの関係者の尽力により、無事に2剤目の医師主導治験開始を迎えることができました。また同時に本治験は開始前から多くの患者さんより問い合わせを頂いており、標準治療抵抗性前立腺がんにおけるアンメットニーズを実感しています。本治験において、アスタチン創薬の実用化に向けて、アスタチン標識PSMA標的薬の安全性と有効性を明らかにしていきたいと思います。
用語説明
※1 前立腺特異的膜抗原(PSMA)
前立腺がんの細胞表面に発現している膜タンパク。多くの前立腺がんで発現が認められ、去勢抵抗性の進行前立腺がんでは特に強い発現が認められる。PSMAは Prostate Specific Membrane Antigenの略称。
※2 アルファ線
近年、短い飛程でエネルギー(治療効果)の高い放射線として、治療利用が進みつつある。アルファ線を出す薬剤をがん病巣に選択的に集めることで、周囲の組織には影響を与えることなく、がんの治療が可能となる。
※3 アスタチン(At-211)
元素記号:At。211Atはアルファ線(α線)を放出する放射性同位元素であり、サイクロトロンと呼ばれる加速器を用いて金属のビスマスにアルファビームを照射することで製造される(物理的半減期 7.2時間)。アスタチンは低分子化合物やペプチドに標識可能であり、様々ながんを標的とすることが可能である。
※4 国立研究開発法人 日本医療研究開発機構(AMED) 橋渡し支援研究(シーズF)
大学発の有望な研究シーズを実用化担当企業への橋渡しを目的として、AMEDが実施する「橋渡し支援研究プログラム」の中で、治験開始ならびに実用化を目指す研究課題を支援する産学協働事業。AMEDはJapan Agency for Medical Research and Developmentの略称。
※5 治験薬GMP基準
治験薬を製造する際に遵守すべき適切な製造管理および品質管理の方法や必要な構造設備を定めた基準。GMPはGood Manufacturing Practiceの略称。
※6 医薬品医療機器総合機構(PMDA)
医薬品の品質、有効性および安全性について、治験開始前の相談から承認までを一貫した体制で指導・審査する独立行政法人。PMDAはPharmaceuticals and Medical Devices Agencyの略称。
※7 セラノスティクス(Theranostics)
治療(Therapeutics)と診断(Diagnostics)を一体化した新しい医療技術を指す。
※8 PETをもちいた画像診断
PET(Positron Emission Tomography)検査は陽電子放出断層撮影法と呼ばれ、がんの病期診断や再発診断に用いられる。
※9 β線核種
原子核から電子(β線)を放出する核種を指す。代表的なβ線治療として、放射性ヨウ素(I-131)を用いた甲状腺がんや悪性褐色細胞種の治療、ルテチウム(Lu-177)標識薬のルタテラを用いた神経内分泌腫瘍治療が保険診療で実施されている。
※10 アスタチン化ナトリウムを用いた難治性甲状腺がんに対する医師主導治験
甲状腺がんがアスタチンを取り込む性質を利用して大阪大学医学部附属病院で実施されている第Ⅰ相医師主導治験のことを指す。国内で最初に開始されたアスタチンの治験である。
特記事項
本治験薬の製造にあたっては、大阪大学 核物理研究センター(中野貴志教授、福田光宏教授)、および理化学研究所仁科加速器科学研究センター(センター長:櫻井博儀、製造担当:羽場宏光 室長、金山洋介 技師、南部明弘 テクニカルスタッフI、佐藤望 研究パートタイマーI、重河優大 特別研究員、清水弘通 特別研究員)より、原料としてのアスタチンの供給を受け、大阪大学医学部附属病院 核医学診療科内の短寿命放射性薬剤製造施設において、治験薬GMP製造を行います。また本医師主導治験は大阪大学医学部附属病院において、核医学診療科(科長:礒橋佳也子 講師)と泌尿器科(科長:野々村祝夫 教授)との連携の下で実施されます。
なお、本シーズは2022-2026年度国立研究開発法人日本医療研究開発機構(AMED)橋渡し支援研究プログラム(シーズF)「課題名:前立腺特異的膜抗原(PSMA)を標的とした革新的α線治療薬の実用化に向けた医師主導治験の実施」に採択され、大阪大学医学部附属病院 未来医療開発部の橋渡し拠点(田中友希夫・滋野聡プロジェクトマネージャー、山岸 義晃 特任准教授(常勤)、飛田 英祐 特任教授(常勤))の支援の下で、治験の準備を進めてきました。今後、引き続き、AMED橋渡し支援研究プログラムならびに未来医療開発部の支援の下で治験を進めます。
本治験開始までの非臨床研究ならびに治験薬製造検討は、同放射線科学基盤機構(豊嶋厚史 教授、白神宜史 特任准教授(常勤)、大江一弘 准教授)、同理学研究科(深瀬浩一 教授、兼田加珠子 教授)の協力を得て、実施されました。また治験適正使用マニュアルの作成ならびに退出基準の検討は厚生労働省科学研究班(研究代表者:近畿大学 細野眞 教授)で実施され、日本核医学会(理事長:金沢大学 絹谷清剛 教授)の承認を得ています。
さらに、大阪大学核物理研究センターでは今後の多施設共同治験の実施に向けて、経済産業省の支援を受けて、「アルファ線核医学治療社会実装拠点」を建設中であり、2024年2月末にTATサイクロトロン棟が竣工しました(プレスリリース参照:2024/2/29『核物理研究センターTAT サイクロトロン棟が竣工』)。今後、アスタチンの製造に特化したサイクロトロンが設置され、アスタチンの大量安定供給が開始される予定です。
またアスタチンを医薬品として実用化するにあたり設立された大学発ベンチャー、アルファフュージョン株式会社(藤岡直CEO、本社:大阪府北区)との強固な連携体制が構築され、共同研究講座(アスタチン創薬実用化共同研究部門)を通じて、共同開発を進めています。
なお、本治験においては、PSMA-PETプローブの標識合成装置(CFN-MPS200、住友重機械工業社製)を治験使用機器として位置付け、F-18 PSMA-1007 PET検査(画像診断)を実施致します。