2024-06-25 基礎生物学研究所,生命創成探究センター,京都大学
基礎生物学研究所/生命創成探究センター 定量生物学研究部門の酒井啓一郎 元研究員(現:ニューヨーク市立大学ブルックリン校 研究員)、近藤洋平 元助教(現:京都大学生命科学研究科 特定准教授)、後藤祐平 元助教(現:京都大学生命科学研究科 准教授)、青木一洋 教授(現:京都大学生命科学研究科 教授、基礎生物学研究所/生命創成探究センター 教授(兼任))らは、休眠した酵母細胞内の流動性に着目し、休眠時の細胞質は低い流動性を示すが、目覚めと共に急速に流動化すること、さらに、この流動化に必要な一連の分子経路を明らかにしました。本成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences)に掲載予定で、2024年6月18日にオンライン先行公開されました。
 【研究の背景】
【研究の背景】
細胞は外界からのストレスを耐え忍ぶための様々な仕組みを備えています。そのひとつとして、一時的に成長・増殖を止めた細胞状態である「休眠(Dormancy)」が知られています。休眠細胞は、細胞内に乾燥保護機能を持つ化合物を蓄積し、また、細胞膜上を硬い殻のような構造で物理的に覆うことで高いストレス耐性を獲得します。身近な例では、植物は種子を作ることで休眠し、乾燥などの生存に不利な環境であっても長期に渡って生き続けることができます。休眠は可逆的な状態であり、ストレスが去って環境条件が良好になれば、細胞は成長・増殖を再開します。この再開の過程は「目覚め(Dormancy breaking)」と呼ばれ、植物の例では発芽に相当します。このような休眠と目覚めは、植物の種子だけでなく、細菌、酵母、哺乳類細胞、さらには、クマムシやユスリカといった様々な生物で見られます。これまでに多くの研究者が、これらの生物を対象として休眠と目覚めの過程を理解しようとしてきましたが、特に、目覚めの過程において細胞内でどのような仕組みが働いているのかについては、よくわかっていませんでした。
【研究の成果】
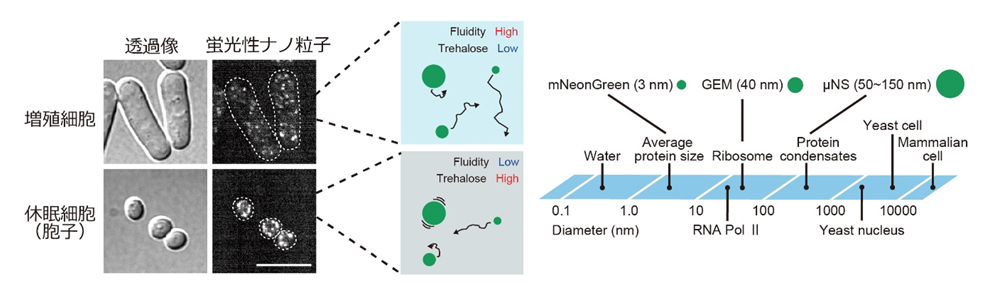
本研究では、分裂酵母(Schizosaccharomyces pombe)を用い、細胞の目覚めの仕組みを明らかにすることを試みました。分裂酵母は培地中の栄養源の濃度を変えるという単純な操作で、胞子(休眠)と発芽(目覚め)を誘導することができ、休眠・目覚め研究における優れたモデル生物です。まず、本研究グループは、微小な蛍光性のナノ粒子を分裂酵母で発現させ、粒子の動きを追跡することで、細胞内の流動性を評価しました。この蛍光性ナノ粒子は、細胞内のリボソーム(直径 40 nm程度)と同程度の大きさです。休眠した細胞では、脱水に起因して細胞内が極度に乾燥した状態になることが以前から知られており、細胞内の流動性が低下していることが予想されました。蛍光性ナノ粒子の動きを観察すると、増殖期の細胞と比較して、胞子では粒子の動きが数十倍遅くなっていました(図1)。つまり、休眠した胞子では細胞質の流動性は著しく低くなっているということがわかりました。
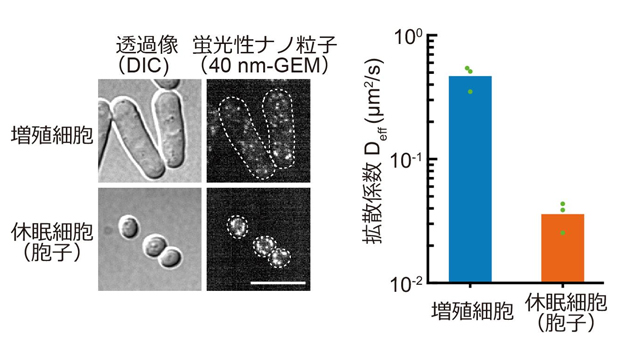
図1. 蛍光性ナノ粒子による細胞内の流動性の測定。蛍光性ナノ粒子を発現する増殖細胞と休眠細胞(胞子)の顕微鏡画像(左)。蛍光性ナノ粒子の軌道追跡から計算した拡散係数(右)。
次に、休眠から増殖期へ復帰するどこかの段階で細胞質が流動化することが考えられるため、発芽過程での細胞質の流動性の変化に着目しました。その結果、発芽を誘導してからわずか1時間以内に細胞質が流動化していることを発見しました(図2)。興味深いことに、このタイミングでは吸水に伴う細胞サイズの増大は見られず、吸水以外の機構により発芽時には細胞質が流動化すると考えられます。
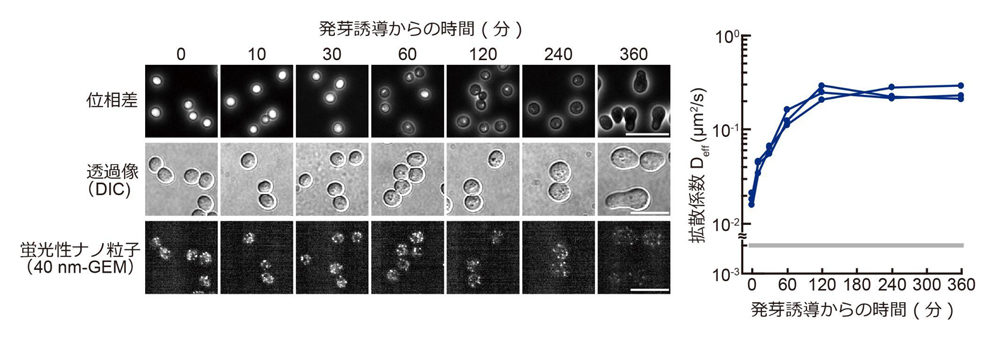 図2. 休眠からの目覚めにおける細胞内流動性の変化。
図2. 休眠からの目覚めにおける細胞内流動性の変化。
発芽過程における細胞質の流動化のメカニズムを解明するため、続いてグルコースのセンシング経路であるcAMP-PKA経路に着目しました(図3A)。分裂酵母の発芽はグルコースの添加で誘導されます。そのため、本経路を構成する因子を欠失した酵母細胞では正常に発芽過程が進まず、細胞質の流動化にも影響が見られると考えられました。cAMP-PKA経路の構成因子の破壊株(pka1Δ)では、グルコースを添加して発芽を誘導しても細胞質の流動性が低いままでした(図3B)。よって、cAMP-PKA経路が発芽過程での細胞質の流動化に必須であることがわかりました。
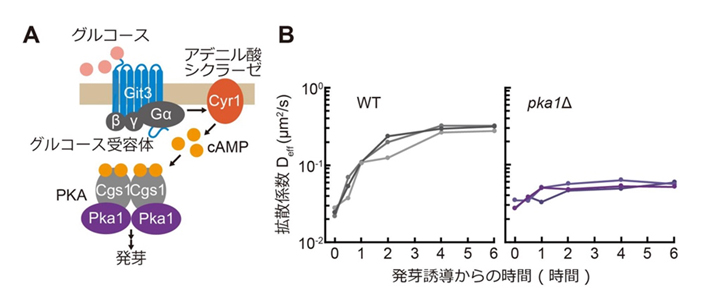
図3. グルコースを感知するcAMP-PKA経路が、休眠からの目覚めで細胞質を流動化させるのに必要である。(A) 分裂酵母のグルコース検知シグナル伝達経路であるcAMP-PKA経路の模式図。(B)cAMP-PKA経路の主要因子であるPKAの破壊株(pka1Δ)では、休眠からの目覚めを誘導しても細胞質の流動化が起こらない。
cAMP-PKA経路以外にも細胞質の流動化に関わるメカニズムがあるかを様々な手法を使って調べた結果、最終的にトレハロースが流動性に関わっていることを発見しました。トレハロースはグルコースが1,1-グリコシド結合した二糖の一種です。酵母を含め、休眠した多くの生物で細胞内にトレハロースが蓄積することが知られています。実際に、分裂酵母の胞子では増殖期の細胞と比べて、1000倍程度もトレハロース量が増加していました(図4A)。興味深いことに、発芽が始まるとトレハロースは急速に分解され、それと同じ時期に細胞質が流動化することがわかりました(図4B) 。この結果はトレハロースの分解が細胞質の流動化を引き起こす可能性を示唆しています。
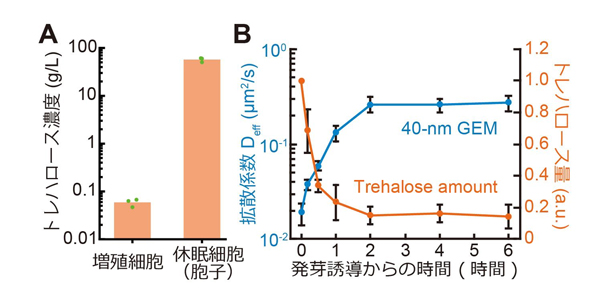
図4. 休眠細胞(胞子)ではトレハロースが蓄積しており、細胞質流動性の低下と相関している。(A) 増殖細胞と休眠細胞(胞子)でのトレハロース濃度。(B) 休眠から目覚める際のトレハロース量の変化を経時的に測定した。トレハロース量の低下は細胞質流動性の回復と同じタイミングで起こる。
cAMP-PKA経路の構成因子であるpka1の破壊株では発芽誘導後もトレハロースが蓄積したままであり、pka1破壊株では細胞質の流動化が起きないという結果と整合しました(図5A)。トレハロースが細胞質の流動性を制御するという考えをさらに検証するため、トレハロースの分解酵素であるNtp1を欠失した細胞で流動性を計測しました。その結果、ntp1破壊株では野生株と比較して十分に細胞質が流動化しないということが明らかになりました(図5B)。ntp1破壊株ではトレハロースが分解されないということも確かめられました(図5A)。これらの結果より、発芽開始後にNtp1が細胞内のトレハロースを分解することで、細胞質が流動化すると結論づけました(図5C)。cAMP-PKA経路の破壊株の結果を踏まえると、Ntp1の活性化はcAMP-PKA経路によって制御されていると考えられます。
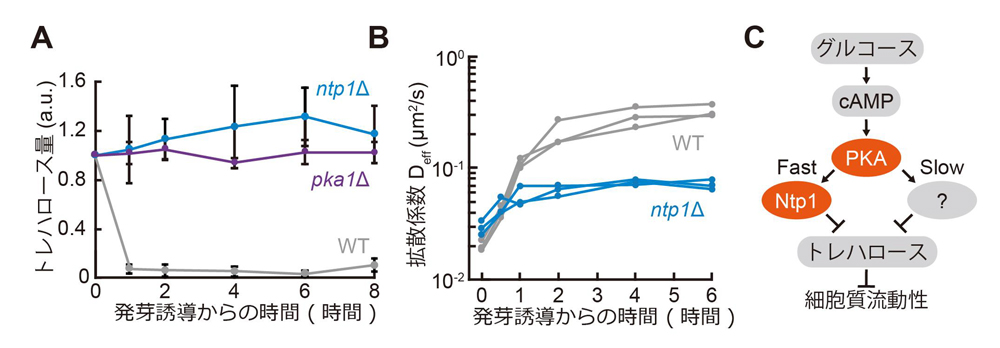 図5. トレハロースが分解されることにより、休眠からの目覚めが促される。(A) cAMP-PKA経路の主要因子であるPKAの破壊株(pka1Δ)では、休眠からの目覚めを誘導したときでもトレハロースの分解が抑制されている。トレハロース分解酵素Ntp1の破壊株(ntp1Δ)では、休眠からの目覚めを誘導したときでもトレハロースの分解が抑制されている。(B)トレハロース分解酵素Ntp1の破壊株(ntp1Δ)では、休眠からの目覚めを誘導しても細胞質流動性が低いままである。(C)分裂酵母胞子での休眠からの目覚めの分子機構。休眠細胞がグルコースを感知すると、cAMP-PKA経路を介して、トレハロース分解酵素Ntp1が活性化し、トレハロースが分解されることで細胞質の流動性が回復する。
図5. トレハロースが分解されることにより、休眠からの目覚めが促される。(A) cAMP-PKA経路の主要因子であるPKAの破壊株(pka1Δ)では、休眠からの目覚めを誘導したときでもトレハロースの分解が抑制されている。トレハロース分解酵素Ntp1の破壊株(ntp1Δ)では、休眠からの目覚めを誘導したときでもトレハロースの分解が抑制されている。(B)トレハロース分解酵素Ntp1の破壊株(ntp1Δ)では、休眠からの目覚めを誘導しても細胞質流動性が低いままである。(C)分裂酵母胞子での休眠からの目覚めの分子機構。休眠細胞がグルコースを感知すると、cAMP-PKA経路を介して、トレハロース分解酵素Ntp1が活性化し、トレハロースが分解されることで細胞質の流動性が回復する。
【本研究のまとめと今後の展望】
本研究では、分裂酵母の発芽過程における細胞質の流動化とその制御機構を明らかにしました。グルコースをcAMP-PKA経路が感知し、その下流でNtp1がトレハロースを分解することが細胞質の流動化に必要であることがわかりました。また従来、発芽開始の指標とされてきた位相差顕微鏡での黒色化(白から黒への変化)よりも細胞質の流動化が先行していたため(図2、位相差)、流動化は発芽過程の最初期の現象の一つであると考えられます。
本研究成果によって、酵母だけでなく他の生物種の休眠・目覚めの理解が進むことが今後期待されます。休眠はヒトの細胞のがん化と関連することも知られています。増殖を停止したがん細胞が突発的に目覚めて増殖を再開することが、がんの根治を難しくする一つの要因だと言われています。酵母から得られた知見によって、がん細胞や植物の種子の休眠と目覚めの理解に繋がれば、医療や農業へ応用できることが期待されます。
【発表雑誌】
雑誌名 Proceedings of the National Academy of Sciences
掲載日 2024年6月18日
論文タイトル:Cytoplasmic fluidization contributes to breaking spore dormancy in fission yeast
著者:Keiichiro Sakai*, Yohei Kondo*, Yuhei Goto**, and Kazuhiro Aoki** (*co-first authors, **co-corresponding authors)
DOI: https://doi.org/10.1073/pnas.2405553121
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの酒井啓一郎 研究員(現:ニューヨーク市立大学ブルックリン校 研究員)、近藤洋平 助教(現:京都大学生命科学研究科 特定准教授)、後藤祐平 助教(現:京都大学生命科学研究科 准教授)、青木一洋 教授(現:京都大学生命科学研究科 教授、基礎生物学研究所/生命創成探究センター 教授(兼任))の研究グループによる成果です。
【研究サポート】
本研究は、文部科学省日本学術振興会科学研究費助成事業(18H02444, 19H05798, 22H02625, 19K16050, 22K15110, 22J10844, 19H05675)の支援のもと行われました。
【本研究に関するお問い合わせ先】
自然科学研究機構 基礎生物学研究所 定量生物学研究部門
自然科学研究機構 生命創成探究センター 定量生物学研究グループ
京都大学 大学院生命科学研究科 統合生命科学専攻 遺伝機構学 細胞周期学分野
教授 青木 一洋 (アオキ カズヒロ)
【報道担当】
基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 研究戦略室
京都大学 渉外・産官学連携部 広報課 国際広報室