2024-10-29 東京大学
- 2024年に米国の乳牛で流行しているH5N1高病原性鳥インフルエンザウイルスが、ヒトに感染し、感染したヒトは結膜炎を発症した。
- マウスおよびフェレットに高い致死率を示した。
- フェレット間での飛沫感染を評価したところ、17-33%の確率で飛沫感染が認められ、飛沫感染したフェレットは死亡した。
発表内容
東京大学国際高等研究所 新世代感染症センター 河岡義裕 機構長らの研究グループは、2024年3月に米国の乳牛農場従業員で結膜炎を発症したヒトから分離されたH5N1高病原性鳥インフルエンザウイルスの病原性と感染伝播性について動物モデルを用いて解析しました。
H5N1亜型の高病原性鳥インフルエンザウイルス(注1)はヒトに感染することは稀であり、ヒトからヒトへと効率よく飛沫伝播は起こしませんが、ヒトに感染した場合には重篤な症状を引き起こし、50%程度の致死率を有します。2020年から現在に至るまで、H5N1亜型(clade 2.3.4.4b)の高病原性鳥インフルエンザウイルスが世界的に流行しており、ヒトを含む様々な哺乳類への感染例も報告されております。2024年3月以降、米国の14の州の乳牛においてH5N1高病原性鳥インフルエンザウイルスの感染例が報告されています。また、ウイルスに感染した牛の乳汁、体液を介したヒトへの感染例も報告されており、ヒトでのウイルスの感染拡大が懸念されています。
本研究では、ヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)の性状解析を行いました。
まず、huTX37-H5N1がヒトの細胞で増殖するのか、2種類の初代培養細胞を用いて調べました。実験には、牛から分離されたH5N1高病原性鳥インフルエンザウイルス(NM93-H5N1)およびヒトで強い病原性をもつヒトから分離されたH5N1高病原性鳥インフルエンザウイルス(VN1203-H5N1)を比較対象として使用しました。異なる感染量(multiplicity of infection: MOI)(注2)でウイルスを感染後、37℃と33℃の培養条件で継時的にウイルス増殖を評価しました。33℃ではhuTX37-H5N1の増殖性は角膜上皮細胞では限定的であった一方で、肺胞上皮細胞ではその他の2種類のウイルスと比較しても高いウイルス力価が認められました(図1)。37℃での肺胞上皮細胞では、全てのウイルスが効率よく増殖しました(図1)。この結果から、ヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)は、ヒトの肺で効率よく増殖する可能性が示唆されました。

次に、マウスを用いてヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)の病原性を調べました。マウスに106感染価、105 感染価、104 感染価、103 感染価、102 感染価、101 感染価、100 感染価のウイルスを経鼻的に感染後、体重変化と50%マウス致死量(50%のマウスが死亡する感染価: MLD50)を評価しました。その結果、感染させたマウスは全て死亡し、MLD50は1 感染価以下であることから、本ウイルスはマウスに対して非常に強い病原性を有していることがわかりました(図2)。以前に行った研究では、牛から分離されたH5N1高病原性鳥インフルエンザウイルス(NM93-H5N1)のMLD50が31.6感染価、以前にヒトから分離されたH5N1高病原性鳥インフルエンザウイルス(VN1203-H5N1)のMLD50が2.2感染価であった(Eisfeld et al., Nature, 2024)ことから、ヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)はそれらのウイルスよりもマウスに対して強い病原性を有していることが明らかになりました。続いて103 感染価のhuTX37-H5N1を感染させたマウスの臓器中のウイルス量を測定しました。その結果、huTX37-H5N1は感染後3日で脳や筋肉を含む全身の臓器で増殖していることがわかりました(図2)。
続いて、フェレットでの病原性を調べました。106 感染価のhuTX37-H5N1をフェレットに経鼻的に接種後、体重と体温の変化を調べました。その結果、感染したフェレットは体重減少および低体温を呈し、感染後5日までにすべてのフェレットが死亡しました(図3)。臓器中のウイルス量を調べたところ、マウスと同様に全身の臓器からウイルスが検出されました(図3)。中でも肝臓で非常に多量のウイルスが検出されました。以前行った研究では、牛から分離されたH5N1高病原性鳥インフルエンザウイルス(NM93-H5N1)に感染したフェレットは、6日目まで全て生存していたことから、huTX37-H5N1はフェレットにおいてNM93-H5N1よりも強い病原性を持っていることが明らかになりました。
さらに、huTX37-H5N1のフェレット間での飛沫伝播性について調べました。以前、本研究グループは、牛から分離されたH5N1高病原性鳥インフルエンザウイルス(NM93-H5N1)が効率は悪いながらフェレット間で飛沫伝播することを報告しました(Eisfels et al., Nature, 2024)。2匹のフェレットを直接接触しないように置かれたケージで飼育し、一方のフェレット(感染群)に106 感染価 のhuTX37-H5N1を経鼻的に感染させ、飛沫を介してウイルスがフェレット(暴露群)に感染するかどうかを継時的に鼻腔スワブを採取して評価しました。感染群のフェレットは、感染後4日目までにすべて死亡しました。注目すべきは、6ペア中2ペアのフェレット(33%)で暴露群の鼻腔スワブからウイルスが検出されたことです(図4)。これらウイルスが検出された暴露群のフェレットは、暴露後6日目までに死亡、もしくは安楽殺されました。続いて、より少ないウイルスを感染させた場合の飛沫伝播性を評価しました。103 感染価、102 感染価、101 感染価のhuTX37-H5N1をそれぞれフェレット(6ペア)に経鼻的に接種後、同様に飛沫伝播を評価しました。その結果、全ての感染群のフェレットは感染後6日目までに死亡しました。全ての感染量において、6ペア中1ペアのフェレット(16.7%)で暴露群の鼻腔スワブからウイルスが検出されました。ウイルスが検出された暴露群のフェレットは全て死亡し、全身の臓器からウイルスが検出されました。これらの結果から、ヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)は17-33%の確率でフェレット間を飛沫伝播し、飛沫感染したフェレットは死亡することがわかりました。
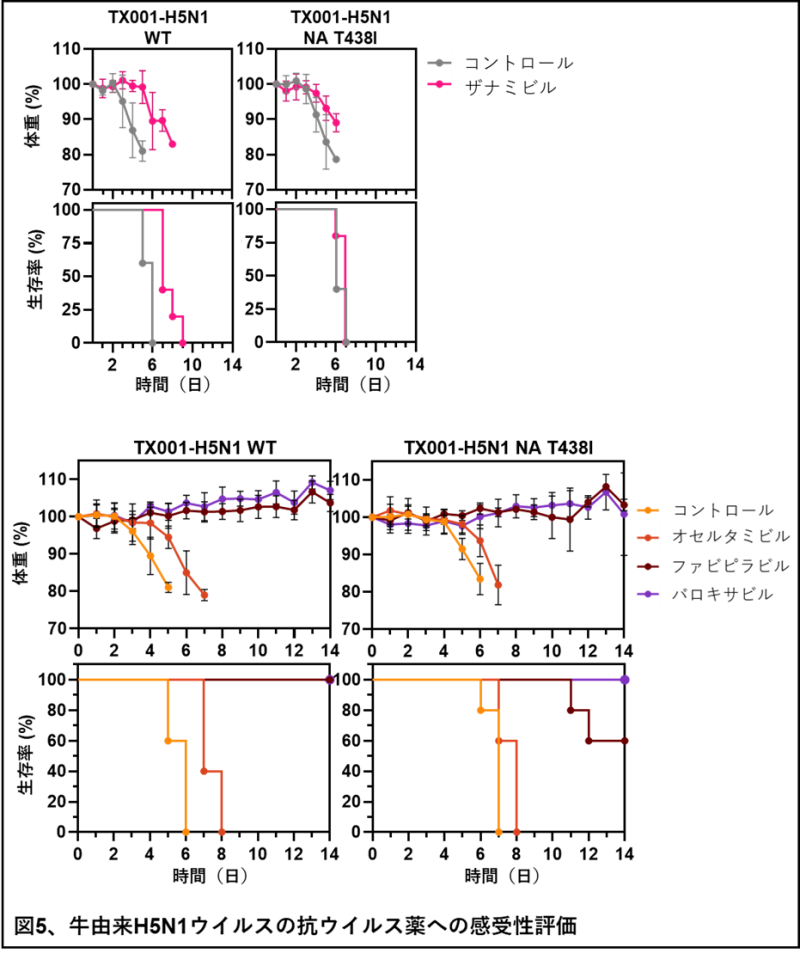
最後に、抗ウイルス薬への感受性を評価しました。ノイラミニダーゼ(NA)阻害薬とポリメラーゼ阻害薬は、インフルエンザウイルスに対する抗ウイルス薬として使用されます。NAにアミノ酸変異(T438I)が起きることで、NA阻害薬に対する感受性が低下することが知られています。このT438I変異をNA遺伝子にもつ牛H5N1高病原性鳥インフルエンザウイルスがデータベース上に報告されており、抗ウイルス薬に対する感受性の低下が懸念されています。そこで、NAにT438I変異をもつ牛H5N1高病原性鳥インフルエンザウイルス(TX001-H5N1-T438I)をリバースジェネティクス法(注3)で作製し、マウスを使用して抗ウイルス薬への感受性を調べました。TX001-H5N1またはTX001-H5N1-T438Iを経鼻的に感染し、その1時間後に、NA阻害薬であるザナミビルをマウスに経鼻的に投与しました。その結果、感染したウイルスにかかわらず、すべてのマウスが死亡しました(図5)。次に、経口NA阻害薬であるオセルタミビルに加えて、ポリメラーゼ阻害薬に対する感受性を調べました。オセルタミビル、ポリメラーゼ阻害薬としてファビピラビルとバロキサビルを投与したマウスにウイルスを感染後、体重変化と生存を評価しました。オセルタミビルを投与したマウスは、8日目までにすべて死亡しましたが、過半数のファビピラビル投与マウス、ならびにすべてのバロキサビル投与マウスが生存しました(図5)。これらの結果から、ポリメラーゼ阻害薬は牛由来H5N1高病原性鳥インフルエンザウイルスに対し、有効であることが明らかになりました。
以上の結果から、ヒトから分離された牛由来高病原性鳥インフルエンザウイルス(huTX37-H5N1)は、ヒトの肺の細胞で効率よく増殖すること、マウスおよびフェレットに強い病原性を有していること、フェレット間で飛沫伝播し、飛沫感染したフェレットが死亡することが明らかになりました。本研究を通して得られた成果は、現在米国および世界中で流行しているclade 2.3.4.4bに属するH5N1鳥インフルエンザウイルスへの対策および、将来のインフルエンザウイルスによるパンデミック対策計画を策定、実施する上で、重要な情報となります。
本研究は10月29日(日本時間)英国科学誌「Nature」(オンライン版)に公表されました。
発表者
東京大学国際高等研究所 新世代感染症センター
河岡 義裕 特任教授/機構長
兼:国立国際医療研究センター研究所 国際ウイルス感染症研究センター長
東京大学医科学研究所 ウイルス感染部門 特任教授
研究助成
本研究は、東京大学国際高等研究所 新世代感染症センター、国立国際医療研究センター、東京大学医科学研究所、静岡県立大学、米国ウィスコンシン大学が共同で実施し、日本医療研究開発機構(AMED)、新興・再興感染症研究基盤創生事業(中国拠点を基軸とした新興・再興および輸入感染症制御に向けた基盤研究)ならびに、AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業(ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス(東京大学国際高等研究所新世代感染症センター))の一環として行われました。
用語解説
(注1)鳥インフルエンザウイルス
A、B、C、D型の4種類に分類されるインフルエンザウイルスの中で、A型インフルエンザウイルスは、過去に世界的な大流行(パンデミック)を起こしてきた。ウイルス表面にある2つの糖たんぱく質、ヘマグルチニン(HA)とノイラミニダーゼ(NA)の抗原性の違いにより、さらに細かく亜型が分類されている。現在までに、HAでは19種類(H1からH19)、NAでは11種類(N1からN11)の亜型が報告されており、本研究で対象としたH5N1ウイルスはH5亜型、N1亜型に分類されるA型インフルエンザウイルスのことをいう。
鳥インフルエンザはA型インフルエンザウイルスが原因となり生じる鳥の病気である。鳥インフルエンザウイルスは家禽に対する病原性を指標に、低病原性と高病原性に分類される。低病原性鳥インフルエンザウイルスに感染した家禽は無症状か軽い呼吸器症状、下痢、産卵率の低下を示す程度であるが、高病原性鳥インフルエンザウイルスでは重篤な急性の全身症状を呈して、ほぼ100%の家禽が死亡する。
(注2)multiplicity of infection: MOI
感染多重度。ここでは細胞とウイルスの比率を意味し、MOI=0.1の場合、10個の細胞に対して1個のウイルスの比率で感染することを意味する。
(注3)リバースジェネティクス法
ウイルスゲノムから感染性ウイルスを人工的に作製する技術。
論文情報
Chunyang Gu*, Tadashi Maemura*, Lizheng Guan*, Amie J. Eisfeld*, Asim Biswas*, Maki Kiso*, Ryuta Uraki, Mutsumi Ito, Sanja Trifkovic, Tong Wang, Lavanya Babujee, Robert Presler Jr., Randall Dahn, Yasuo Suzuki, Peter J. Halfmann, Seiya Yamayoshi, Gabriele Neumann, and Yoshihiro Kawaoka¶, “A human isolate of bovine H5N1 is transmissible and lethal in animal models,” Nature: 2024年10月29日, doi:10.1038/s41586-024-08254-7.
論文へのリンク (掲載誌)
お問い合わせ先
〈研究に関する問合せ〉
東京大学国際高等研究所 新世代感染症センター
河岡 義裕(かわおか よしひろ) 特任教授/機構長
兼:
国立国際医療研究センター研究所 国際ウイルス感染症研究センター長
東京大学医科学研究所 ウイルス感染部門 特任教授