2018-06-14 理化学研究所
理化学研究所(理研)脳神経科学研究センター タンパク質構造疾患研究チームの遠藤良研究員と田中元雅チームリーダーらの国際共同研究グループ※は、神経変性疾患[1]の一つ「前頭側頭葉変性症(FTLD)」における精神障害の発現機構を分子レベルで解明しました。疾患の原因タンパク質が相互作用する他のタンパク質を一緒に凝集(共凝集)させることで、神経細胞の樹状突起内で起こる局所翻訳[2]に障害が生じ、これが起因となって精神障害が発現することが分かりました。
本研究成果は、神経変性疾患の多くで併発する精神障害の発症機構の解明に加えて、不安障害やうつ病などの精神疾患の発症機構の解明につながる可能性があります。さらに、タンパク質凝集体[3]や神経細胞での翻訳因子を標的とした、新たなバイオマーカーや治療法の開発にもつながると期待できます。
FTLDの患者には逸脱した社会行動などの精神障害がみられることから、神経変性疾患と精神障害には共通する発症機構が存在すると考えられていましたが、分子レベルでは、そのメカニズムはよく分かっていませんでした。今回国際共同研究グループは、培養神経細胞とマウスを用いて、さまざまな精神障害に関わるタンパク質DISC1が、神経細胞の樹状突起で起こる局所的な翻訳を制御することを発見しました。また、DISC1がFTLDの原因タンパク質TDP-43[4]と共凝集することで、その局所翻訳機能が低下し、精神障害が発現することも発見しました。
本研究は、米国の科学雑誌『Biological Psychiatry』(5月8日)に掲載されました。
※国際共同研究グループ
理化学研究所 脳神経科学研究センター タンパク質構造疾患研究チーム
研究員 遠藤 良(えんどう りょう)
チームリーダー 田中 元雅(たなか もとまさ)
埼玉医科大学国際医療センター
教授 高尾 昌樹(たかお まさき)
名古屋市立大学大学院 医学研究科
教授 赤津 裕康(あかつ ひろやす)
東京都健康長寿医療センター
研究部長 村山 繁雄(むらやま しげお)
ジョンズ・ホプキンス大学統合失調症センター
ディレクター・教授 澤 明(さわ あきら)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 新学術領域「新生鎖の生物学(領域代表:田口英樹)」、東京都健康長寿医療センターおよび福祉村病院 高齢者ブレインバンクなどの支援を受けて行われました。
背景
神経変性疾患の多くは精神障害を併発し、不安障害やうつ病などの精神疾患と似た症状を示すことが知られています。例えば、神経変性疾患の一つ「前頭側頭葉変性症(FTLD)」の患者は、社会性の欠如などの行動異常を示します。FTLD患者の脳の前頭葉や側頭葉では神経細胞の脱落(神経細胞死)がみられ、残存した神経細胞には「TDP-43」などの異常タンパク質の凝集が認められます。このことは、TDP-43の凝集体形成がFTLDで併発する精神障害の発現にも関与している可能性を示しています。しかし、これまでTDP-43の凝集体がもたらす神経細胞死に関する研究は広く行われてきたものの、この凝集体がどのように精神障害に関与するかはよく分かっていませんでした。
TDP-43などの神経変性疾患の原因タンパク質が凝集体を形成する際には、しばしば、ある程度の特異性を持って、相互作用する他のタンパク質を一緒に凝集させる(共凝集)ことが知られています。このことから、TDP-43と共凝集するタンパク質はその機能を失うと考えられます。
国際共同研究グループは、TDP-43と共凝集する可能性のあるタンパク質として「DISC1」に着目しました。DISC1は、さまざまな精神障害に関与することに加えて、凝集性が高いことで知られています注1)。また、TDP-43が結合するタンパク質の一部は、DISC1とも結合することも知られています。そこで、著しい精神障害を併発するFTLDを病態モデルとして、DISC1がTDP-43と共凝集するのか、共凝集する場合にはDISC1のどのような機能が低下するのか、またその機能低下が精神障害を誘発するのかについて調べることにしました。
注1)Tanaka M, Ishizuka K, Nekooki-Machida Y, Endo R, Takashima N, Sasaki H, Komi Y, Gathercole A, Huston E, Ishii K, Hui KK, Kurosawa M, Kim SH, Nukina N, Takimoto E, Houslay MD, Sawa A. Aggregation of scaffolding protein DISC1 dysregulates phosphodiesterase 4 in Huntington’s disease. J. Clin. Invest., 127, 1438-1450 (2017).
研究手法と成果
国際共同研究グループはまず、マウスおよびヒト由来の神経細胞(図1)において、DISC1がTDP-43と結合するのか、免疫沈降法[5]で調べました。その結果、結合することが分かりました。
次に、マウス神経細胞内に凝集性の高いTDP-43のC末端[6]の断片(TDP-220C)を発現させ、FTLD患者の脳内の神経細胞と同様に、細胞質と樹状突起内にTDP-220Cの凝集体を持つ「FTLDモデル神経細胞」を作製、培養しました。免疫染色によって細胞内でつくられる内在性のDISC1を検出したところ、DISC1はTDP-220C凝集体と同じ場所に顕著に局在しており、両者が共凝集することが示されました(図2)。さらに、ヒトFTLD患者の脳においても、DISC1は多くのTDP-43の凝集体と共凝集していることが分かりました。
次に、TDP-43凝集体との共凝集によってDISC1のどのような機能が低下するのかを調べました。そこで、DISC1の新たな機能としてメッセンジャーRNA(mRNA)の翻訳に着目しました。ショ糖密度勾配実験[7]によって、通常の神経細胞のリボソーム[8](mRNAの翻訳を行なう場所)を40S、60S、モノソーム[9]、ポリソーム[9]の四つに分画し、DISC1がこれらの画分に局在するかを調べました。その結果、DISC1は活発にmRNAの翻訳を行っているポリソームと相互作用すること、さらに40Sに多く局在することが分かりました。これらの結果は、DISC1がmRNAの翻訳に関与していることを強く示しています。
そこで、DISC1がmRNAの翻訳開始とペプチド鎖(タンパク質を構成するアミノ酸がペプチド結合で連結したもの)の伸長のどちらに関与するかを調べました。DISC1の発現を抑制させた神経細胞の抽出液にmRNAを加えて、どのような影響が出るかを調べた結果、翻訳開始因子[10]を必要としないmRNAの翻訳よりも、翻訳開始因子を必要とするmRNAの翻訳が著しく阻害されました。この結果から、DISC1はmRNAの翻訳開始に、より大きく関与していることが明らかになりました。
DISC1の発現を抑制させた神経細胞におけるDISC1の翻訳への関与をさらに調べるため、新しくつくられるタンパク質(新生タンパク質)の合成量を検出しました。その結果、DISC1の発現を抑制すると、神経刺激に応答して樹状突起内のmRNAの翻訳(局所翻訳)によってつくられる新生タンパク質の合成量が著しく低下することが明らかになりました。また、シナプス(図1)に局在するさまざまなタンパク質(シナプスタンパク質)の合成量が著しく低下していました。このことから、DISC1は神経活動依存的な局所翻訳によってシナプスタンパク質の発現を制御していることが分かりました。
次に、TDP-43が凝集しているFTLDモデル神経細胞を用いて同様の実験を行った結果、同じく神経活動依存的な局所翻訳の著しい低下が見られました。そこで、この機能不全にDISC1のTDP-43との共凝集が関わっているかを調べるため、FTLDモデル神経細胞にDISC1を発現させ、可溶性のDISC1量を増やしました。その結果、神経活動依存的な局所翻訳が回復しました。このことから、DISC1がTDP-43と共凝集することにより機能障害を受け、局所翻訳が低下していることが分かりました。
最後に、DISC1とTDP-43の共凝集によるDISC1の機能低下が、FTLD患者で見られる社会性の欠如などの行動異常に関与するか調べました。アデノ随伴ウイルス[11]を用いてマウス脳にTDP-220Cを発現させ、TDP-220C凝集体を形成させた「FTLDのモデルマウス(TDP-220Cマウス)」を作製しました。このマウスの脳を調べた結果、前頭葉の神経細胞では、内在性のDISC1がTDP-220C凝集体と共凝集しており、シナプスタンパク質の著しい減少が見られました。この結果は、培養神経細胞における実験と一致しています。
また、自発的な活動性や社会性をみるための行動試験を行った結果、TDP-220Cマウスは社会性の欠如および多動性を示しました。(図3)。そこでTDP-220Cマウスの前頭葉にDISC1を共発現させ、可溶性のDISC1を増やしたところ、行動異常が有意に回復しました(図3)。
これらの結果から、DISC1がTDP-220Cの凝集体と共凝集することで、DISC1の局所翻訳機能が低下し、精神障害が発現することが明らかになりました。
今後の期待
近年、神経細胞の樹状突起における局所翻訳は、脳の高次機能に重要であることが示されています。今回、DISC1とTDP-43が局所翻訳を制御すること、そして凝集体形成による局所翻訳の機能破綻が精神障害の発現に関与することを見いだしました。この結果は、神経変性疾患の多くで併発する精神障害の発症機構の解明に加えて、不安障害やうつ病といった精神疾患の発症機構の解明につながる可能性があります。
さらに、これらの疾患に対する、タンパク質凝集体や神経細胞での翻訳因子を標的とした新たなバイオマーカーや治療法の開発にもつながると期待できます。
原論文情報
Ryo Endo, Noriko Takashima, Yoko Nekooki-Machida, Yusuke Komi, Kelvin Kai-Wan Hui, Masaki Takao, Hiroyasu Akatsu, Shigeo Murayama, Akira Sawa and Motomasa Tanaka, “TDP-43 and DISC1 Co-Aggregation Disrupts Dendritic Local Translation and Mental Function in FTLD”, Biological Psychiatry, 10.1016/j.celrep.2018.03.035
発表者
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
研究員 遠藤 良(えんどう りょう)
(旧 脳科学総合研究センター タンパク質構造疾患研究チーム 研究員)
チームリーダー 田中 元雅(たなか もとまさ)
(旧 脳科学総合研究センター タンパク質構造疾患研究チーム チームリーダー)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 神経変性疾患
- 神経細胞の変性・脱落を伴う病気の総称。異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。前頭側頭葉変性症(FTLD)、アルツハイマー病、パーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。
-
- 局所翻訳
- 細胞体から離れた場所で行われるメッセンジャーRNA(mRNA)の翻訳。神経細胞においては、細胞体から樹木の枝のように複数分岐した樹状突起や軸索でもmRNAが輸送され、翻訳が行われる。
-
- タンパク質凝集体
- 変性したタンパク質、または折り畳み途中で異常が起こったタンパク質同士が寄り集ることでできる塊。タンパク質としての本来の機能を持たず、神経変性疾患など病気の原因となると考えられている。
-
- TDP-43
- 前頭側頭葉変性症(FTLD)の変性部位である前頭葉と側頭葉に存在するタンパク質凝集体の主要構成成分。RNAに結合するタンパク質であり、核内ではRNAの安定化や転写調節に、核外では樹状突起へのmRNAの輸送などに関与している。
-
- 免疫沈降法
- 抗原と抗体の親和性を利用することで、溶液中から目的の抗原を特異的に分離させる手法。タンパク質同士の相互作用を解析する際に広く用いられる。
-
- C末端
- タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシル基がペプチド結合(-NH-CO)をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシル基側をC末端と呼ぶ。
-
- ショ糖密度勾配実験
- ショ糖密度勾配溶液を用いて、リボソームの大きさ(重さ)を指標にリボソームの大小の各サブユニットやモノソームとポリソームを分離する手法。
-
- リボソーム
- mRNAの翻訳を行なう(遺伝情報からタンパク質を合成する)場所。真核生物では、40Sの小サブユニットと60Sの大サブユニットからなる。
-
- モノソーム、ポリソーム
- 小サブユニット(40S)と大サブユニット(60S)から構成される、一つのリボソーム。翻訳されているmRNAに複数のリボソームが連結したものは、ポリソームという。
-
- 翻訳開始因子
- 遺伝子の情報を持つ mRNA、翻訳の最初のアミノ酸を提供するMet-tRNA、翻訳反応を進行させるリボソームの三者が会合すると、タンパク質の合成を開始させる「開始複合体」が形成される。翻訳開始遺伝子とは開始複合体の形成に働くタンパク質のグループであり、30種類以上が知られている。
-
- アデノ随伴ウイルス
- DNAゲノムを保有するウイルスで、ヒトに感染しても重篤な症状を引き起こさず、19番染色体の特定のゲノム領域などに組み込まれることが知られている。このような性質から、ベクターウイルスとして遺伝子導入に広く用いられる。
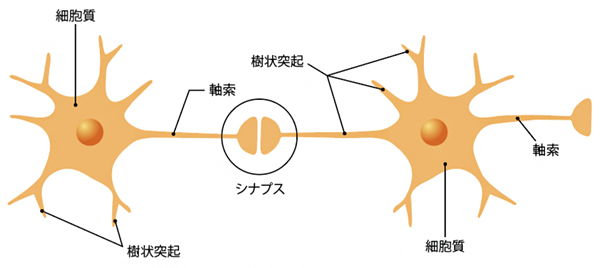
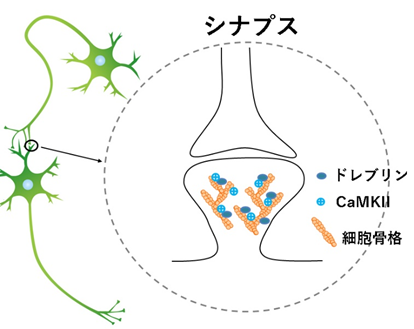
図1 神経細胞とシナプスの模式図
神経細胞は大きく細胞質(細胞体)、軸索、樹状突起からなっている。シナプスは神経細胞間または神経細胞と他種細胞間に形成される結合部位とその構造。シナプスに局在するタンパク質(シナプスタンパク質)によって、細胞間の化学物質による信号の伝達を行い、神経活動に重要な役割を担う。
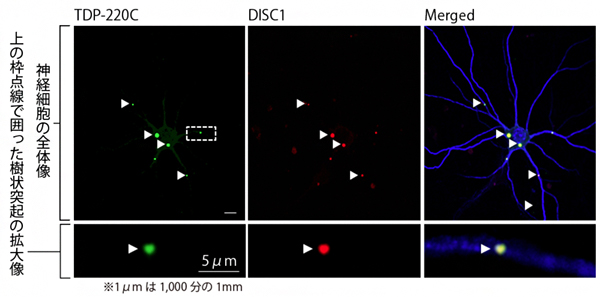
図2 前頭側頭葉変性症(FTLD)モデル神経細胞におけるDISC1とTDP220Cの共凝集
左:レンチウイルスによって神経細胞内にTDP-43のC末端の断片(TDP-220C)を発現させ、TDP-220C凝集体(緑)を形成させたFTLDモデル神経細胞。矢頭はTDP-220C凝集体を指す。
中:免疫染色によって検出したFTLDモデル神経細胞内の内在性のDISC1(赤)。
右:左と中の写真を重ね合わせた画像。青色は樹状突起と核を示す。DISC1とTDP-220C凝集体が共凝集していることが分かる。
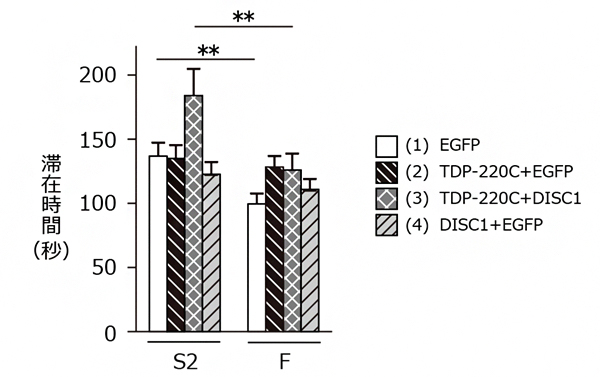
図3 FTLDモデルマウス(TDP-220Cマウス)を用いた行動解析実験
(1)EGFP:緑色蛍光タンパク質(EGFP)のみを発現したコントロールマウス
(2)TDP-220C+EGFP:TDP-220CとEGFPを共発現したFTLDモデルマウス
(3)TDP-220C+DISC1:TDP-220CとDISC1を共発現したマウス
(4)DISC1+EGFP:DISC1とEGFPを共発現したマウス
(1)~(4)のマウスが「既知のマウス(F)」と「新奇なマウス(S2)」の周囲に滞在した時間を測定した。その結果、(1)コントロールマウスは既知のマウス(F)より新奇なマウス(S2)と長く接触した。(2)FTLDモデルマウスは新奇なマウス(S2)に対して興味を示さず、社会性の欠如が認められた。この社会性の欠如はDISC1を共発現させることで回復した。