2025-02-12 国立がん研究センター
発表のポイント
- BRAF融合遺伝子陽性の膵がんまたは低悪性度神経膠腫を対象とした医師主導治験で、参加を希望する患者さんの希望に応じて自宅近くの医療機関と国立がん研究センター中央病院がパートナー契約を締結し、その医療機関(パートナー施設)で治験に必要な検査や中央病院とのオンライン診療を行うオンライン治験を開始しました。
- BRAF融合遺伝子陽性の膵がんなど患者数が少ないがんの治験は、治験に必要な患者さんの登録に時間を要し、また治験を実施する医療機関も限られるため、臨床開発が進み難い状況にあります。
- オンライン治験の導入により、地方在住の希少がん患者さんの治験参加における時間的・経済的負担が軽減し、治験へのアクセスが劇的に改善するのみならず、参加を希望する患者さんの早期登録と速やかな臨床開発につなげることをめざしてまいります。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:瀬戸泰之、以下「中央病院」)は、BRAF融合遺伝子陽性の膵がんまたは低悪性度神経膠腫を対象とした医師主導治験(Perfume試験:NCCH2101/MK011)において、参加を希望する患者さんの自宅近くの医療機関と中央病院がパートナー契約を締結し、その医療機関(パートナー施設)で治験に必要な検査や中央病院とのオンライン診療を行うオンライン治験を開始しました。BRAF融合遺伝子陽性の膵がんなど患者数が少ないがんの治験は、治験に必要な患者さんの登録に時間を要し、また治験を実施する医療機関も限られるため、臨床開発が進み難い状況にあります。しかし、本試験のように参加を希望される患者さんの自宅近くでパートナー施設を検討し、中央病院と連携いただくことで、中央病院に通院が困難な地方在住の希少ながんの患者さんも治験に参加しやすくなります。
昨年よりオンライン治験への参加が可能となった、局所進行・再発類上皮肉腫に対するタゼメトスタットの第II相医師主導治験(TAZETTA試験)では、一部の患者さんはオンライン治験でパートナー施設に通院して治験に参加しています。同試験では、オンライン治験を導入したことで予定より早期に患者さんの登録を終了することが実現しました。このたび、BRAF融合遺伝子陽性の膵がんまたは低悪性度神経膠腫を対象とする医師主導治験(Perfume試験)においても、このオンライン治験を導入することで、参加を希望する患者さんの早期登録と速やかな臨床開発につなげることを目指してまいります。
両試験へのDCT(decentralized clinical trial)導入は、国立研究開発法人日本医療研究開発機構(AMED)臨床研究・治験推進研究事業「希少がんプラットフォーム試験へのDCT導入に関する研究開発(研究代表者:中村 健一)」の支援を受けています。
オンライン治験について
従来、治験へ参加するためには、決められたスケジュールで治験実施医療機関まで毎回来院する必要がありましたが、オンライン治験では治験実施医療機関に必ずしも来院することなく、治験へ参加することが可能になります。オンライン治験では、患者さんは居住地域の医療機関(パートナー施設)へ来院していただきます。パートナー施設と治験実施医療機関である国立がん研究センター中央病院をオンラインでつなぎ診察を行います。治験薬(経口薬)は、中央病院から患者さんの自宅へ直接配送し、患者さんには国立がん研究センター中央病院の医師の指示のもとで内服を行っていただきます。治験期間中の検査については、決められたスケジュールでパートナー施設にて検査を受け、検査結果はパートナー施設から国立がん研究センター中央病院に共有されます。こうした仕組みによって、患者さんは自宅近くの医療機関を介して治験へ参加することができます。
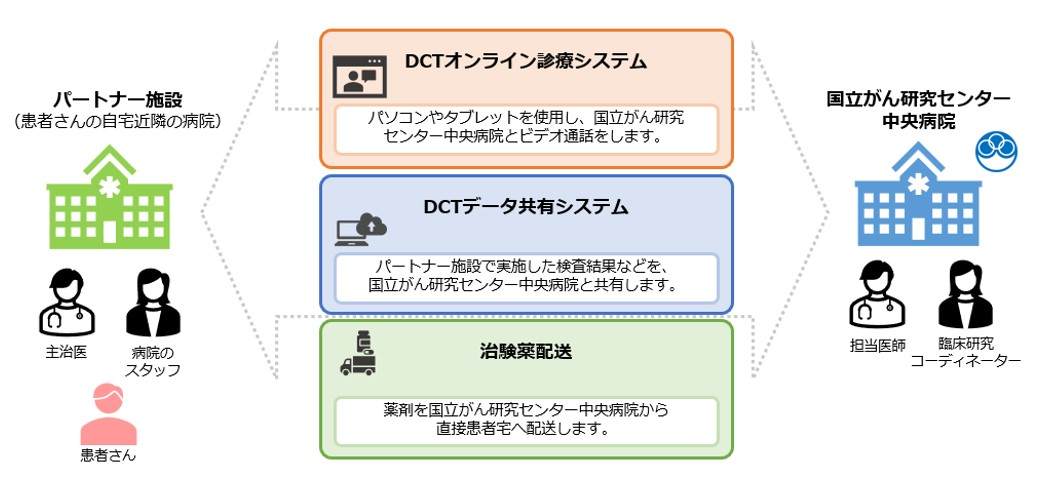
なお、パートナー施設は、がんゲノム医療中核拠点病院・拠点病院・連携病院のいずれかであるなどの条件があります。国立がん研究センター中央病院とパートナー施設との間で、あらかじめ(プレコントラクト)、あるいは患者さんから申し出があった時点(オンデマンド)で施設間契約を締結します。現在のパートナー施設は、国立病院機構四国がんセンター、島根大学医学部附属病院、鹿児島大学病院、熊本大学病院、高知大学病院の5施設です。今後パートナー施設を全国に拡大し、希少がんオンライン治験ネットワークを整備していきます。
希少がんの治療開発について
希少がんの新規治療開発は、患者さんの数が極めて少ないことや、対象となる疾患の患者さんの情報を集約する仕組みが十分に構築されていないことから、患者登録に長い年月を要し、ランダム化比較試験を実施することが困難であり、企業による開発が積極的に行われていません。
国立がん研究センター中央病院では、希少がんでの治療開発を推進するため、2014年には「希少がんセンター」を開設し、2017年からは企業とも共同で希少がんの研究開発・ゲノム医療を推進する「MASTER KEY(マスター キー)プロジェクト」を立ち上げ、2024年10月時点で31の医師主導治験・企業治験をプロジェクトとして実施しています。
しかしながら、このような希少がんの治験は都市部に偏在しており、地方在住患者さんの治験へのアクセスの改善について希少がんの患者団体からも強い要望が寄せられています。遠隔地から中央病院で実施している治験に参加することを希望したとしても、移動のための時間的、経済的負担によって断念するケースも多く、治験へのアクセスの地域間格差は、地方在住の患者さんにとって大きな課題となっています。
こうした背景をもとに、中央病院ではMASTER KEYプロジェクトで実施されている2つの医師主導治験(TAZETTA試験、Perfume試験)でオンライン治験を開始し、患者さんが地域に居ながらにして中央病院が実施する治験へ参加することが可能となりました。

MASTER KEY(マスター キー) プロジェクト ウェブサイト https://www.ncc.go.jp/jp/ncch/masterkeyproject/index.html
今後の展望
オンライン治験の導入により、地方在住の患者さんの治験参加における時間的・経済的負担が軽減し、治験へのアクセスが劇的に改善するのみならず、参加を希望する患者さんの早期登録と速やかな臨床開発につなげることをめざしてまいります。今後パートナー施設を全国に拡大し、希少がんオンライン治験ネットワークを整備していきます。
また希少がんや希少な遺伝子異常を持つがんに対する医師主導治験・企業治験にも積極的にオンライン治験の導入を進めていきます。小児を対象とした試験や、希少がん以外への拡大も視野にいれて、患者さんの来院とオンライン診療を組み合わせたハイブリッド型のオンライン治験の実施など、患者さんのニーズや研究の特徴にあわせ、患者さんの治験へのアクセスを改善する取り組みを進めていきます。
国立がん研究センターは、オンライン治験の導入を通し、がん対策推進基本計画(第4期)注1の全体目標「誰一人取り残さないがん対策を推進し、全ての国民とがんの克服を目指す。」に取り組んでまいります。
用語解説
注1 がん対策推進基本計画
「がん対策推進基本計画」については、がん対策基本法(平成18年法律第98号)に基づき策定するものであり、がん対策の総合的かつ計画的な推進を図るため、がん対策の基本的方向について定めるとともに、都道府県がん対策推進計画の基本となるものです。2023年3月28日に閣議決定された「がん対策推進基本計画(第4期)」では2023年度から6年間の基本指針を示すもので「誰一人取り残さないがん対策を推進し、全ての国民とがんの克服を目指す」を全体目標に掲げ、「予防」「医療」「がんとの共生」を柱としています。
試験情報
【Perfume試験】 (候補患者さん募集中)
課題名 BRAF融合遺伝子陽性の進行・再発の低悪性度神経膠腫または膵癌に対するビニメチニブの第II相医師主導治験
治験実施計画書番号 NCCH2101/MK011
治験薬 ビニメチニブ(経口薬:MEK阻害薬)
研究代表者 森實 千種(国立がん研究センター中央病院 肝胆膵内科)
臨床研究実施計画・研究概要公開システム
URL: https://jrct.niph.go.jp/latest-detail/jRCT2031230007(外部サイトにリンクします)
jRCT番号 jRCT2031230007
Perfume試験の実施医療機関
・国立がん研究センター中央病院
・国立がん研究センター東病院
・北海道大学病院
・東北大学病院
・京都大学医学部附属病院
・九州大学病院
研究資金
本試験は小野薬品工業株式会社から資金および薬剤の提供を受けて実施します。
(参考)2023年10月10日プレスリリース:「BRAF融合遺伝子陽性の低悪性度神経膠腫または膵がん患者を対象としたMEK阻害薬(ビニメチニブ)の全国6施設共同第2相医師主導治験開始」 https://www.ncc.go.jp/jp/information/pr_release/2023/1010/index.html
【TAZETTA試験】 (患者登録終了)
課題名 局所進行・再発類上皮肉腫に対するタゼメトスタットの第II相医師主導治験
治験実施計画書番号 NCCH2107/MK012
治験薬 タゼメトスタット(経口薬:EZH2阻害薬)
研究代表者 米盛 勧(国立がん研究センター中央病院 腫瘍内科)
臨床研究実施計画・研究概要公開システム
URL: https://jrct.mhlw.go.jp/latest-detail/jRCT2031220523(外部サイトにリンクします)
RCT番号 jRCT2031220523
研究資金 本試験はエーザイ株式会社から資金および薬剤の提供を受けて実施しています。
問い合わせ先
試験に関する問い合わせ先
国立研究開発法人 国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 臨床研究支援室
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室