2018/12/21 基礎生物学研究所,日本医療研究開発機構,ケンブリッジ大学
基礎生物学研究所 生殖細胞研究部門の北舘祐助教と吉田松生教授、英国ケンブリッジ大学のBenjamin Simons教授を中心とした国際共同研究グループは、マウスを用いて、精子を作る幹細胞の数が長い間一定に保たれる新しい仕組みを明らかにしました。
多細胞生物が組織を長い間安定して維持するためには、組織細胞を作るおおもとの「幹細胞」の数が一定に保たれることが大切です。一般に幹細胞は、「ニッチ」と呼ばれる特別な場所に集まっていて、その数はニッチに入ることができる上限によって決まると考えられています。しかしマウスの精子幹細胞は特定の場所に集まることはなく、精巣中に散らばって活発に動き回っています。精子幹細胞の数を保つ未知の仕組みがあるはずですが、謎に包まれていました。
本研究では、マウスの精巣にあるリンパ内皮細胞と呼ばれる細胞が、精子幹細胞の自己複製を促すFGF(線維芽細胞増殖因子)を作ることを見つけました。FGFの量を増減させた変異マウスや数理モデルを用いて解析した結果、実にシンプルな仕組みが明らかになりました。「精子幹細胞は、動き回りながらFGFを取り込んで消費する。FGFを多く取り込んだ精子幹細胞は自己複製して数を増やす一方、少ししか取り込めなかった精子幹細胞は分化して、幹細胞は減る。その結果限られた量のFGFをめぐる競合が生まれ、幹細胞の数はFGFの産生量に応じた一定の値に自ずと収束する。」というものです。この「自己複製因子の競合」という新たな原理の発見は、他の組織においても幹細胞の数を保つ仕組みの理解に貢献すると期待されます。
本研究成果は米国東部時間2018年12月20日にCell Stem Cell誌(電子版)に掲載されました。
【研究の背景】
ヒトを含むほ乳類は、数多くの精子を長期間作り続けます。この、次世代を残すために必須な営みを支えるのが「精子幹細胞」です。この細胞は、精子を作る(分化する)とともに、自分自身と同じ幹細胞を作る(自己複製する)ことができます。この時、精子幹細胞の数が一定になるよう、分化と自己複製のバランスが保たれていることが大切です。バランスが崩れると、幹細胞が枯渇したり、逆に異常に増えたりして、安定して精子を作ることができなくなってしまいます。
多くの組織が幹細胞によって維持されていることが知られていますが、マウス精子幹細胞と同様、その数は一定に保たれています。研究が進んでいるマウス小腸やショウジョウバエ生殖巣(卵巣や精巣)などの幹細胞は、「ニッチ」と呼ばれる、自己複製を促すシグナル分子が濃縮した特別な場所に集まっています。そのため幹細胞の数は、ニッチに入ることができる数の上限と等しくなります。しかし、ほ乳類の精巣ではこのような特別な場所は見つかりません。精子は「精細管」と呼ばれる管状の組織で作られますが、幹細胞は、自らが生み出した分化細胞の間を活発に動き回っています1)。さらに、幹細胞の増殖や分化を促すシグナル分子は特定の場所に限局せず、組織中に広く分布しています2),3)。そのため、「ニッチの物理的サイズが幹細胞の数を決める」という理屈は成り立ちません。このような組織にも幹細胞の数を一定に保つ仕組みがあるはずですが、それは謎に包まれていました。
【研究の成果】
本研究では、マウス精巣で精子幹細胞の数を一定に保つメカニズムの解明に取り組みました。吉田とSimonsらは、精子幹細胞が精細管のなかでも血管の近くを特に好んで動き回り、血管の近くでは幹細胞の数が多いことを発見していました1),4)。本研究グループは今回、血管の近くで多く作られるタンパク質を探索し、線維芽細胞増殖因子(FGF:具体的にはFGF5, FGF8, FGF4)を見つけました。FGFは、精細管を外から取り囲む細胞(リンパ内皮細胞)が作っていました。さらに、幹細胞がFGFを細胞内に取り込んで消費していることが分りました。FGFは精子幹細胞の増殖を促すシグナル分子として作用することが知られており、FGFを多く取り込んだ精子幹細胞は、自己複製しやすくなるとともに分化しにくくなります。FGFの産生量を増やしたり減らしたりしたマウスの精巣を解析したところ、FGFが作られる量と精子幹細胞の数は直線的に相関していました(図1)。
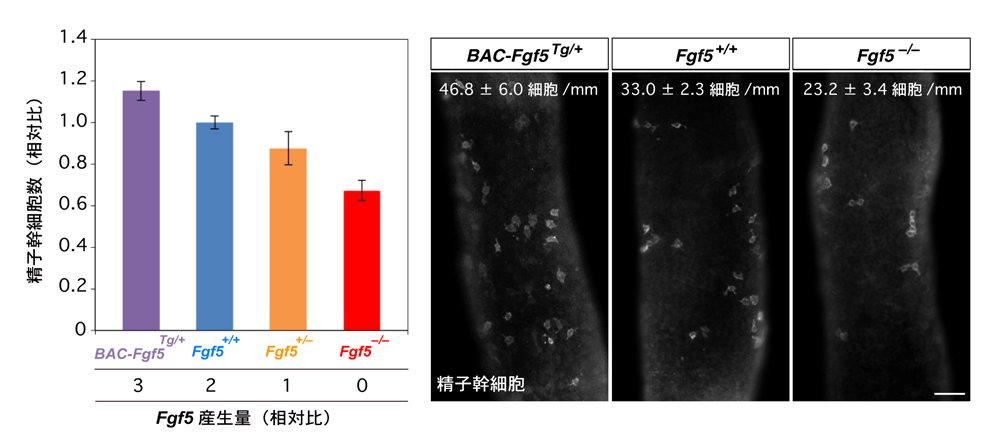 図1. FGFの産生量と幹細胞の数(密度=精細管長さあたりの数)の関係。
図1. FGFの産生量と幹細胞の数(密度=精細管長さあたりの数)の関係。
FGF の産生量を人工的に増やしたマウス(紫:BAC-Fgf5Tg/+)、通常のマウス(青:Fgf5+/+)、人工的に減らしたマウス(オレンジ:Fgf5+/-)、更に減らしたマウス(赤:Fgf5–/–)における、精子幹細胞の数。FGFの産生量と幹細胞数の間に直線的な相関関係があることがわかる。右はそれぞれのマウスの精細管の写真(幹細胞が白く染色されている)。
このような、精子幹細胞とFGFに関する発見をもとに、幹細胞の数が一定に保たれる仕組みを数理生物学的に解析しました。その結果、「常に一定量作られるFGFを精子幹細胞が取り込み、取り込んだFGF量に応じて自己複製と分化の確率が変わる」という極めてシンプルな原理によって、FGFの産生量と精子幹細胞数の直線的相関など多くの実験結果を定量的に説明できることが分かりました。とりわけ、精子幹細胞の数を強制的に減らした後の再生過程は興味深いものでした。薬剤を投与して精子幹細胞の一部を殺したところ、残った精子幹細胞は活発に分裂し、その数は通常の数を大きく超えました。この結果はニッチの物理的な大きさが幹細胞の数を決めるのではないことを明瞭に示しますが、その後も増加と減少を繰り返して次第に本来の数に収束していきました。精子幹細胞数に見られるこのような振動現象も、同じ数理モデルで見事に説明することができました(図2)。
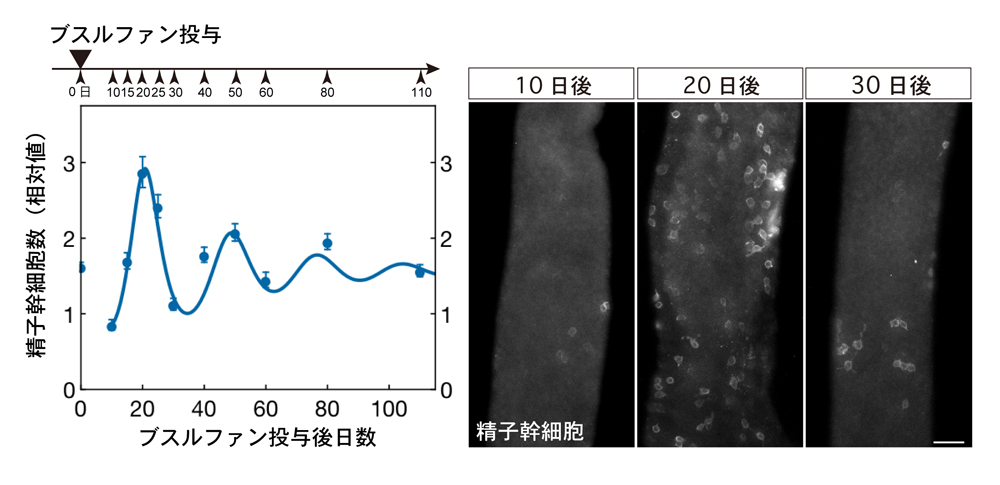 図2. 精子幹細胞の数を強制的に減らした後の再生過程に見られる幹細胞数の振動現象。
図2. 精子幹細胞の数を強制的に減らした後の再生過程に見られる幹細胞数の振動現象。
薬剤(ブスルファン)を投与して精子幹細胞の数を約1/3に減らすと、幹細胞数は振動しながら次第に本来の値に収束した(●)。これは、数理モデルによるシミュレーション(実線)とよく一致した。右は、ブスルファン投与後の精細管の写真(精子幹細胞が白く染色されている)。この振動現象は以下のように説明することができる。①精子幹細胞が減ると、FGFが消費されずに余る。②余ったFGFの作用で幹細胞が急速に増殖し、本来の値を超えて増加する。③幹細胞が増え過ぎると消費が過多となり、今度はFGFが枯渇する。④増えすぎた幹細胞は分化して幹細胞の数が減る。⑤これを繰り返して、幹細胞数は次第に一定の値に収束する。このように、「自己複製因子の競合」によって自然に生まれる負のフィードバックによって幹細胞の数は一定に保たれる。
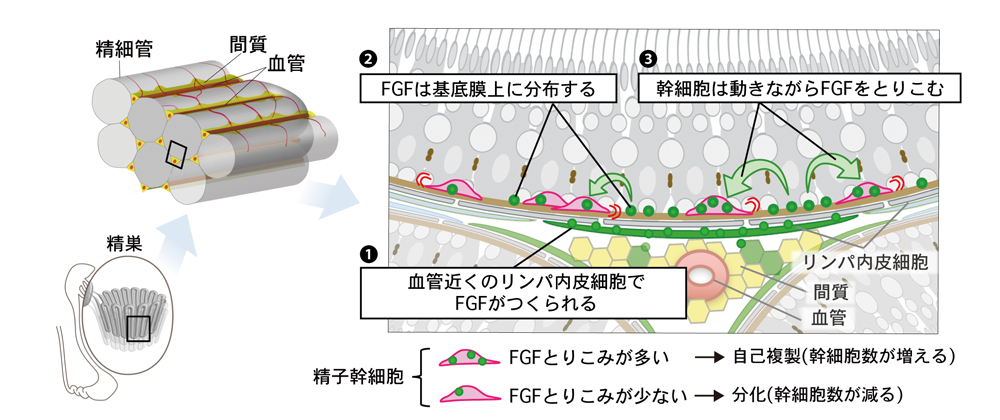
以上の結果、「精子幹細胞は、精細管の中を動き回りながら、リンパ内皮細胞の作るFGFをお互いに奪い合う。その結果、幹細胞の数はFGFの産生量に応じた決まった値に自ずと収束して、長期間維持される。」という、シンプルなメカニズムを新たに提唱しました(図3)。
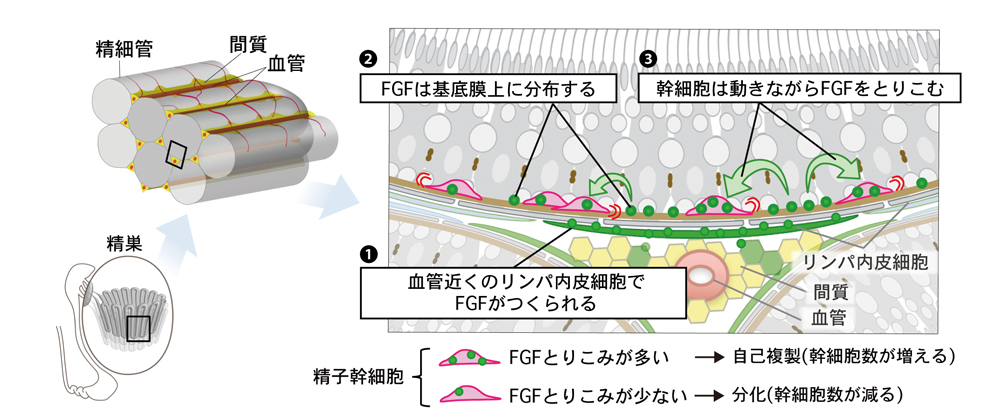 図3.マウス精巣で精子幹細胞の数が一定に保たれるメカニズム
図3.マウス精巣で精子幹細胞の数が一定に保たれるメカニズム
精子幹細胞は、血管の近くで精細管を取り囲むリンパ内皮細胞が産生したFGFを、動き回りながら取り込む。FGFを多く取り込んだ精子幹細胞は自己複製する一方、取り込みが少なかった精子幹細胞は分化する。その結果、精子幹細胞の数はFGFの産生量によって規定されることになり、血管の近くで幹細胞の数が多いことも自然に説明される。
【今後の展望】
本研究は、精子幹細胞が散らばっているマウス精巣において、幹細胞数を一定に保つ新規のメカニズム「幹細胞による自己複製因子(この場合はFGF)の競合」を見出しました。ほ乳類骨髄の造血幹細胞など、幹細胞が散らばっている例は他にも知られています。作用している分子は違っても、広く組織幹細胞が同じ原理で制御されている可能性が考えられます。
また、本研究が見出した精子幹細胞の制御メカニズムは、ゲノムに変異を持つ幹細胞の異常な増加や加齢に伴う幹細胞機能の低下など、次世代を残して遺伝情報を正しく伝える生殖細胞の本質を脅かす現象の基盤となっていると考えられます。これらの研究が進展し、不妊、腫瘍、遺伝性疾患などの理解と対策の向上につながることが期待されます。
1) 2014年05月02日付けプレスリリース http://www.nibb.ac.jp/press/2014/05/02.html
2) 2015年04月28日付けプレスリリース http://www.nibb.ac.jp/press/2015/04/28.html
3) 2017年02月10日付けプレスリリース http://www.nibb.ac.jp/press/2015/04/28.html
4) Science 317, 1772-1776 (2007)
【発表雑誌】
雑誌名 Cell Stem Cell
掲載日 米国東部時間2018年12月20日
論文タイトル:Competition for mitogens regulates spermatogenic stem cell homeostasis in an open niche
著者:Yu Kitadate, David J. Jörg, Moe Tokue, Ayumi Maruyama, Rie Ichikawa, Soken Tsuchiya, Eri Segi-Nishida, Toshinori Nakagawa, Aya Uchida, Chiharu Kimura-Yoshida, Seiya Mizuno, Fumihiro Sugiyama, Takuya Azami, Masatsugu Ema, Chiyo Noda, Satoru Kobayashi, Isao Matsuo, Yoshiakira Kanai, Takashi Nagasawa, Yukihiko Sugimoto, Satoru Takahashi, Benjamin D. Simons, Shosei Yoshida
DOI: 10.1016/j.stem.2018.11.013
【研究グループ】
基礎生物学研究所、ケンブリッジ大学、筑波大学、熊本大学、大阪大学、大阪母子医療センター、滋賀医科大学、東京大学、東京理科大学からなる国際共同研究。
【研究サポート】
本研究は、以下をはじめとする研究費の支援を受けて行われました。
文部科学省科学研究費補助事業(科研費)新学術領域研究
「配偶子制御」領域(課題名:マウス精巣におけるGSC/ニッチ・システムの解明)
「配偶子産生」領域(課題名:マウス配偶子産生におけるGSCの制御機構の解明)
「配偶子構築」領域(課題名:個体発生における生殖細胞集団のレパートリー動態の解明)
「血管と神経」領域(課題名:精子幹細胞ニッチと血管のワイヤリング)
「上皮管腔組織形成」領域(課題名:マウス精上皮管腔極性化機構の解明)
日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
「機能低下」領域(課題名:精子形成を支える幹細胞のホメオスタシスと機能低下)
【研究に関するお問い合わせ先】
基礎生物学研究所 生殖細胞研究部門
教授 吉田 松生 (ヨシダ ショウセイ)
【報道担当】
基礎生物学研究所 広報室
【AMEDに関するお問い合わせ先】
国立研究開発法人 日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
精子幹細胞の数を一定に保つ新たな仕組みを発見