2026-06-09 名古屋大学
<関連情報>
- https://www.nagoya-u.ac.jp/researchinfo/result/2026/02/post-940.html
- https://www.nagoya-u.ac.jp/researchinfo/result/upload_images/20260209_med_jp.pdf
- https://www.science.org/doi/10.1126/sciadv.adu5944
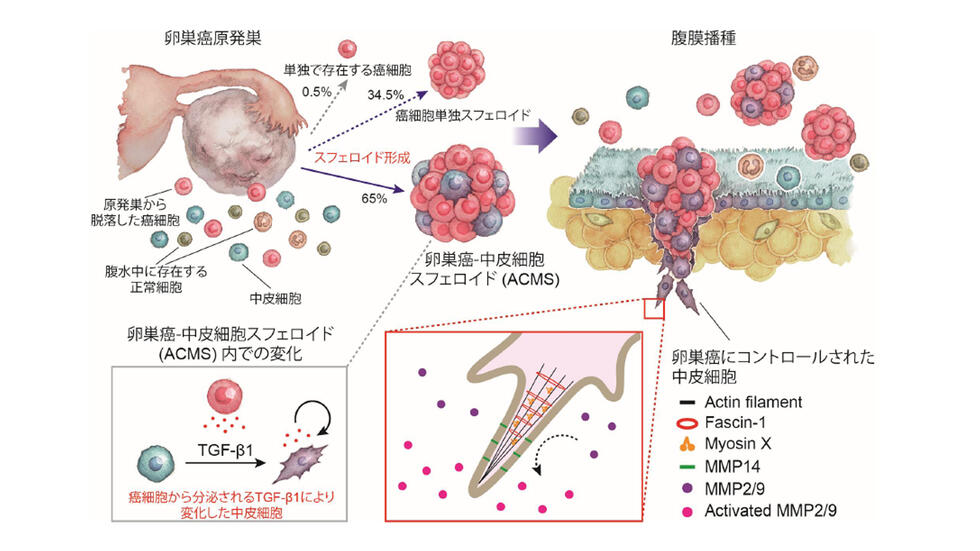
中皮細胞は、腹水由来卵巣癌細胞の腹膜浸潤および転移をスフェロイド形成を通じて促進する Mesothelial cells promote peritoneal invasion and metastasis of ascites-derived ovarian cancer cells through spheroid formation
Kaname Uno, Masato Yoshihara, Yoshihiko Yamakita, Kazuhisa Kitami, […] , and Hiroaki Kajiyama
Science Advances Published:6 Feb 2026
DOI:https://doi.org/10.1126/sciadv.adu5944
Abstract
Patients with epithelial ovarian cancer (EOC) are often diagnosed with peritoneal metastasis and ascites, the accumulation of intraperitoneal fluid containing nonmalignant cells. However, the interactions between EOC and nonmalignant cells before peritoneal metastasis remain unclear. To investigate this, whole EOC spheroids were observed using a multiphoton microscope, and their invasion ability was assessed. Mesothelial cells were identified as notable components of ascites through morphological assessment, immunohistochemical/immunofluorescence staining, and single-cell RNA sequencing analyses. Almost all EOC cells were spheroids, with 60% containing mesothelial cells. EOC cells quickly generate aggregated spheroids with mesothelial cells, and these aggregated cancer-mesothelial spheroids (ACMSs) invade collagen or mesothelial layers. Mesothelial cells forming ACMSs initiated the invasion. RNA sequencing analysis revealed marked RNA expression changes in mesothelial cells, whereas the changes in EOC cells were minor. Transforming growth factor–β1–stimulated mesothelial cells showed increased invadopodium formation along with fascin-1 up-regulation. These findings suggest that EOC cells alter mesothelial cells through ACMSs, thereby elucidating the rapid spread of EOC in the abdominal cavity.