2019-01-31 京都産業大学,青山学院大学,北海道大学,科学技術振興機構
ポイント
- 日・中・韓で多い原因不明の難治性脳血管疾患であるもやもや病の責任遺伝子としてミステリンを見いだしていたが、そのはたらきは不明であった。
- 今回、ミステリンが“脂肪代謝の制御因子”であることを突き止めたもやもや病は原因不明とされてきたが、“代謝バランスの異常”が鍵である可能性がある。
- 今回の発見は脂肪代謝の新たな制御メカニズムの発見でもある。
もやもや病は東アジア(日・中・韓)に多い脳血管疾患で、脳への主要な血液供給路である内頸動脈が、脳の下部で原因不明の狭窄・閉塞を起こし、血流障害や血液不足(虚血)による虚血発作・脳梗塞を引き起こす疾患です。発症は5歳前後の子供に多く、脳への血液供給不足による発達障害を合併する場合もあります。虚血に対する生体の自然な反応として、毛細血管の発達とそれによる血流の回復があり、もやもや病の場合にも頭蓋内にもやもやとした煙状の毛細血管が発達します(病名の由来)。しかし、この毛細血管が破れて脳出血を引き起こし、症状をさらに悪化させることがあります(脳出血の発症ピークは成人以後)。60年以上前に日本で見つかった疾患ですが、現在も原因不明であり、重篤な、また根治療法の確立されていない疾患であることから、「難病の患者に対する医療等に関する法律」(平成26年法律第50号)に基づき指定される指定難病の1つです。
もやもや病の遺伝的なリスク要因として新規遺伝子ミステリン(別名RNF213)の変異が同定されました。この変異によりもやもや病の罹患率は100倍以上、上昇します。京都産業大学 タンパク質動態研究所の永田 和宏 所長、森戸 大介 主任研究員(現 昭和大学 医学部講師)は、この遺伝子の生理機能および変異によって生じる病態機能を突き止めるため、ミステリン遺伝子の分子クローニングを初めて行い、その後も継続して機能解析を続けてきました。これまで、ミステリンの酵素活性や分子構造などを明らかにしてきましたが、今回、ミステリンが細胞内の脂肪貯蔵部位である“脂肪滴”に局在して、脂肪分解酵素から脂肪滴を保護し、細胞内の脂肪蓄積を増やすはたらきを持つ“脂肪代謝の制御因子”であることを突き止めました(青山学院大学、北海道大学との共同研究)。
脂肪は酸素呼吸により燃焼して生体内の重要なエネルギーとして用いられます。しかし、脂肪が過剰に蓄積した肥満状態が、動脈硬化や糖尿病を含む種々の生活習慣病を引き起こすことが知られています。これまでもやもや病患者において顕著な脂質代謝異常は見いだされておらず、もやもや病と脂質代謝の関係についてまったく着目されてきませんでした。しかし、今回の発見はもやもや病が代謝バランスの破たんによって引き起こされる疾患の一種である可能性を示唆しています。今後、代謝異常の観点からもやもや病発病プロセスの再検討を行うことが必要と考えられます。
本研究の成果は、米国東部時間2019年1月31日9時(日本時間2019年1月31日23時)に、細胞生物学の専門誌「The Journal of Cell Biology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長)
研究課題名:「小胞体恒常性維持機構:Redox,Ca2+,タンパク質品質管理のクロストーク」
研究代表者:永田 和宏(京都産業大学 総合生命科学部 教授/タンパク質動態研究所 所長)
研究期間:平成25年4月~平成31年3月
科学研究費補助金 基盤C
研究課題名:「モヤモヤ病タンパク質ミステリンの細胞内機能」
研究代表者:森戸 大介(京都産業大学 タンパク質動態研究所 主任研究員)
研究期間:平成27年4月~平成30年3月
<研究の背景>
もやもや病は東アジア(日・中・韓)に多い脳血管疾患で、脳への主要な血液供給路である内頸動脈が、脳の下部で原因不明の狭窄・閉塞を起こし、血流障害、血液不足(虚血)による虚血発作・脳梗塞を引き起こす疾患です。東アジア人種では約1万人に1人、白人では約10万人に1人が罹患する稀少疾患です。発症は5歳前後の子供に多く、脳への血液供給不足による発達障害を合併する場合もあります。虚血に対する生体の自然な反応として、毛細血管の発達とそれによる血流の回復があり、もやもや病の場合にも頭蓋内にもやもやとした煙状の毛細血管が発達し(病名の由来)、これにより血流がある程度、回復します。しかし、この毛細血管が破れて脳出血を引き起こし、症状をさらに悪化させることがあります(脳出血の発症ピークは成人以後)。主要な治療法は頭表部の血管(浅側頭動脈など)を頭蓋骨に開けた穴から頭蓋内の血管(中大脳動脈など)につないで血流を回復するバイパス手術ですが、再発により複数回の手術が必要になる場合があります。もやもや病は60年以上前に日本で見つかった疾患ですが、原因は現在も不明であり、重篤、また根治療法の確立されていない疾患であることから、「難病の患者に対する医療等に関する法律」(平成26年法律第50号)に基づき指定される指定難病の1つです。
東アジア人種に発症が偏っていること、また、一部の患者が家族発症歴を示すことから、遺伝要因の関与が疑われていました。東北大学(呉 繁夫 教授ら)を中心とした研究グループが孤発例に着目した遺伝解析を行い、また、京都大学(小泉 昭夫 教授ら)を中心とした研究グループが家族例に着目した遺伝解析を行い、17番染色体上に同一の遺伝子変異を見いだしました。この変異は新規遺伝子ミステリン(別名RNF213)の内部にあったことから、京都大学グループとの共同研究として、京都産業大学 タンパク質動態研究所の永田 和宏 教授、森戸 大介 主任研究員らが初めての分子クローニングを行い(2011年)、遺伝子ミステリンの生理機能探索および変異による病態機能探索を開始ました。
これまで永田教授、森戸主任研究員らはミステリン遺伝子にコードされるミステリンタンパク質が巨大な細胞内タンパク質であり、ATP加水分解活性や物理運動活性、ユビキチンリガーゼ活性を示すことなどを解明してきました(2014年、2015年、2017年)。しかし、この因子がこれらの酵素活性を使って細胞内で何をするのかは不明でした。また、もやもや病変異により、どのような機能異常が起こるのかも明らかになっていませんでした。今回、高解像度の共焦点レーザー顕微鏡観察を端緒として、ミステリンが脂肪滴と呼ばれる構造に集積して、脂肪代謝の制御因子としてはたらくことを突き止めました。
<研究の内容と成果>
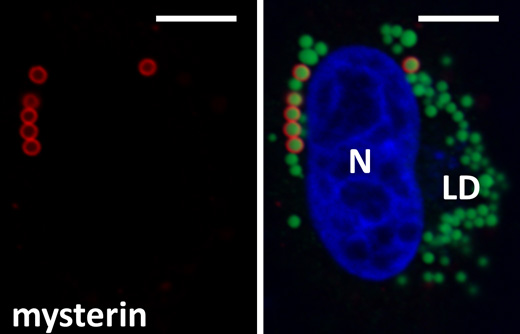
ミステリンタンパク質の細胞内局在を高解像度の共焦点レーザー顕微鏡により観察したところ、直径1μm(マイクロメーター:1mmの1000分の1)程度の球状構造を形成することが分かりました(図1)。この構造を調べたところ、球状構造の内側には中性脂肪が蓄積していることが分かりました。すなわちこの構造体は、脂肪滴と呼ばれる細胞内の脂肪貯蔵サイトでした。
生体のエネルギー源は主に糖と脂肪の2種類が知られています。脂肪は水に溶けないため脂肪滴と呼ばれる構造を細胞内に形成して貯蔵されます。脂肪滴の主成分である中性脂肪は必要に応じて分解されて脂肪酸になり、ミトコンドリアでの酸化的代謝経路(酸素呼吸)によりエネルギー産生に用いられます。この脂肪が過剰に蓄積した状態が肥満で、種々の生活疾患病を引き起こします。脂肪滴の表面には脂肪合成酵素や脂肪分解酵素が付着し、ダイナミックに脂肪の出し入れ(合成と分解)を行っています。ミステリンが脂肪滴上に局在していたことから、脂肪代謝と関係しているのではないかと考え、検討を行ったところ、ミステリンがある状態では脂肪滴の数が増え、ミステリンがない状態では脂肪滴が細胞内から消失してしまいました。すなわちミステリンは脂肪蓄積を促進する方向にはたらく代謝制御因子であると思われました。
ミステリンが脂肪滴を増やすメカニズムについて解析したところ、脂肪滴表面の主要な脂肪分解酵素ATGLがミステリンにより脂肪滴から排除されていることが分かりました。ミステリンには、脂肪分解酵素が脂肪滴と結合できなくすることで、脂肪分解を止めるはたらきがあることが分かりました。さらに、ミステリンのATP加水分解酵素活性を破壊すると、ミステリンは脂肪滴へ局在することができなくなることも分かりました。リアルタイム蛍光観察データや、以前に解明したミステリンのATPアーゼサイクル型複合体形成メカニズムと合わせて、ミステリンはATPアーゼサイクルと連動して脂肪滴に局在していることが推測されました(図2)。
もやもや病を引き起こす変異には2種類あることが知られています。東アジア人のもやもや病患者が持つR4810K変異と、近年、白人のもやもや病患者で見つかったユビキチンリガーゼ変異(白人変異)です。まず、R4810K変異によるミステリンの機能異常について調べたところ、意外にも、変異による機能異常はまったく検出できませんでした。次に、白人変異による異常を調べたところ、白人変異が入ることにより、ミステリンは脂肪滴に局在できなくなり、異常なタンパク質のかたまり(凝集)を形成することが分かりました。ここで観察された2つの現象(脂肪滴からの脱落と凝集塊の形成)のうちどちらか、もしくは両方がもやもや病の原因であると思われました。
東アジア人のもやもや病変異の保因者は、約100~300人に1人がもやもや病に罹患することが知られています。この割合は非保因者の罹患率が約10万人に1人であるのに比べて100倍以上高く、重要なリスク因子であることは間違いありません。一方で白人のもやもや病変異の保因者は、全員がもやもや病を発症していました。これらのデータから、東アジア人変異は追加の環境要因(例えば、生活習慣の偏りや感染、炎症など)または遺伝要因があった場合に初めて効果を発揮する感受性変異であると考えられています。これに対して、白人変異は、それのみで著明な細胞異常を引き起こす原因変異であると考えられます。このような病因としての効果の違いが、細胞レベルでのふるまいの違いになったものと考えられます。
<今後の展開>
東アジア人のもやもや病と白人のもやもや病は、疾患として同一あるいは非常に似通ったものであると考えられています。おそらく、東アジア人のもやもや病変異は通常の条件下では白人のもやもや病変異で見られた分子異常、細胞異常を引き起こしませんが、追加要因のある場合に、白人のもやもや病変異と同様のミステリン機能異常(局在異常や凝集形成)を引き起こすものと考えられます。
今後、2つの異常(ミステリンの脂肪滴からの脱落と凝集形成)のそれぞれがもやもや病発病プロセスにどう関わるのか、また、東アジア人変異においては、どのような条件下で白人のもやもや病変異と同一の異常を引き起こすのかについて、培養細胞、マウスを用いた同定が必要です。また、もやもや病患者から得られた病理サンプルの再検討や、代謝データの収集・再検討も必要と思われます。今回、もやもや病の責任遺伝子が意外にも脂肪代謝の制御因子であることが明らかになりました。この発見を機に、これらの解析を進めることで、近い将来にもやもや病発病プロセスの全貌が明らかになることが期待でき、さらに根治療法確立への大きなヒントが得られるものと考えられます。
また、今回の発見は脂肪代謝の新たな因子の発見でもあり、今後、この因子ミステリンの機能をさらに解明することにより、各種の脂質代謝異常(肥満、動脈硬化、糖尿病など)の解決につながる可能性があります。
<参考図>
![]()
図1 ミステリンは細胞内に直径1μmの球状構造を形成する
ヒト子宮がん由来HeLa細胞を用いた染色。左図と右図は同一の視野の特定の染色シグナルだけを抜き出している(左図:赤、右図:赤、青、緑)。赤色はミステリン、青色は細胞核(N)、緑色は脂肪滴の中性脂肪(LD)を示す。右上の白線は5μmを示す。ミステリンが直径1μmの脂肪滴を密に取り囲んでいるのが分かる。画像は共焦点レーザー顕微鏡を用いて撮影しているので、細胞の水平断面として視覚化している。実際にはミステリンは円を形成するのではなく球を形成している。
![]()
図2 データから予想されるミステリンのサイクル型脂肪滴局在
ミステリン(青紫)は通常、1分子の状態で細胞内に浮遊している。ATPと結合した状態で、脂肪滴(LD)の表面に移動して、推定6分子のドーナツ状複合体を形成する。この状態でATPを加水分解して、化学エネルギーを物理エネルギーに変換し、何らかの機械的な運動をした後、脂肪滴から遊離して1分子状態に戻ると考えられる(ATPアーゼサイクル型複合体形成)。ミステリンが脂肪滴上で実際にどのような機械運動をしているのか不明だが、結果として、脂肪分解酵素ATGLが脂肪滴上に存在できないような環境を作り出すらしい。
<論文情報>
タイトル:“The AAA+ ATPase/ubiquitin ligase mysterin stabilizes cytoplasmic lipid droplets”
(AAA+型ATP加水分解酵素でありユビキチンリガーゼでもあるミステリンは細胞内の脂肪滴を安定化する)
著者名:Munechika Sugihara, Daisuke Morito, Shiori Ainuki, Yoshinobu Hirano, Kazutoyo Ogino, Akira Kitamura, Hiromi Hirata, and Kazuhiro Nagata
<お問い合わせ先>
<研究に関すること>
森戸 大介(モリト ダイスケ)
昭和大学 医学部 生化学教室 講師
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
<報道担当>
京都産業大学 広報部
科学技術振興機構 広報課