2019-02-07 甲南大学,日本医療研究開発機構
研究チームはシンプルな動物である線虫C. エレガンス注1)の低温馴化注2)を解析してきました。今回、ヒトにおいて心臓病や”てんかん”に関わるカリウムチャネル注3)に相当する線虫のカリウムチャネル(KQT-2)の変異体が、低温馴化に異常を示しました。予想外なことに、KQT-2の変異体の低温馴化異常は、「飼育空間の大きさ」に影響されることが分かりました。この空間依存的な低温馴化に関わる細胞として、頭部の1対のADL注4)と呼ばれる温度受容ニューロンがKQT-2を介して低温馴化を調節していました。
ADLは、体内の酸素濃度を感知する酸素受容ニューロン(URX注5))と神経回路を作っていました。さらに、URXの酸素受容体で受け取られた酸素濃度の情報がADL温度受容ニューロンを調節していることが分かりました。
これらのことから、環境の酸素濃度が酸素受容ニューロンを介して、温度受容ニューロンを調節し、体の低温馴化を変化させることが示唆されました。
本研究から、温度と酸素という質的に異なる2つの情報の統合に関わる神経回路が明らかになりました。この神経回路は、情報の統合や識別に関わる神経機構の解析モデルになると期待しています。
ヒトと線虫で共通する生体調節メカニズムが多数見つかっていることから、線虫のKQT-2に相当するヒトのKCNQも体の低温適応に関与する可能性が考えられ、ヒトの温度適応の仕組みや、温度による健康障害の原因解明などに役立つと期待されます。
本研究成果は、米国東部標準時2019年2月6日14時(日本時間:2月7日4時)に、米科学誌「Science Advances(サイエンス アドバンシス)」のオンライン版で公開されます。
研究の背景と経緯
例えば、ヒトの体は約37兆個の細胞で構成されており、生体調節の中枢である脳は、約1000億個の神経細胞で構成されています。そのため、その細胞間ネットワークは非常に複雑で、ヒトの生体内の情報処理を解析する大きなハードルになっています。
本研究チームは、959個の細胞からなるシンプルなモデル実験動物である線虫「C.エレガンス」を使い、温度適応メカニズムの解明を目指してきました。これまでに、低温耐性現象(図1)の解析から、低温耐性に関わる分子と組織ネットワークが少しずつ見つかってきました。具体的には、頭部に1対ずつ存在するASJと ADLと呼ばれる感覚ニューロンがそれぞれ温度を受容する温度受容ニューロンであること(図2)、ASJからインスリンが分泌され、腸がインスリンを受容することによって体内の脂肪酸構成比を変化させ、低温耐性が制御されることを発見しました(図2)(Ohta et al., Nature commun, 2014; Ujisawa., PNAS, 2018)。さらに、腸から精子に情報が伝達され、精子が頭部の温度受容ニューロンをフィードバック制御することを突き止めました(図2)(Sonoda et al., Cell reports, 2016)。
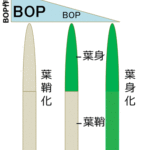
さらに、飼育温度をわずか数時間変えることで、線虫が低温耐性を獲得したり消失したりするという、低温馴化(温度馴化)が見つかりました(図1)。しかし、低温馴化の分子メカニズムには未知な点が多く残されていました。
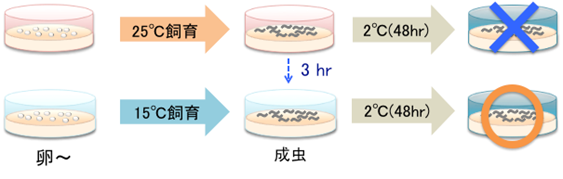
図1.線虫の低温耐性・馴化
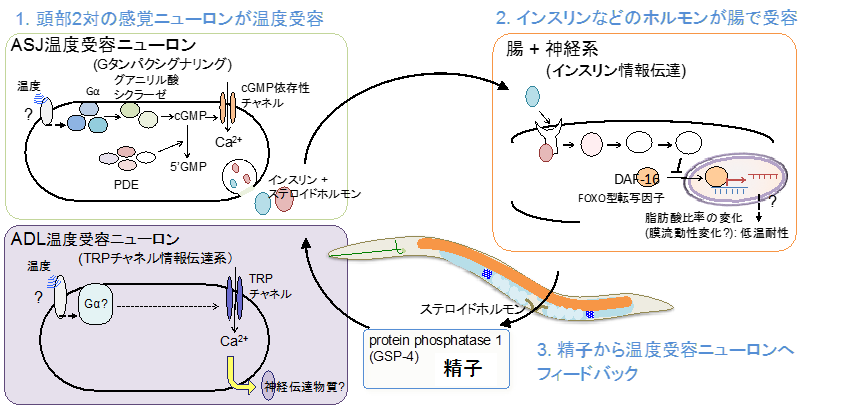
図2.既知の低温適応の生体ネットワーク
研究の内容
カリウムチャネルKQT-2は空間依存的な低温馴化に関わる
低温馴化に関わる新しい遺伝子を見つけるために、ヒトにおいて、てんかんや心臓病などの原因遺伝子として知られているカリウムチャネルに着目し、それに相当する線虫のカリウムチャネルであるKQT-2を解析しました。
KQT-2が欠損した変異体線虫(kqt-2変異体)は、25℃で飼育後に15℃に3時間置き、2℃の低温刺激を与えると野生株に比べて高い生存率を示す異常がみられました。さらに興味深いことに、このkqt-2変異体の低温馴化異常は大きなシャーレで飼育した場合により異常が強くなることが分かりました。つまり、温度以外の別の環境因子が低温馴化に影響を与えることが示唆されました(図3)。

図3.kqt-2変異体の飼育プレートの大きさによる低温馴化の違い
カリウムチャネルKQT-2は温度受容ニューロンの活動を正に制御
kqt-2変異体の低温馴化の異常は、頭部のADL温度受容ニューロンでkqt-2遺伝子を発現させることで回復しました。そこで、カルシウムイメージング法注6)という光技術で、kqt-2変異体のADL温度受容ニューロンの温度変化に対する神経活動の変化を調べました。一般的にカリウムチャネルは神経活動を抑制することが知られているため、カリウムチャネルを欠損させた変異体では神経活動が上昇する異常が見られます。しかし予想外にも、kqt-2変異体のADLの神経活動は低下していました。そのため、KQT-2は、他のKQT型カリウムチャネルと複合体を形成して、複合体チャネルを抑制的に制御している可能性を考え、ADL温度受容ニューロンで発現している他のKQT型カリウムチャネルであるKQT-3を調べました。
カルシウムイメージング解析から、kqt-3変異体のADL温度受容ニューロンの神経活動は野生株に比べて上昇していました。さらに、kqt-2変異体のADLの神経活動の低下は、kqt-2変異体にkqt-3変異を導入することで抑えられました。つまり、KQT-2がKQT-3を抑制することでADL温度受容ニューロンのチャネルの開閉が調節され、低温馴化が制御されることが分かりました(図4)。
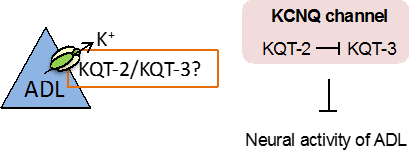
図4.KQT型カリウムチャネルによるADLニューロンの活性調節
酸素受容ニューロンは温度受容ニューロンと神経回路を作り低温馴化を調節
KQT型カリウムチャネルが機能するADL温度受容ニューロンは、体内の酸素濃度を感知する一対の「酸素受容ニューロン」であるURXと局所的な神経回路を作っていました。そこで、URX酸素受容ニューロンの酸素受容体であるGCY-35の変異体の低温馴化を調べたところ、低温馴化が低下していました。さらに、gcy-35変異をカリウムチャネルkqt-2変異体に導入すると、kqt-2変異体が示す低温馴化異常とADL温度受容ニューロンの温度刺激に対する神経活動の低下が回復しました(図5)。
つまり、環境における「酸素濃度」と「温度情報」がADLニューロンで統合され、低温馴化が制御されていることが分かりました。
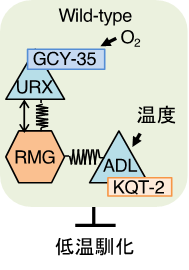
図5.酸素濃度と温度情報の神経回路モデル
URXによって受容された酸素情報とADLが受容した温度情報がADLニューロン内で情報統合されることによって低温馴化が決定される。
今後の展開
ヒトを含む高等動物の脳・神経系においても、1つのニューロン内において複数の神経情報が統合処理されています。そのため、今回見つかった神経回路の解析を進めることで、どのようにニューロン内で複数の神経情報が統合処理されるかという、脳神経系の基本的なメカニズムの解明に繋がると期待しています。
また、線虫のKQT-2に相当するヒトのKCNQについて、温度適応との関連性は報告されていません。そのため今後、ヒトのKCNQについても温度適応という観点から研究が行われる可能性が期待されます。
研究支援
用語解説
- 注1)C.エレガンス
- 土壌に生息する非寄生性の線虫で、正式名称はカエノラブディティス・エレガンス。古くから分子遺伝学的解析に使用されている。1998年には多細胞生物で初めて全ゲノムDNAの解読が終了した。ヒトの遺伝子数と同等に約2万個の遺伝子を持ち、類似の遺伝子も多い。
- 注2)低温馴化
- 動植物が寒い季節を乗り越える際に、秋の低くなってきた温度を感じ取り、到来する冬にむけて生体内での準備を行う現象。
- 注3)カリウムチャネル
- 神経細胞を含むほとんどの細胞の細胞膜に埋め込まれており、細胞膜を貫通させる穴を作っている、主に細胞内のカリウムイオンだけを細胞外に排出させる役割を持っている。
- 注4)ADL(温度受容ニューロン)
- 線虫C. elegansの頭部に左右一対だけ存在し、環境の感覚情報を受け取る感覚ニューロンである。線虫にとって嫌な匂いやフェロモンを感じることができる。最近、このニューロンが温度を感じる温度受容ニューロンであることが分かってきた。
- 注5)URX(酸素受容ニューロン)
- 線虫C. elegansの頭部に左右一対だけ存在し、体内を循環する体液の酸素に反応するニューロンである。このニューロンの中には酸素を受け取る酸素受容体があり、その働きにより酸素濃度に応じた神経活動の変化を引き起こすことができる。
- 注6)カルシウムイメージング法
- カルシウムイオンはニューロンの働きに重要な役割を果たす。細胞内のカルシウム濃度の変動を色の変化として見る方法のことを指す。本研究では、カルシウムイオンと結合し、カルシウムの濃度により色が変わる蛍光タンパク質を細胞に導入した。
論文情報
- 掲載論文名
- “Cold acclimation via the KQT-2 potassium channel is modulated by oxygen in Caenorhabditis elegans”
(C. elegans においてカリウムチャネルKQT-2を介した低温馴化は酸素によって調節される)
Science Advances,5,eaav3631,2019
DOI:10.1126/sciadv.aav3631 - 発表者
- 岡畑 美咲(オカハタ ミサキ)(甲南大学大学院自然科学研究科 博士後期課程生、日本学術振興会特別研究員DC)
- Aguan D. Wei(Center for Integrative Brain Research, Seattle Children’s Research Institute)
- *太田 茜(オオタ アカネ)(日本学術振興会特別研究員PD、甲南大学特別研究員)
- *久原 篤(クハラ アツシ)(甲南大学理工学部/大学院自然科学研究科/統合ニューロバイオロジー研究所、教授)
- *責任著者
お問い合わせ先
本研究内容に関すること
久原 篤(クハラ アツシ)(本研究論文の責任著者)
甲南大学 理工学部 教授
太田 茜(オオタ アカネ)(本研究論文の責任著者)
日本学術振興会 特別研究員PD/甲南大学特別研究員
岡畑 美咲(オカハタ ミサキ)(本研究論文の筆頭著者)
日本学術振興会 特別研究員DC/甲南大学大学院自然科学研究科博士後期課程生
広報に関すること
甲南学園 広報部
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課