力学刺激によって生じるツメガエル胚細胞内のリン酸化の変化の詳細が明らかに
2019-03-07 基礎生物学研究所
基礎生物学研究所の橋本寛研究員、木下典行准教授、上野直人教授および米国プリンストン大学のIleana Cristea教授らは共同で、「リン酸化プロテオーム」をいう方法を用いて、アフリカツメガエルの初期胚に力をかけた時に、細胞内でどのような応答が起きているのかの詳細を網羅的に明らかにしました。そして、いくつかのタンパク質リン酸化酵素(プロテイン・キナーゼ)が力学刺激に応じて素早く活性化されるとともに、細胞の接着斑およびタイトジャンクションと呼ばれる構造を構成するタンパク質のリン酸化レベルが増加することが明らかになりました。また、力学刺激を受けた細胞・組織は構造的に強固で安定的な上皮様組織へと変化することもわかりました。この成果は2019年3月6日付でCell System誌に掲載されました。
【研究の背景】
人を含めた生物はさまざまな力に晒されています。例えば重力もそのひとつです。重力のように生物を取り巻く環境としての力に加えて、体の中でもさまざまな力が発生しています。血管の中を粘性が高い血液が流れると、血管の壁に対して「ずり応力」が生じます。また、心臓などの臓器の運動によってある組織が引っ張られ、押されたりすることによって、「牽引力」や「圧縮力」といった力が生じます。最近、この物理的な力が生物の受精卵が成長する発生過程で重要な役割を担っていることが明らかになりつつあります。初期胚では細胞集団が移動して大きく位置を変えます。その際に、こうした牽引力や圧縮力が周囲の組織にも力の影響を及ぼし、その性質を変化させ、発生が正常に進むことを可能にすると考えられています。また、さまざまな細胞に分化する多分化能をもった間葉系幹細胞は、培養する際の足場となる基質の硬さによって、脳、筋肉、骨など異なる組織に分化することも知られています。この数十年間の分子生物学の進歩によって多くの発生調節機構が遺伝子やタンパク質の働きとして理解されるようになってきましたが、加えて、この物理的な力も発生制御機構に必須の役割を果たす要因として注目されるようになってきました。これは力という物理量を考慮した新しい生物学の夜明けとも言えるでしょう。
力による刺激を受けた細胞はそのシグナルを変換し、細胞の変形や運動など細胞内の遺伝子やタンパク質を変化させ、その結果として細胞の性質の変化に結びつける必要があります。つまり、物理シグナル(力)を化学シグナルに変換しているのです。しかしながら、力応答のシグナルの全容については不明なままでした。
【本研究の成果】
今回、基礎生物学研究所形態形成研究部門の橋本寛研究員、木下典行准教授、上野直人教授らは米国プリンストン大学のIleana Cristea教授の研究グループとの共同研究で、細胞が力に対してどのように応答するのかを質量分析という方法を用いて詳細に解析し、その力応答の過程で生じる細胞内の状態の変化の詳細を明らかにしました。研究材料には大きさが1ミリほどのアフリカツメガエルの初期胚(原腸形成期)をもちい、それを遠心力で弱く圧縮しました。胚は力を受けて一時的に変形しますが、遠心を止めるともとの球形にもどります。それぞれ、0分、10分、30分、60分間遠心し、その直後に胚全体からタンパク質を抽出し、質量分析装置をもちいてタンパク質のリン酸化を網羅的に同定する「リン酸化プロテオーム」という手法により解析しました。
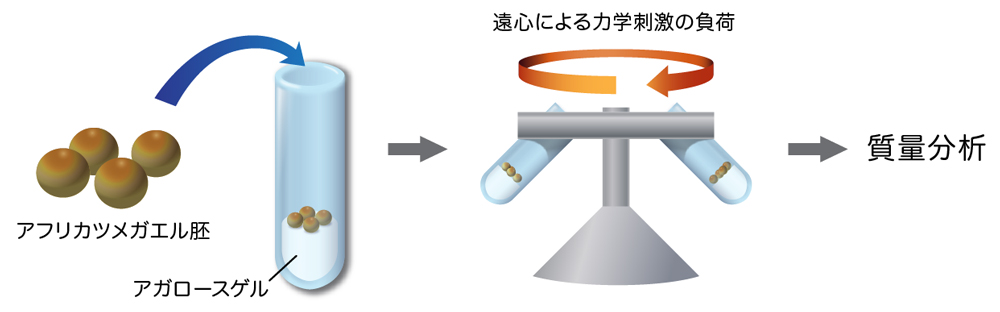
図1:アフリカツメガエル胚への力学刺激負荷
アフリカツメガエルの原腸胚を遠心(450 xg)し、細胞を破砕、タンパク質を抽出後、質量分析でタンパク質のリン酸化を検出した。
本研究では9千以上ものリン酸化ペプチドを解析することにより、遠心という力学刺激が化学シグナルに変換される細胞応答の詳細を明らかにしました。まず、力学刺激をかけると、細胞接着に関与するタンパク質群の大規模なリン酸化が見られました。またそのリン酸化を担う酵素群についても、時系列動態がリン酸化酵素群により異なることを発見しました。これは、異なるリン酸化酵素がその時系列で異なる活性化をしていることを示唆しています。加えて、リン酸化に伴い、細胞間の隙間を塞ぐタイトジャンクション(密着結合)にはZO-1というタンパク質が、力学刺激依存的に集積することが明らかになりました。このような応答は、遠心による力学刺激ばかりでなく、圧縮刺激でもみられることが確認されました。さらに、こうしたリン酸化状態やタンパク質量変化の全体像をとらえることによって、力学刺激を受けた細胞・組織は、より運動能は低いものの構造的には強固で安定的な上皮様組織へと転換する「間充織-上皮転換(MET)」様の変化を起こすことも明らかになりました。これらの知見は、生物は力という外的刺激に応答し、変形という生物個体の変化に抗い、正常な形態や機能を保とうとする巧妙な仕組みをもっていることを示しています。加えて、上皮性がんではMETとは逆の「上皮-間充織転換(EMT)」が起こり、上皮細胞が運動能の高い間葉系細胞に転換することが浸潤のひとつのメカニズムとされていますが、今回の発見は力がその転換調節に関わっていることを示唆するもので、今後がん医療への貢献も期待できるかもしれません。本研究成果は、2019年3月6日付でCell System誌に掲載されます。

図2:力学刺激後に起こった細胞の変化
タイトジャンクション(密着結合)を構成するタンパク質ZO-1の局在が変化し、結合が強化された。これは運動能の高い間充織細胞が上皮細胞様に変化した時に見られる間充織-上皮転換(MET)様の変化が起こったことを示している。
【論文情報】
Cell System誌 2019年3月6日付 オンライン先行掲載
論文タイトル:Mechanical Force Induces Phosphorylation-Mediated Signaling that Underlies Tissue Response and Robustness in Xenopus Embryos
著者:Yutaka Hashimoto, Noriyuki Kinoshita, Todd M. Greco, Joel D. Federspiel, Pierre M. Jean Beltran, Naoto Ueno, and Ileana M. Cristea
DOI: https://doi.org/10.1016/j.cels.2019.01.006
【研究グループ】
基礎生物学研究所の橋本寛研究員、木下典行准教授、上野直人教授および米国プリンストン大学のIleana Cristea教授の共同研究として実施されました。
【研究サポート】
本研究は文部科学省科学研究費補助事業のサポートを受けて実施されました(22127007, 15H05865)。本国際共同研究は自然科学研究機構の戦略的国際交流加速事業(平成28-30年度)によって橋本研究員がプリンストン大学に派遣され実施されました。
【本研究に関するお問い合わせ先】
基礎生物学研究所 形態形成研究部門
教授 上野 直人(ウエノ ナオト)
【報道担当】
基礎生物学研究所 広報室

