NF-κBシグナル伝達経路がM細胞の分化を制御する
2018-01-16 理化学研究所
要旨
理化学研究所(理研)統合生命医科学研究センター粘膜システム研究グループの金谷高史研究員と大野博司グループディレクターらの国際共同研究グループ※は、腸管内の抗原を取り込んで免疫応答を発動する「M細胞[1]」の分化が、「NF-κBシグナル伝達経路[2]」によって制御されることを発見しました。
腸の粘膜は、食物や食物とともに摂取される外来微生物、40兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。これらの中には病原性を持つものが含まれていることから、腸管には免疫細胞が集まったパイエル板[3]などの腸管免疫組織が発達しています。腸管粘膜は腸管上皮細胞から構成されており、その中で腸管免疫組織を覆う部分は、濾胞随伴上皮細胞層(FAE)[4]と呼ばれています。FAEには腸管内の微生物を取り込み、腸管免疫組織に受け渡して免疫応答を発動するM細胞が分布しています。M細胞の分化は、FAEの直下に分布する間質細胞[5]から産生されるRANKL[6]というタンパク質によって誘導されます。金谷研究員らは2012年に、転写因子Spi-B[7]がM細胞の成熟分化に必須であることを発見しました注1)。しかし、Spi-B以外にどのような分子がM細胞分化に関与しているのか分かっていませんでした。
今回、国際共同研究グループは、RANKLによってNF-κBシグナル伝達経路が活性化されることに着目し、このシグナル伝達経路のM細胞分化における役割を調べました。その結果、M細胞の分化がTRAF6[8]というタンパク質を介したNF-κBシグナル伝達経路によって制御されていることが明らかとなりました。
本成果は、M細胞分化の分子メカニズムの一端を解明しました。今後、この発見をもとにin vitro(試験管内)でM細胞を扱うことが容易になり、M細胞の性質の理解が進むものと期待できます。
本研究は、米国の科学雑誌『Journal of Experimental Medicine』に掲載されるのに先立ち、オンライン版(1月16 日付け)に掲載されます。
注1)2012年6月18日プレスリリース「腸管内の抗原取り組み口「M細胞」の分化に必須な転写因子を発見」
※共同研究グループ
理化学研究所 統合生命医科学研究センター
粘膜システム研究グループ
グループディレクター 大野 博司 (おおの ひろし)(横浜市立大学大学院 生命医科学研究科 大学院客員教授)
研究員 金谷 高史 (かなや たかし)(横浜市立大学大学院 生命医科学研究科 大学院客員研究員)
テクニカルスタッフⅡ 榊原 小百合(さかきばら さゆり)
テクニカルスタッフⅡ 橘 直子 (たちばな なおこ)
研修生(研究当時) 陣野原 俊 (じんのはら とし)(横浜市立大学大学院 生命医科学研究科 大学院生)
研修生(研究当時) 蜂須賀 雅美(はちすか まさみ)(横浜市立大学大学院 生命医科学研究科 大学院生)
免疫恒常性研究リーム
チームリーダー 秋山 泰身 (あきやま たいしん)
大分大学 医学部 感染予防医学講座
教授 小林 隆志 (こばやし たかし)
助教 飛驒野 真也(ひだの しんや)
慶應義塾大学 医学部 消化器内科
准教授 佐藤 俊朗 (さとう としろう)
北海道大学 医学研究院 解剖学分野 組織細胞学教室
教授 岩永 敏彦 (いわなが としひこ)
助教 木村 俊介 (きむら しゅんすけ)
千葉大学 医学部 消化器内科
教授 加藤 直也 (かとう なおや)
准教授 勝野 達郎 (かつの たつろう)
助教 中川 倫夫 (なかがわ ともお)
エモリー大学
教授 イフォー・ウイリアムズ(Ifor Williams)
背景
体内と外界の境界は、皮膚と粘膜で分けられています。体表面を形成する皮膚は、重層する表皮細胞と角質層で比較的堅牢な防壁となっています。一方、体の内側にある粘膜の多くは、単層の細胞だけで覆われています。特に腸管粘膜は、栄養や水分の吸収効率を高めるため、広い表面積を持ち、食物や食物とともに侵入する外来微生物、さらには40兆個もの腸内細菌といった異物(抗原)に常にさらされています。
したがって腸管粘膜は、多くの感染症における病原性微生物の初期侵入経路でもあり、感染から個体を守る最前線と考えられます。そのため、腸管にはパイエル板に代表される腸管免疫組織が発達しています。腸管免疫組織は、腸管内腔から腸管粘膜を介して直接抗原の供給を受け、免疫応答を発動させます。腸管粘膜は腸管上皮細胞という細胞で構成されており、その中で腸管免疫組織を覆う部分は、濾胞随伴上皮細胞層(FAE)と呼ばれています。FAEには「M細胞」が存在し、腸管内の微生物を取り込み、腸管免疫組織に分布する樹状細胞などの免疫細胞に受け渡します(図1)。この結果、取り込まれた微生物に対して特異的な免疫応答が発動されることから、M細胞は腸管免疫応答を発動するための開始点として重要です。
M細胞は腸管上皮細胞の一種であり、腸管上皮幹細胞がFAEの直下に分布する間質細胞から産生されるRANKLというタンパク質の刺激を受けることによって分化します。金谷研究員らは2012年に、転写因子Spi-BがM細胞の成熟分化に必須であることを発見しました。しかし、Spi-B以外にどのような分子がM細胞分化に関与しているのか十分に分かっていませんでした。
研究手法と成果
国際共同研究グループは、M細胞分化に重要な役割を果たす分子を明らかにするため、オルガノイド培養[9]でM細胞を誘導し培養しました。オルガノイドには腸管上皮幹細胞を含む未分化な細胞が含まれているため、RANKLで刺激することでオルガノイドにM細胞を誘導することができます(図2)。
RANKLは、その受容体であるRANKに結合し、「NF-κBシグナル伝達経路」の古典経路[2]を介してp50/RelAを、非古典経路[2]を介してp52/RelBといったNF-κBファミリー転写因子[2]を活性化させることが知られます。そこで、オルガノイドをRANKLで刺激してNF-κBファミリー転写因子の発現を調べたところ、Nfkb2およびRelb(それぞれp52およびRelBをコードする遺伝子)の発現がSpib(Spi-Bをコードする遺伝子)に先行して誘導されることが分かりました。
また、クロマチン免疫沈降法[10]により、RelBがSpibのプロモーター[11]へ結合することが確認されたことから、p52/RelBがSpi-Bの発現を直接的に制御することが示されました。実際に、オルガノイドへp52/RelBを強制発現させたところ、Spi-BやM細胞マーカー遺伝子の発現が上昇したことから、非古典経路がSpi-Bの上流でM細胞分化を制御していることが分かりました(図3)。
一方、p50/RelAの強制発現は、p52/RelBのようにSpi-BやM細胞マーカー遺伝子の発現を強く誘導させることはできませんでしたが、Nfkb2およびRelbの発現を誘導することが分かりました。また、p50/RelAを活性化させる古典経路を阻害した状態でオルガノイドをRANKLで刺激すると、M細胞分化が著しく阻害されることが観察されました。これらのことから、古典経路は非古典経路の上流においてM細胞分化を制御していることが分かりました。
RANKは、TRAF6というタンパク質を介してNF-κBシグナル伝達経路を活性化させます。そこで、腸管上皮細胞特異的にTRAF6を欠損したマウスにおけるM細胞の形成を調べたところ、M細胞が完全に欠失していることが観察されました(図4)。また、TRAF6を欠損させたヒト小腸由来オルガノイドへRANKLによるM細胞誘導を行った場合、M細胞を誘導できなかったことから、TRAF6はマウスおよびヒトのM細胞分化に必須であることが明らかとなりました。
今後の期待
今回、M細胞分化制御因子としてNF-κBシグナル伝達経路が必須であることが明らかになりました。M細胞は腸管免疫応答を発動する開始点であると同時に、病原性細菌の感染口にもなることが知られています。そのため、M細胞の抗原取り込みなどの特性を理解することは、感染症予防の観点からも非常に重要です。しかし、M細胞は腸管粘膜の中でも限られた部位にしか存在せず、生体内での絶対数が非常に少ないため、M細胞の特性の理解はまだ十分ではありません。
本成果により、今後オルガノイドを用いてin vitro(試験管内)でM細胞を効率よく誘導することで、M細胞の性質を理解する研究が発展すると期待できます。
原論文情報
Takashi Kanaya, Sayuri Sakakibara, Toshi Jinnohara, Masami Hachisuka, Naoko Tachibana, Shinya Hidano, Takashi Kobayashi, Shunsuke Kimura, Toshihiko Iwanaga, Tomoo Nakagawa, Tatsuro Katsuno, Naoya Kato, Taishin Akiyama, Toshiro Sato, Ifor Williams, and Hiroshi Ohno, “Development of intestinal M cells and follicle-associated epithelium is regulated by TRAF6-mediated NF-κB signaling”, Journal of Experimental Medicine, doi: 10.1084/jem.20160659
発表者
理化学研究所
統合生命医科学研究センター 粘膜システム研究グループ
研究員 金谷 高史 (かなや たかし)
グループディレクター 大野 博司 (おおの ひろし)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- M細胞
- 腸管粘膜を構成する腸管上皮細胞の一つ。パイエル板をはじめとする腸管免疫組織を覆う部分に分布する。腸管内の抗原を取り込み、腸管免疫組織の免疫細胞に抗原を受け渡す役割を担う。これにより、抗原に対する免疫応答を発動する。取り込んだ抗原をできるだけ早く免疫細胞に渡すため、ポケットのような形をしている。大野博司グループディレクターの研究グループはこれまでにGP2をはじめとする複数のM細胞に特異的に発現する分子の同定に成功している注2)。
注2)2009年11月12日プレスリリース「腸管免疫応答に重要な細菌認識受容体を世界に先駆けて発見」
-
- NF-κBシグナル伝達経路、NF-κBファミリー転写因子、古典経路、非古典経路
- シグナル伝達経路は、生体内である種のシグナルが他のシグナルに変換され、連続して伝わる過程のこと。NF-κBシグナル伝達経路は、NF-κBファミリー転写因子を中心に構成されるシグナル伝達経路である。NF-κBファミリー転写因子としてp50、p52、RelA、RelB、c-Relの5種類のタンパク質が知られており、これらがホモもしくはヘテロ二量体を形成し、転写因子として機能する。NF-κBシグナル伝達経路には古典経路および非古典経路の2種類があり、受容体の種類によって活性化される経路が異なる。なお、古典経路はタンパク質の合成を必要としない迅速な経路であり、一方で非古典経路はタンパク質の合成を伴うため比較的時間がかかる経路である。
-
- パイエル板
- 小腸の粘膜下に、リンパ球などの免疫細胞が集合して作られるリンパ組織。粘膜側は濾胞随伴上皮細胞層(FAE)と呼ばれる、絨毛とは異なった上皮細胞層に覆われている。腸管内の細菌などの抗原を、FAEを介して取り込む。取り込まれた抗原はFAEに近接するドーム下領域(sub-epithelial dome: SED)に分布する樹状細胞に受け渡され、T細胞へと抗原提示が行われる。最終的に、抗原特異的なIgA(免疫グロブリンA)抗体を産生するB細胞が成熟する。抗原特異的なIgA抗体は腸管内に放出され、抗原の排除に寄与する。
-
- 濾胞随伴上皮細胞層(FAE)
- パイエル板の粘膜側を覆う上皮細胞層。FAEには5~10%の割合でM細胞が存在する。残りは、主に絨毛の大部分を占める吸収上皮細胞様の細胞で構成されている。FAEはfollicle-associated epitheliumの略。
-
- 間質細胞
- 生体組織の支持構造を構成する細胞である。上皮組織においては上皮細胞の直下に分布しており、上皮細胞の増殖やさまざまな機能を促進する成長因子などを産生する。
-
- RANKL
- 腫瘍壊死因子(Tumor necrosis factor: TNF)スーパーファミリーサイトカインの一種。破骨細胞の分化因子として同定された。2009年にパイエル板の間質細胞に発現することが見いだされ、さらにM細胞の分化を誘導していることが発見された。RANKLはReceptor activator of NF-κB ligandの略。
-
- Spi-B
- 転写因子の一つ。1996年、免疫細胞の一種であるB細胞に発現して、分化や機能を調節することが発見された。2012年に金谷研究員らは、腸管粘膜を構成する上皮細胞の中ではM細胞だけで発現することを発見し、その分化に必須であることを見いだした。
-
- TRAF6
- CD40やRANKといったTNF受容体スーパーファミリーの細胞内ドメインに結合するタンパク質。NF-κBシグナル伝達経路などのシグナル伝達経路を活性化させる。TRAF6はTNF receptor associated factor 6の略。
-
- オルガノイド培養
- 小腸よりクリプト(腸陰窩)を採取し、三次元条件下で培養するとクリプトの幹細胞が増殖し、それらの細胞から各種腸管上皮細胞が分化する組織体(オルガノイド)が形成され、in vitro(試験管内)において腸管上皮細胞の分化や機能を再現することができる。2009年に佐藤俊朗博士(現慶應義塾大学)らによって確立された。なお、オルガノイドをRANKLで刺激するとM細胞を誘導することができる。
-
- クロマチン免疫沈降法
- 生体内におけるタンパク質とゲノムDNAの結合部位を検出するための実験手法。ホルムアルデヒドによってDNAとDNAに結合しているタンパク質を架橋したのちに、DNAの断片化を行い、タンパク質の抗体を用いてタンパク質-DNA複合体を回収する。さらにDNAとタンパク質を脱架橋し、DNAのみを回収し配列を調べることでタンパク質がゲノムのどこに結合していたか分かる。
-
- プロモーター
- DNAにおいて遺伝子が転写される際、転写のレベルを制御している領域である。転写開始点や転写レベルを調節している。
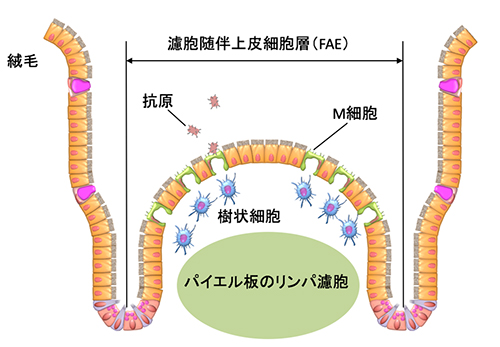
図1 腸管免疫組織を覆う腸管粘膜に分布するM細胞
M細胞は、パイエル板をはじめとする腸管免疫組織を覆う腸管粘膜の濾胞随伴上皮細胞層(FAE)に分布しており、腸管内に侵入してきた病原体などの抗原を取り込んで樹状細胞などの免疫細胞に受け渡す。
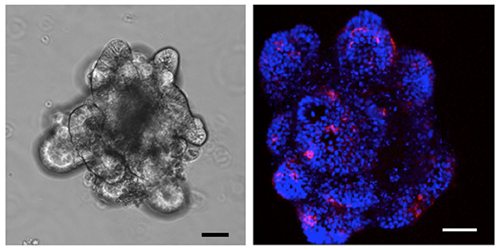
図2 小腸上皮幹細胞から作製したオルガノイドとオルガノイドに誘導されたM細胞
左:小腸よりクリプト(腸陰窩)を採取し、三次元条件下で培養することで作製したオルガノイド。スケールバーは50マイクロメートル(µm、1µmは1,000分の1mm)。
右:オルガノイドをRANKLで刺激すると、GP2陽性のM細胞が分化する。青色は細胞の核を示し、赤色はGP2を発現するM細胞を示している。スケールバーは50 µm。
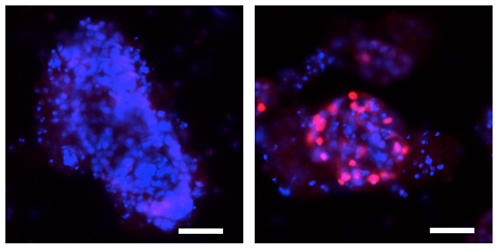
図3 オルガノイドにおけるp52/RelBの強制発現によるSpi-Bの発現誘導
オルガノイドにレンチウイルスを用いてp52/RelBを強制発現させると、Spi-Bの発現が誘導される。左は陰性対照であり、強制発現を行っていないオルガノイド。右はp52/RelBを強制発現させたオルガノイド。青色は細胞の核を示し、赤色はSpi-Bを発現する細胞を示している。スケールバーは50 µm。
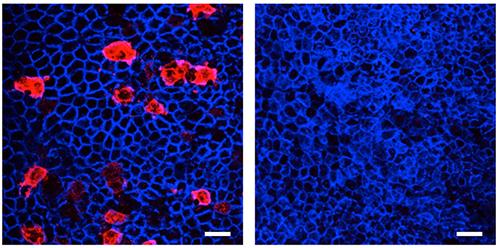
図4 TRAF6欠損マウスにおけるM細胞の欠失
腸管上皮細胞特異的にTRAF6を欠損させたマウスから、FAEを採取してM細胞マーカーの染色を行った。左はTRAF6を欠損していない陽性対照のマウスから採取したFAE。右はTRAF6欠損マウスから採取したFAE。青色は細胞間接着タンパク質であるE-cadherinを示し、赤色はGP2を発現する細胞を示している。右では、M細胞が欠失していることが分かる。スケールバーは50 µm。