2019-03-20 京都大学iPS細胞研究所
ポイント
- 胎生期膵臓外分泌組織から分泌されるタンパク質(TFF2)が内分泌細胞の生存をサポートしていることを見出した。
- これまで注目されてこなかったTFF2などの外分泌細胞由来因子を応用し、発生現象を正確に再現することで、 iPS細胞からより良質なインスリン細胞を作り出せると期待される。
1. 要旨
平田耕司研究員(CiRA未来生命科学研究部門、京都大学医学研究科)、および川口義弥教授(CiRA同部門)らの研究グループは、胎生期膵臓外分泌組織から分泌されるタンパク質(TFF2)がCXCR4受容体を介してインスリン細胞の生存を助けていることを見出しました。また、TFF2はCXCR4以外の未知の受容体を通じて内分泌前駆細胞の保護も行っていることが分かり、これまで不明であった膵臓の外分泌―内分泌組織間の相互作用の一端が解明されました。
この研究成果は、2019年2月7日(英国時間)に英科学誌「Scientific Reports」で公開されました。
2. 研究の背景
膵臓は,消化酵素を分泌する外分泌組織と、血糖調節を担うホルモンを血液中に放出する内分泌組織(膵島)の2種類の組織を含むユニークな臓器です。胎生期の膵臓形成において、外分泌・内分泌組織は、枝分かれした膵管構造の別々の領域にほぼ同時に形成され終生共存しますが、それぞれの組織の形作りや機能を獲得する過程で、お互いがどのように影響し合うかはよく分かっていませんでした。
研究グループはこれまでの研究で、胎生期外分泌組織特異的Pdx1ノックアウトマウス(Elastase-Cre; Pdx1cKOマウス)注1が外分泌組織の著しい低形成だけでなく、内分泌細胞系譜の形成にも様々な異常を来たして結果的に糖尿病になることを示し、正常な内分泌組織の形成は未知の外分泌組織由来因子の制御を受けることを予想していました。
今回の研究では、正常な内分泌組織の形成をサポートする外分泌組織由来因子を具体的に同定し、その作用機序を解明することを目指しました。
3. 研究結果
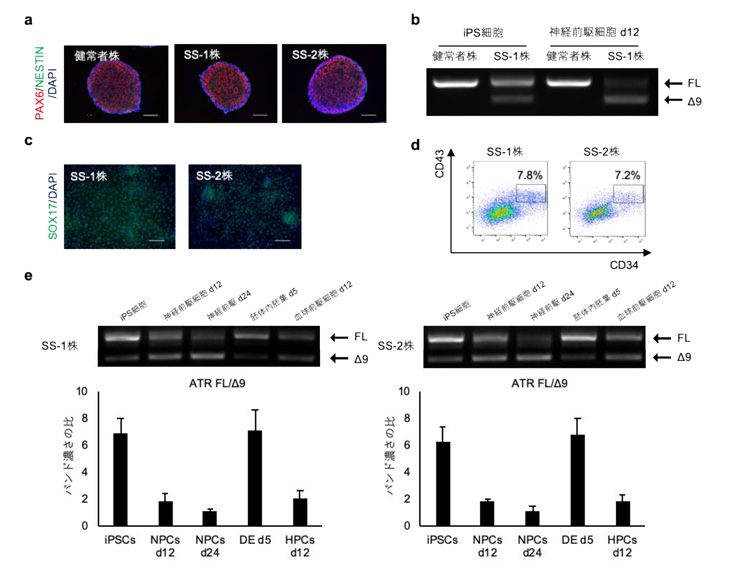
本研究では、上記外分泌組織低形成マウス(Elastase-Cre; Pdx1cKOマウス)と正常マウスそれぞれの出生当日の膵臓組織を用いたマイクロアレイ解析注2から候補因子を抽出し、その中でTrefoil Factor 2(TFF2)に注目しました。免疫組織染色注3とin situ hybridization注4ならびにqPCR解析注5から、TFF2は正常マウスでは胎生16.5日から膵外分泌組織に発現し始め、それ以降成体期まで発現量が徐々に増加しますが、Elastase-Cre; Pdx1cKOマウスではTFF2発現が極めて少ないことがわかりました(図1)。
そこで、胎生16.5日時点のElastase-Cre; Pdx1cKOマウスの膵臓組織解析を行ったところ、Nkx6.1陽性内分泌前駆細胞注6およびインスリン細胞が顕著なアポトーシス注7を起こしていることが観察されました(図2)。一方、TFF2受容体であるCXCR4はインスリン細胞だけに発現していることが判明し、外分泌細胞で作られたTFF2がインスリン細胞に何らかの働きかけをしている可能性が高まりました(図3)。
次に、胎生期の膵臓組織を培養する方法を開発してTFF2の機能を調べました。まず、Elastase-Cre; Pdx1cKOマウスの培養膵臓組織にTFF2を加えるとインスリン細胞数が増えることを見出しました。この効果は、細胞の増殖が刺激されたのではなく、 抗アポトーシス作用で死ににくくなっているためだとわかりました。TFF2とCXCR4拮抗薬を合わせて加えると、上記インスリン細胞数の増加/抗アポトーシス作用がキャンセルされ、更には正常マウス膵組織培養にCXCR4拮抗薬だけを添加してもインスリン細胞のアポトーシスが促進されたことから、外分泌組織由来TFF2がCXCR4を介してインスリン細胞の生存を助けていると結論されました(図4)。
さらに、TFF2はElastase-Cre; Pdx1cKOマウスのNkx6.1陽性内分泌前駆細胞のアポトーシスも抑制しましたが、この効果はCXCR4拮抗薬によってキャンセルされず、TFF2に対する未知の受容体の存在が示唆されます。
以上の知見は、TFF2が内分泌細胞系譜形成の多段階において、それぞれ異なる受容体を介して内分泌細胞の生存を維持する新規の外分泌組織因子であることを示しています(図5)。
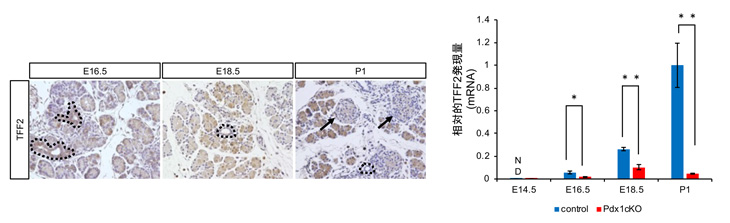
図1 TFF2はマウス胎生16.5日目の膵臓外分泌組織特異的に発現する(左図の茶色の部分。点線は膵管構造。矢印で示す内分泌組織にはTFF2は発現していない)。胎生16.5日以降、正常マウスではTFF2発現量は次第に増加するが、Elastase-Cre; Pdx1cKOマウスでは発現量が極めて少ない。
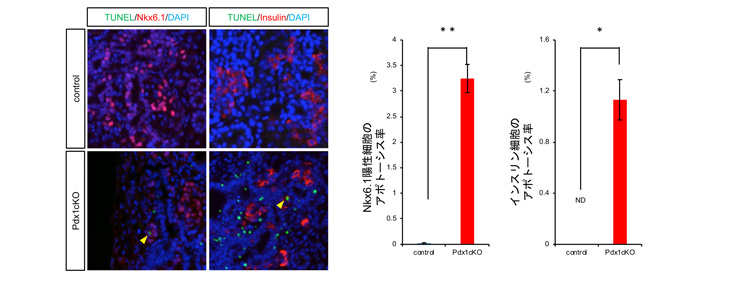
図2 胎生16.5日の正常マウス膵臓ではアポトーシス (左下2図の緑色の部分)はほとんど観察されないが、Elastase-Cre; Pdx1cKOマウスではNkx6.1陽性内分泌前駆細胞およびインスリン細胞でのアポトーシスが亢進している。
図3 胎生期膵臓組織では、既知のTFF2の受容体CXCR4はインスリン細胞だけに発現する
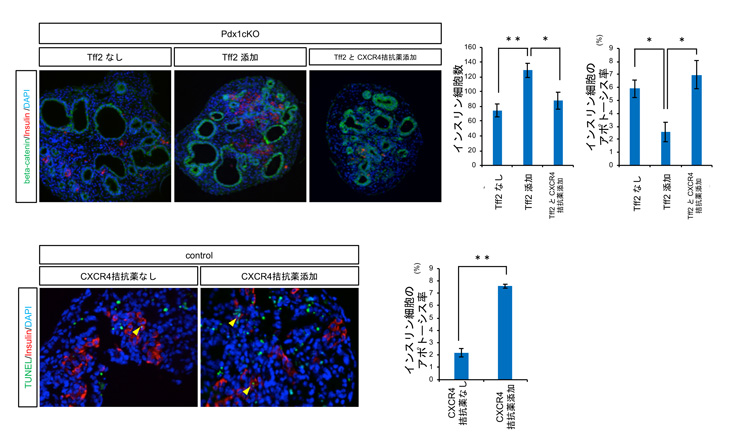
図4 胎生16.5日のElastase-Cre; Pdx1cKOマウス膵臓を培養し、TFF2を加えるとインスリン細胞が増加する。 その際、アポトーシスが抑制される。これらの効果はCXCR4拮抗薬の添加でキャンセルされる(上段)。 一方、正常マウス膵臓にCXCR4拮抗薬を加えるとアポトーシスが活性化してしまう(下段)。
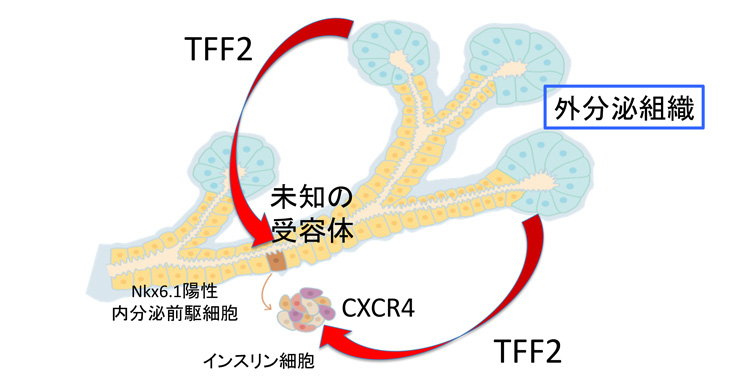
図5 外分泌組織で作られるTFF2は未知の受容体を介してNkx6.1陽性内分泌前駆細胞に、CXCR4受容体を介してインスリン細胞に働きかける。いずれもアポトーシスを抑制して細胞の生存を助ける
4. まとめ
今回の研究は、「なぜ、膵臓では異なった働きをする2つの組織(外分泌組織・内分泌組織)が同時に作られ、終生共存するのか?」という単純な疑問に対して、具体的な分子(TFF2とCXCR4)の働きを実証したという生物学上の意義があります。研究グループでは、TFF2/CXCR4以外にも外分泌組織・内分泌組織間制御を担うシグナルが存在すると考えて研究を続行しています。
iPS細胞を糖尿病治療に役立てる為に、多くの研究者は「より効率的にインスリン細胞を作る」方針で研究開発を行っていますが、TFF2を含めた外分泌組織由来因子の重要性はあまり注目されておりませんでした。本研究の成果は、胎生期の膵臓で実際に起こっていることを明らかにしており、iPS細胞を用いた糖尿病治療法開発に新たな視点を加えています。
5. 論文名と著者
- 論文名
“Exocrine tissue-driven TFF2 prevents apoptotic cell death of endocrine lineage during pancreas organogenesis” - ジャーナル名
Scientific Reports - 著者
Koji Hirata1,2, Sota Kodama1,2, Yasuhiro Nakano2, Yasuko Minaki-Nakagawa2, Yoshiki Aoyama1,2, Morito Sakikubo1,2, Toshihiko Goto1,2, Masahiro Yoshida1,2, Toshihiko Masui1, Takuya Yamamoto2, Shinji Uemoto1 and Yoshiya Kawaguchi2*
* 筆頭著者 - 著者の所属機関
- 京都大学大学院医学研究科 肝胆膵・移植外科学教室
- 京都大学iPS細胞研究所(CiRA)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)
- 再生医療実現化拠点ネットワークプログラム
7. 用語説明
注1)Pdx1ノックアウトマウス(Elastase-Cre; Pdx1cKOマウス)
Pdx1は膵芽細胞マーカーで、発生過程において、膵臓の内分泌細胞・外分泌細胞の形成に必須の遺伝子。Pdx1ノックアウトマウス(Elastase-Cre: Pdx1cKOマウス)は、個体発生に必須の遺伝子などを特定の細胞でのみノックアウトできる(働かないようにする)Cre/loxPシステムを利用して作製されたマウスで、エラスターゼ(消化酵素)をつくる外分泌細胞だけでCreが活性化して、膵臓形成に必要なPdx1の発現を抑える。
注2)マイクロアレイ解析
一度に膨大な数のDNAやたんぱく質を網羅的に検査することができる解析技術。
注3)免疫組織染色
特定のタンパク質を認識する抗体を用いて、そのタンパク質が存在する場所に色を付ける方法。
注4)in situ hybridization
組織や細胞において、特定のDNAやRNAの分布を検出するための技術。
注5)qPCR解析
リアルタイムPCR(ポリメラーゼ連鎖反応)または定量PCRと呼ばれ、DNAの増幅と量の計測が同時にできる方法。
注6)Nkx6.1陽性内分泌前駆細胞
Nkx6.1遺伝子(内分泌前駆細胞のマーカー遺伝子)が発現している細胞。
注7)アポトーシス
細胞死の1つで、細胞内の何らかの異常に反応して起こるプログラムされた細胞死。