神経障害性疼痛治療への応用に期待
2021-08-11 国立精神・神経医療研究センター,京都大学
国立研究開発法人 国立精神・神経医療研究センター(NCNP)神経研究所モデル動物開発研究部の工藤もゑこテクニカルフェロー、Sidikejiang Wupuer 研究員、および関和彦部長と京都大学霊長類研究所神経科学研究部門統合脳システム分野の井上謙一助教と高田昌彦教授らの共同研究グループは、アデノ随伴ウイルスベクター(AAV)を用いて、小型霊長類であるコモンマーモセットの痛覚神経へ選択的に遺伝子を導入することに成功しました。
慢性疼痛は特定の疾患の患者だけでなく、一見健康に見える人の多くが抱える悩みです。過去の調査によれば、日本人成人の4人に1人が何らかの慢性疼痛を有しているとまでいわれています。この、慢性疼痛の24%は「神経障害性疼痛」、つまり体性感覚系の損傷や疾患が原因となって起こる疼痛です。神経障害性疼痛は皮膚などが刺激されなくても持続的に起こる痛みで、現在まで根本的な治療方法は存在しませんでした。しかし、現在盛んに研究が行なわれている遺伝子治療の技術を用いれば、神経障害性疼痛の根治が可能になるかもしれません。例えば、疼痛を伝える末梢感覚神経(侵害受容神経)に選択的に治療関連遺伝子を導入してその活動を抑制する事ができるようになるかもしれません。しかし、末梢神経には、侵害受容神経の他にも、自分が動いているということを伝える神経や、触覚を伝える神経が混在しているため、そのような侵害受容神経のみへの選択的な遺伝子導入は長年不可能とされてきましたが、近年、それを可能にするかもしれない遺伝子治療技術が提案されました。つまり、アデノ随伴ウイルスベクターを用いて、外来遺伝子を侵害受容神経へ選択的に導入する技術です。この技術は、革新的なヒトの慢性疼痛治療に発展する可能性がありますが、成功例はマウスやラットなどのげっ歯類に限られ、ヒトを含めた霊長類では報告されていませんでした。本研究では、同様な遺伝子導入方法を用いて、霊長類(マーモセット)においても侵害受容神経に特化した遺伝子導入が可能なことを世界で初めて証明しました。
本研究の成果は、神経障害性疼痛に悩むヒトの患者さんに対する、アデノ随伴ウィルスベクターを用いた新規の遺伝子治療法に発展する事が期待されます。
本研究成果は、日本時間2021年8月8日21時27分に「Molecular Therapy – Methods & Clinical Development」オンライン版に掲載されました。
研究の背景
慢性疼痛は様々な疾患を持つ患者さんに共通するだけでなく、一見健康に見える人の多くが抱える悩みです。例えば、過去の調査によれば、日本人成人の4人に1人が何らかの慢性疼痛を持っていることがわかっています。そして、慢性疼痛を訴える人の24%は「神経障害性疼痛」、つまり体性感覚系の損傷や疾患が原因となって起こる疼痛です。この、神経障害性疼痛を罹患すると、皮膚などが刺激されなくても痛みが持続しますが、残念ながら、根本的な治療方法は存在しません。このような背景から、近年、神経障害性疼痛の遺伝子治療の方法が、盛んに研究されています。そこでは、疼痛刺激を感知する末梢感覚神経(侵害受容神経)に選択的に外来遺伝子を導入し、その活動を抑制する事によって疼痛を抑圧することが目指されています。ところが、末梢神経には、侵害受容神経の他にも、自分が動いているということを伝える神経や、触覚を伝える神経が混在しています。そのため、侵害受容神経のみに選択的に遺伝子導入を行う事が困難であり、技術的な課題でした。ところが最近、アデノ随伴ウイルスベクターを用いると、外来遺伝子が侵害受容神経選択的に導入できるという画期的な発見が報告されました。この技術を用いれば、ヒトの慢性疼痛を効果的に治療できる可能性があります。しかし、これまで、この選択的な遺伝子導入の成功例は、マウスやラットなどのげっ歯類に限られ、ヒトを含めた霊長類での成功例はありませんでした。
研究の概要
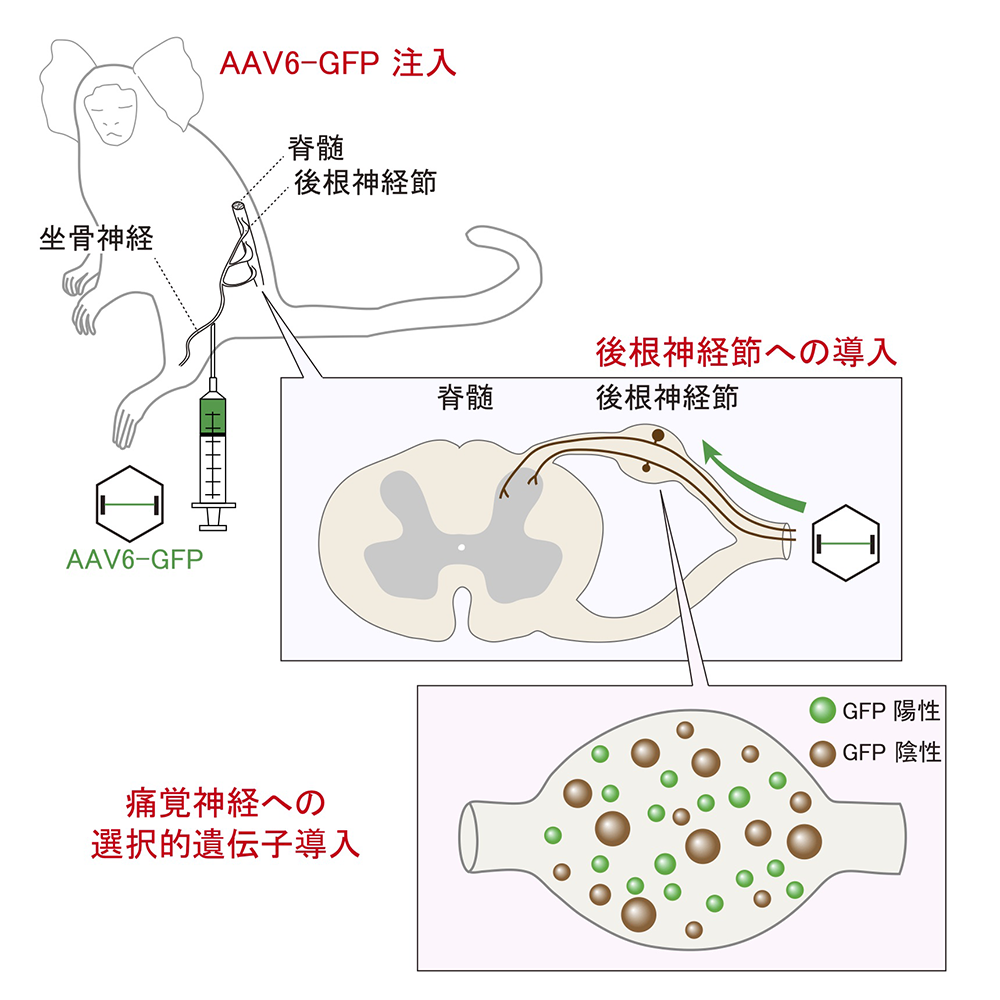
研究グループは、マーモセットの感覚神経細胞に遺伝子導入を行うため、蛍光タンパク遺伝子であるGFPを組み込んだアデノ随伴ウイルス(AAV)ベクターを座骨神経に注入しました(図1A, B)。先行研究との比較のため、げっ歯類のラットに対しても同様の実験を行いました。AAVはそのタイプに応じて異なった組織や細胞に指向性(より優先的に感染しやすい性質)を持つことが知られていますが、特にAAV6はげっ歯類において痛覚神経に指向性があることが知られています。そこで実験ではAAV6と、比較対象として触覚や筋感覚に指向性のあるAAV9を用いました。すると、目的どおり感覚神経細胞に遺伝子導入されていることが確認されました(図1 C-F)。また、標的組織以外への遺伝子導入について調べたところ、ベクターを注入した部位より遠位の脊髄や注入周辺の筋肉では、ベクターの導入量は非常に少なく、神経組織への高い選択性が確認されました(図1 G-I)。
次に、感覚神経細胞におけるAAV6およびAAV9それぞれの指向性を確認したところ、AAV6に関しては、マーモセットもラットと同様に無髄神経細胞に指向性を持っていましたが、AAV9に関しては、有髄神経細胞に指向性を持つラットとは異なり、マーモセットでは指向性が見られませんでした(図2)。感覚神経細胞の中でも、無髄神経は主に痛みなど痛覚に関与し、有髄神経は触覚や筋感覚に関与していることが知られています。さらに、病理学的検査を行ったところ炎症性細胞の浸潤などは認められず、AAVの毒性による影響はほとんど無いことが確認されました(図3)。
最後に、感覚神経細胞の情報の伝達先である脊髄においても、AAV6およびAAV9それぞれの指向性を確認しました。脊髄でも、感覚神経細胞と同様に、AAV6はマーモセットもラットも無髄線維に指向性を持っていました。一方、AAV9に関しては、ラットでは有髄線維に指向性を持っていたのに対し、マーモセットでは、無髄線維に指向性を持つ傾向が見られました(図4)。
この結果、マーモセットに関して、AAV6のタイプを選択すると、痛覚神経に選択的に遺伝子を導入することが可能であることが示されました(図5)。
今回、我々が霊長類の痛覚神経選択的な遺伝子導入に成功できたのは、神経へのウィルスベクター直接注入という投与経路を選択したためだと考えられます。従来の霊長類を対象とした研究ではほとんどが静脈内投与や髄液内投与を用いていたため、痛覚神経への選択性が得られていませんでした。ウィルスベクターが血液脳関門を通過して脳神経細胞に遺伝子を導入する仕組みはよくわかっていませんが、この仕組みにげっ歯類と霊長類では大きな違いがあるものと推察できました。
今後の展望
痛覚神経への選択的な遺伝子導入技術がげっ歯類だけでなく霊長類においても実現した事により、今後は導入技術ではなく、どのような遺伝子を導入することによって慢性疼痛をより効果的に抑制できるかを対象とした開発研究が盛んに行われるようになると予想します。例えば、神経活動を抑えるような治療薬の導入による疼痛抑制、また現在盛んに研究が進んでいる光遺伝学や化学遺伝学を用いた治療方法など、多くの治療方法に発展することが期待できます。私達が開発した方法は、現在のところ末梢神経への直接注射が必要なため、技術的難易度が高いことが欠点です。しかし、今回の発見に基づけば、臨床で日常的に行なわれている皮膚や筋肉への注射によっても同様な効果が期待できます。このような新規注入ルートの開発によって、神経障害性疼痛治療の最も簡便で効果的な方法の一つとして確立できる可能性があります。
図1:AAVベクターの神経内注入
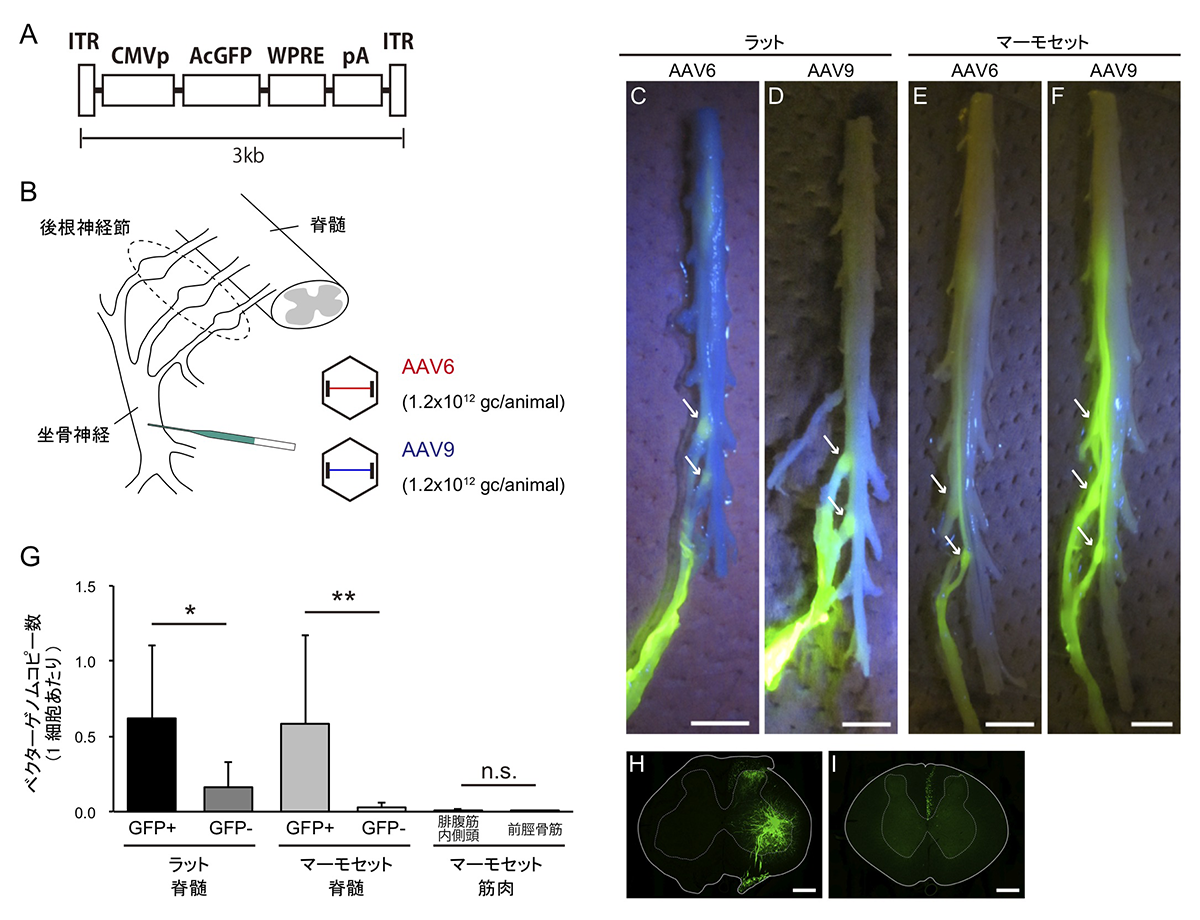
A, B) GFP遺伝子を組み込んだAAVベクターをマーモセットの左側坐骨神経に注入することにより、感覚神経細胞へ遺伝子導入を行う。C-F) AAVベクター注入1ヶ月後の脊髄と後根神経節(白矢印)における蛍光タンパク遺伝子GFPの発現例。G-I) 標的部位以外へのAAVベクターの導入は非常に少ない。注入部位近傍の脊髄(GFP+, H)と遠位の脊髄(GFP-, I)、および注入部位近傍の筋肉(腓腹筋内側頭)と遠位の筋肉(前脛骨筋)におけるAAVベクターコピー数の比較。
図2:感覚神経細胞への蛍光タンパク分子の導入と指向性 感覚神経細胞の遺伝子導入例。感覚神経細胞(NeuN, 赤)と神
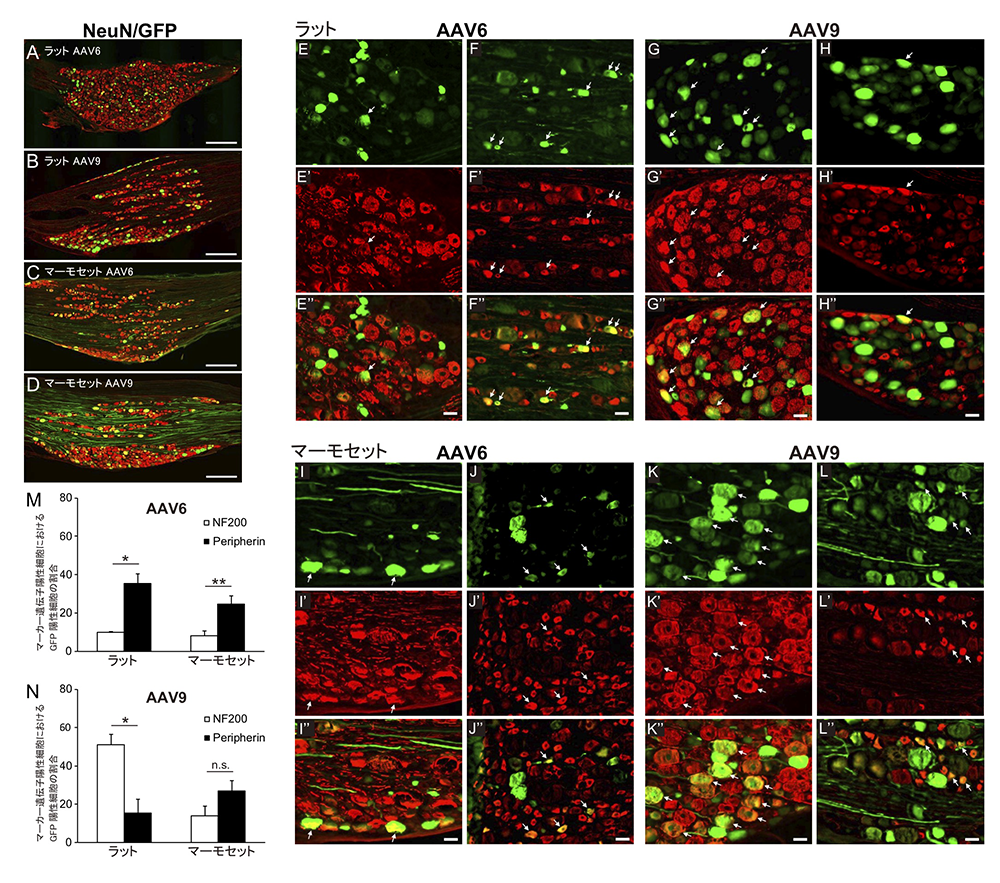
感覚神経細胞の遺伝子導入例。感覚神経細胞(NeuN, 赤)と神経細胞への遺伝子発現を表す蛍光マーカー(GFP, 緑)との重ね合わせにより、AAV6およびAAV9ベクターともに蛍光タンパク分子が神経細胞に導入されているのが分かる(A-D)。さらに、感覚神経細胞を有髄神経(E-E”, G-G”, I-I”, K-K”, 赤)と無髄神経(F-F”, H-H”, J-J”, L-L”, 赤)に区別して、それぞれ蛍光マーカー(緑)との重ね合わせを見ると、AAV6では、ラットもマーモセットも無髄神経により多く遺伝子導入される。一方、AAV9では、ラットは有髄神経により多く遺伝子導入されるが、マーモセットでは有髄・無髄神経とも遺伝子導入に優位な差は見られなかった(M, N)。
図3:ヘマトキシリン・エオジン染色による病理学的検査
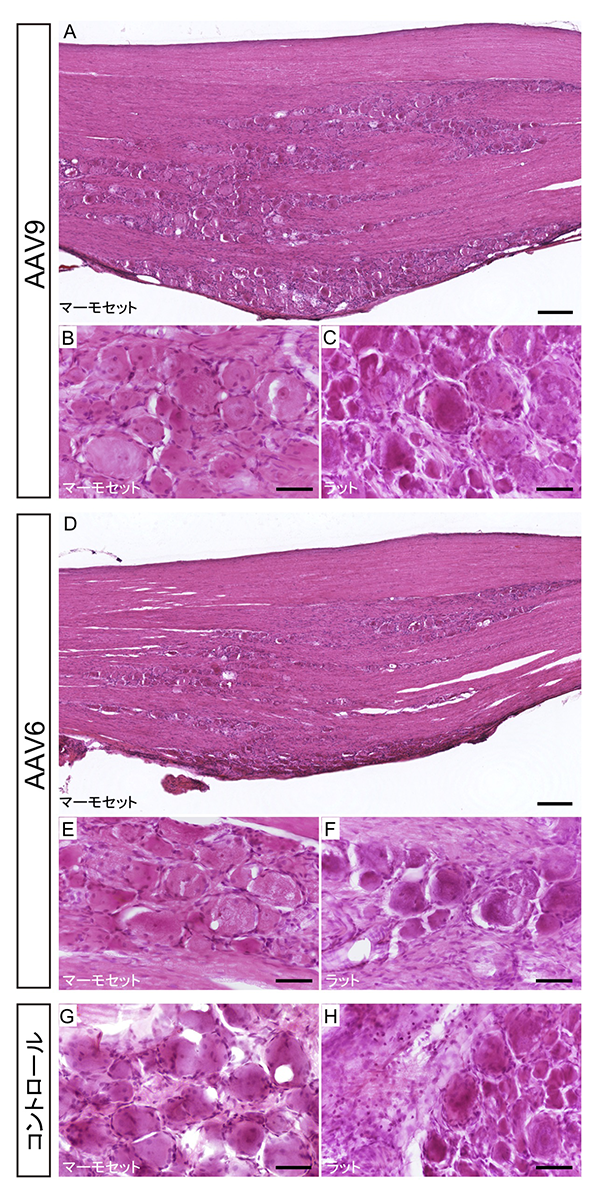
AAV9を投与したマーモセット(A, B)とラット(C)およびAAV6を投与したマーモセット(D, E)とラット(F)感覚神経細胞のヘマトキシリン・エオジン染色の例。反対側のコントロール(Gマーモセット, Hラット)と比較して、細胞浸潤の兆候に有意な差は見られなかった。
図4:脊髄での蛍光タンパク分子の導入と指向性
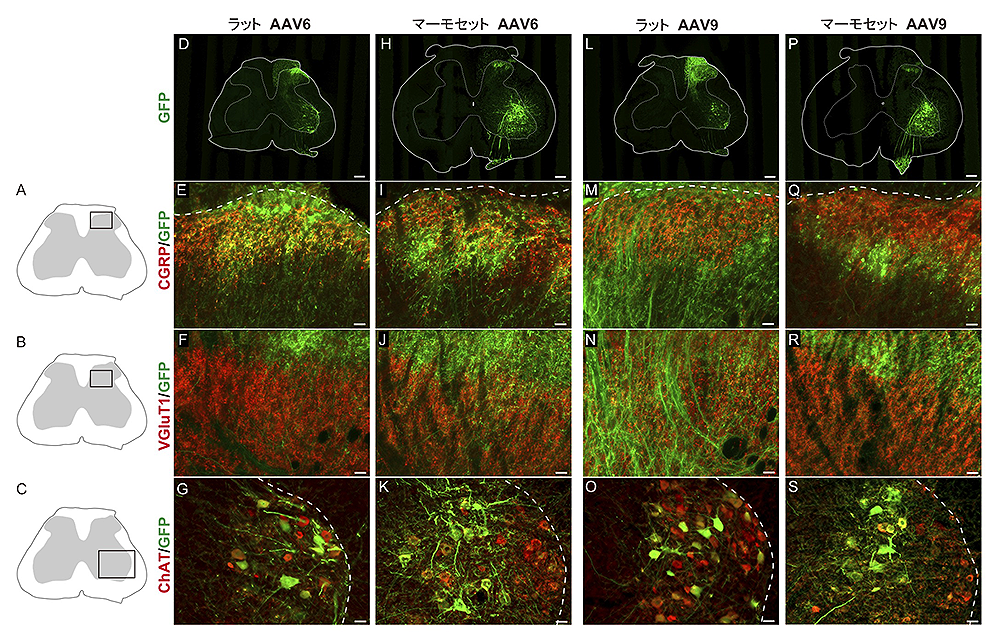
感覚神経細胞に導入された蛍光タンパク分子は、感覚情報の伝達先である脊髄でも確認された(図4)。ラット脊髄およびマーモセット脊髄におけるAAV6とAAV9の遺伝子導入例。AAV6では、ラットもマーモセットも無髄の侵害受容性神経細胞に遺伝子導入が見られたが(E, I)、有髄の体性感覚に関わる神経細胞には導入されなかった(F, J)。一方、AAV9では、ラットは有髄神経に遺伝子導入が見られたが(N)、マーモセットでは無髄神経の一部に導入され(Q)、有髄神経には導入されなかった。なお、脊髄の前角では運動ニューロンに遺伝子導入が見られた(G, K, O, S)。
図5:マーモセットへAAV6タイプのベクターを注入すると、痛覚神経へ選択的に遺伝子を導入することが可能
用語解説
・アデノ随伴ウイルス(AAV)ベクター:
遺伝子治療への応用が期待される遺伝子導入ベクター(遺伝子の運び屋)の一つ。非常に弱い免疫反応しか引き起こさず、病原性は持たないとされている。神経細胞などに効率よく遺伝子導入でき、遺伝子発現が長期間持続するという特徴を持つ。また、AAVのタイプに応じてそれぞれ異なった組織に対する指向性を持つことが知られている。
・後根神経節:
末梢の感覚受容器からの信号を中枢に伝達する感覚神経細胞の集合体。温痛覚、触覚、筋感覚など異なった種類の神経細胞が集まる。感覚神経の軸索(細胞体から延びる細長い突起)が脊髄に入る手前に位置する。
原論文情報
・論文名:” Specific gene expression in unmyelinated dorsal root ganglion neurons in nonhuman primates by intra-nerve injection of adeno-associated virus 6 vector”
・著者:工藤もゑこ、Sidikejiang Wupuer、藤原真紀、齊藤祐子、窪田慎治、井上謙一、高田昌彦、関和彦
・掲載誌:Molecular Therapy – Methods & Clinical Development
・DOI:10.1016/j.omtm.2021.07.009
・URL:https://www.sciencedirect.com/science/article/pii/S2329050121001261
助成金
本成果は、主に以下の研究助成を受けて行われました。
• 文部科学省科学研究費助成金 JP19H01092, 19H05724, 19K21825, JP17J05310
• 日本医療研究開発機構 JP20dm0307021, JP20dm0207077.
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 モデル動物開発研究部 関和彦(せき かずひこ)
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
総務課広報係
京都大学 総務部広報課国際広報室