2019-04-19 徳島大学,日本医療研究開発機構
ポイント
- 抑制性の免疫補助受容体であるPD-1は、自己組織やがん細胞を攻撃するT細胞を強力に抑制するにもかかわらず、通常の免疫応答を抑制することはありませんが、その理由は不明でした。
- PD-1はPD-L1と結合することで抑制作用を発揮しますが、T細胞に抗原を提示する抗原提示細胞上ではCD80という分子がPD-L1と隣り合わせに結合(シス結合)しており、このためPD-1はPD-L1に結合できなくなり、PD-1による抑制が起こらなくなることを明らかにしました。
- CD80をPD-L1にシス結合できなくしたマウスでは、ワクチンに対する免疫応答が弱まり、自己免疫疾患の発症も軽減されることを明らかにしました。
- 本研究から、PD-1が生体にとって必要な免疫応答は抑制しないが、自己免疫疾患につながる免疫応答や、がん免疫応答を選択的に抑制するメカニズムが解明され、新たな自己免疫疾患の治療法開発につながることが期待されます。
概要
徳島大学先端酵素学研究所の杉浦大祐特任助教、岡崎拓教授らの研究グループは、抑制性の免疫補助受容体[1]であるPD-1(Programmed cell death 1)が、有益な免疫応答は抑制せずに、自己免疫疾患につながる免疫応答を選択的に抑制するメカニズムを解明しました。
昨年、抑制性免疫補助受容体PD-1を介した免疫抑制の阻害によるがん治療法の発見により本庶佑博士がノーベル賞を受賞されました。PD-1は自己組織やがん細胞を攻撃するT細胞の活性化を強力に抑制するにもかかわらず、通常の免疫応答を抑制することはありませんが、その理由は不明でした。今回、岡崎教授らのグループは、抗原提示細胞上[3]では、興奮性免疫補助受容体CD28および抑制性免疫補助受容体CTLA-4のリガンド[2]として知られるCD80が、PD-L1と隣り合わせに結合(シス結合)することを明らかにしました。CD80がPD-L1にシス結合するとPD-1はPD-L1に結合できなくなるため、PD-1による抑制がなくなり、T細胞は正常に活性化されることが解明されました。さらに、CD80をPD-L1にシス結合できなくしたマウスでは、ワクチンに対する免疫応答が弱まり、自己免疫疾患の発症が軽減されるが、他方ではがん免疫によるがん細胞の排除も弱まることを明らかにしました。自己免疫疾患の標的となる実質細胞やがん細胞は通常CD80を発現しないため、PD-L1はT細胞のPD-1と結合できて、T細胞の活性化は抑制されるため細胞は傷害されません。一方、T細胞はリンパ節などで抗原提示細胞が提示する抗原を認識しますが、抗原提示細胞にはCD80が発現しているためPD-L1はT細胞のPD-1と結合できなくなり、提示された抗原に対してT細胞が適切に活性化されると考えられます。
本研究は、PD-1が自己組織やがん細胞に応答するT細胞の活性化は強力に抑制する一方で、通常の免疫応答を抑制してしまわないという根本的な疑問を解決するとともに、新たな自己免疫疾患の治療法開発につながることが期待されます。
本研究成果は、4月18日付けで米国科学雑誌「Science」オンライン版に公開されます。
背景
2018年のノーベル生理学・医学賞は、免疫抑制の解除によるがん免疫療法を開発した功績により、本庶佑博士とJames P. Allison博士に授与されました。両博士は、未治療の状態でもがん細胞に対する免疫応答は既に誘導されているにもかかわらず、PD-1およびCTLA-4という抑制性免疫補助受容体(いわゆる、免疫チェックポイント分子)により、がん細胞への攻撃力が無力化されていることを見出しました。さらに、抗体によりPD-1やCTLA-4の機能を阻害してやると、それまで体内で無力化されていたがん細胞特異的T細胞は活性化され、がん細胞を攻撃し、がんが治療できることを発見しました。これらの発見は、がん治療およびがん研究に大きな変革をもたらしました。
PD-1は、1992年に本庶研究室において石田靖雅博士らによって発見されたタンパク質で、活性化したT細胞やB細胞の細胞表面に発現します。岡崎教授は本庶研究室において、PD-1による抑制の分子メカニズムなどを解明し、PD-1が自己に対する不適切な免疫応答やがん免疫応答を抑制する抑制性免疫補助受容体であることを明らかにしました。一方、通常のマウスやヒトでは、PD-1が機能しているにもかかわらず、免疫系は正常に機能して、病原微生物などが排除され生体は防御されています。このことから、病原微生物などに対する有益な免疫応答を無力化してしまわないように、PD-1の機能は使い分けられていると考えられていましたが、そのメカニズムは長らく不明でした。
T細胞は、細胞表面に発現するT細胞抗原受容体を使って抗原を認識します。しかし、抗原を認識しただけではT細胞は活性化されません。活性化には、T細胞に発現している興奮性の免疫補助受容体CD28を介した副刺激が必須です。CD28は、抗原提示細胞上に発現するCD80あるいはCD86と結合して副刺激を伝達することが知られています。
これまで他のグループによって、T細胞上のPD-L1が抗原提示細胞上のCD80と、さらにはT細胞上のCD80が抗原提示細胞上のPD-L1と結合することで、T細胞に抑制性のシグナルを伝達すると、報告されていましたが、その真偽や詳細は不明でした。
本研究では、PD-L1とCD80がT細胞と抗原提示細胞の間で向かい合って結合するのでは無く、同じ細胞上で隣り合わせに結合(シス結合)することを見出したことから、その生物学的意義を解析し、今回の発見に至りました。
研究手法と成果
PD-1の細胞外領域を多量体化させた可溶性タンパク質(PD-1-EC)を用いて、様々な種類の抗原提示細胞にPD-1が実際に結合できるかを検討したところ、PD-1はマクロファージには結合するものの、抗原提示能のより高い樹状細胞にはほとんど結合しないことが分かりました。しかしマクロファージと樹状細胞を比べてもPD-L1の発現量にはほとんど差が無く、さらにCD80欠損マウスの樹状細胞がPD-1と強く結合したことから、CD80が樹状細胞上に発現していると、PD-1はPD-L1に結合できなくなると予測しました。そこで、CRISPR/Cas9を用いたゲノム編集[4]により培養細胞のPD-L1遺伝子を一旦欠損させた後に、PD-L1、PD-L2、CD80あるいはCD86を様々な組み合わせで発現させ、PD-1と結合できるかどうかを検討しました(図1A)。その結果、予想通り、CD80がPD-L1と同じ細胞上に発現する場合にのみ、PD-1とPD-L1の結合が邪魔されることが分かりました。また、CD80がPD-1とPD-L1との結合を邪魔すると、PD-1はT細胞が活性化するのを抑制できなくなることも分かりました(図1B)。
次に、CD80とPD-L1にアミノ酸変異を導入して、PD-L1と結合できないCD80変異体およびCD80と結合できないPD-L1変異体を作製しました(図2A)。CD80変異体はPD-L1と同じ細胞上に発現してもPD-L1とPD-1の結合を邪魔できず、PD-L1変異体はCD80が同じ細胞上に発現していてもPD-1と結合することができました(図2BC)。さらに、CRISPR/Cas9を用いたゲノム編集で、これらの変異を持つマウス(CD80変異体ノックインマウス[5]とPD-L1変異体ノックインマウス)を作製しました。これらのノックインマウスの樹状細胞を野生型マウスの樹状細胞と比べると、PD-1とより強く結合し、T細胞の活性をPD-1依存的に抑制しました(図3AB)。
マウスに抗原を免疫することで、抗原に特異的なT細胞の活性化を惹起することができます。CD80とPD-L1が結合できないノックインマウスでは、抗原特異的T細胞の活性化が著しく障害されていました(図3C)。また、がん免疫療法によるがんの治療効果は、CD80とPD-L1が結合できないノックインマウスではほとんど確認されませんでした(図4A)。さらに、このノックインマウスで、ヒトの自己免疫疾患である多発性硬化症のモデルになる実験的自己免疫性脳脊髄炎を起こさせた際には、自己免疫疾患の発症が軽減していました(図4B)。一連の研究は主にマウスを用いて行いましたが、ヒトのPD-L1とCD80を用いた研究でも同様のことが確認されました。
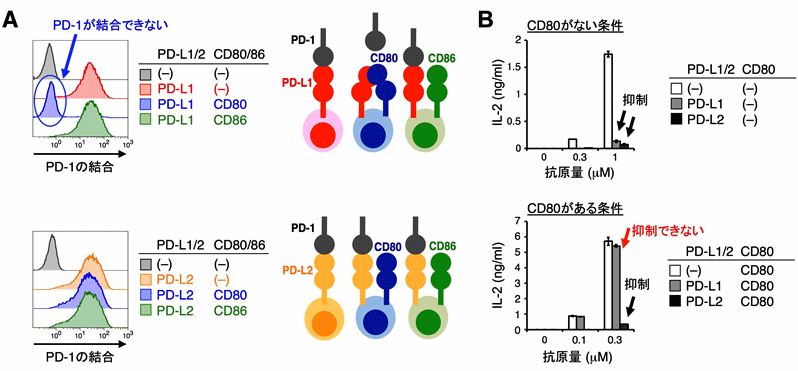
図1:CD80がPD-L1にシス結合すると、PD-1はPD-L1と結合できなくなり、T細胞の活性化は抑制されない
(B)抗原刺激によりT細胞を活性化させるとIL-2が産生される(上段、白)。PD-L1あるいはPD-L2とPD-1が結合して働くとT細胞活性化が抑制され、IL-2産生量が減少する(上段、黒と灰)。抗原提示細胞にCD80を発現させると、PD-L1による抑制効果は失われるが、PD-L2による抑制効果は失われない(下段、灰)。
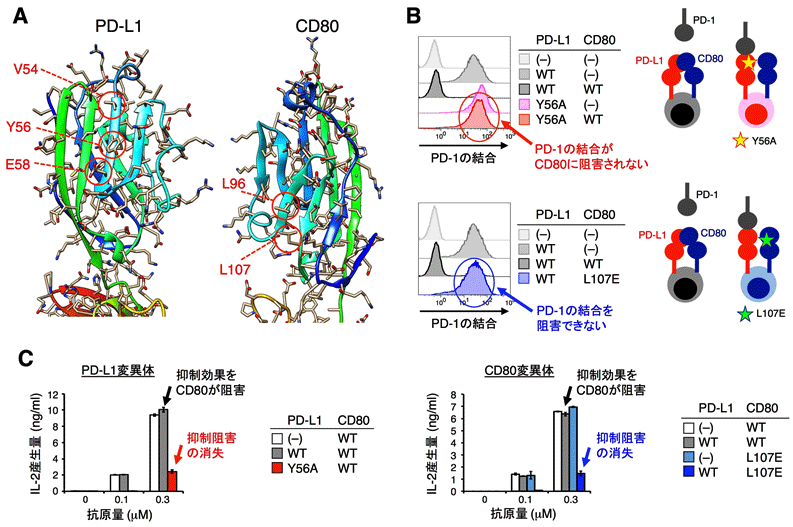
図2:PD-L1と結合できないCD80変異体とCD80に結合できないPD-L1変異体の作製
(B)PD-L1の56番目のチロシンをアラニンに置換した変異体(Y56A)は、同一細胞上にCD80が発現していてもPD-1と結合することができる(上段、赤)。CD80の107番目のロイシンをグルタミン酸に置換した変異体(L107E)は、PD-L1とPD-1の結合を邪魔することができない(下段、青)。
(C)PD-L1変異体(Y56A)は、同一細胞上にCD80が発現していてもPD-1を介してT細胞の活性化を抑制し、IL-2の産生量を減少させる(左、赤)。CD80変異体(L107E)は、PD-L1がPD-1を介してT細胞の活性化を抑制することを阻害できない(右、青)。
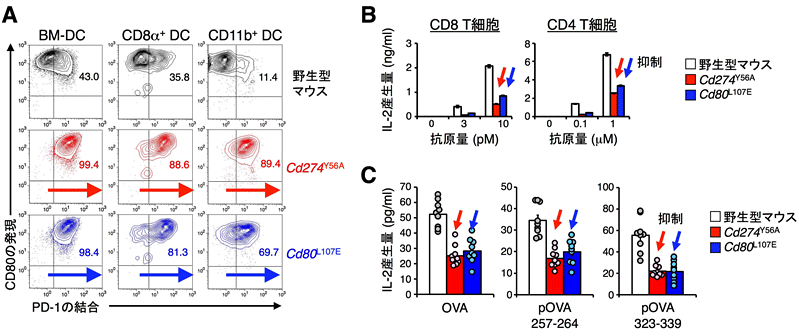
図3:PD-L1変異体およびCD80変異体ノックインマウスの樹状細胞はPD-1を介してT細胞の活性化を強力に抑制する
(B)Cd274Y56AおよびCd80L107Eマウスの骨髄細胞から誘導した樹状細胞を用いて卵白アルブミン応答性のCD8陽性およびCD4陽性T細胞を刺激すると、いずれの活性化もPD-1によって抑制され、IL-2の産生量が減少する(赤、青)。
(C)卵白アルブミンをマウスに免疫し、卵白アルブミンに特異的な免疫応答を誘導すると、Cd274Y56AおよびCd80L107Eマウスでは、卵白アルブミンに特異的な免疫応答の誘導が抑制される(赤、青)。
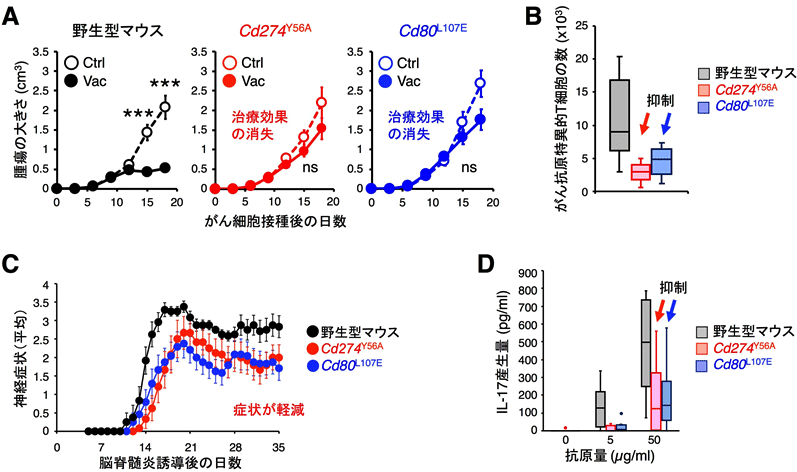
図4:PD-L1とCD80のシス結合がおこらないマウスでは、がん免疫応答と自己免疫応答が顕著に減弱する
(B)(A)において、がん抗原に特異的なT細胞の誘導が、Cd274Y56AおよびCd80L107Eマウスでは顕著に障害される。
(C)マウスに自己抗原を免疫して、ヒトの自己免疫疾患である多発性硬化症に類似した症状を誘導すると、野生型マウスと比較して、Cd274Y56AおよびCd80L107Eマウスでは症状が有意に軽減される(赤、青)。(D)(C)において、自己抗原に応答してIL17を産生するT細胞の誘導がCd274Y56AおよびCd80L107Eマウスでは顕著に障害される
研究成果の意義・今後の展望
本研究によって、T細胞が抗原提示細胞によって活性化される段階において、CD80がCD28の副刺激を活性化するが、他方ではPD-1による抑制シグナルを阻害するという巧妙なメカニズムの存在することが解明されました。ほとんどのがん細胞や臓器の実質細胞ではCD80が発現していないため、がん細胞や各種臓器の実質細胞に対するT細胞応答はPD-1により抑制されると考えられます(図5)。すなわち、PD-1あるいはPD-L1に対する抗体を用いたがん免疫療法では、PD-1による抑制作用が解除された結果、がん細胞は活性化されたT細胞の攻撃を受けて排除されます。しかし、自己抗原に特異的なT細胞が活性化されてしまうと、自己組織が破壊され、副作用として自己免疫疾患を発症します。
本研究は、PD-1は感染免疫応答などの生体にとって有益な免疫応答を抑制せずに、自己免疫疾患につながる免疫応答やがん免疫応答を選択的に抑制するメカニズムを解明したことから、新たな自己免疫疾患の治療法開発につながることが期待されます。
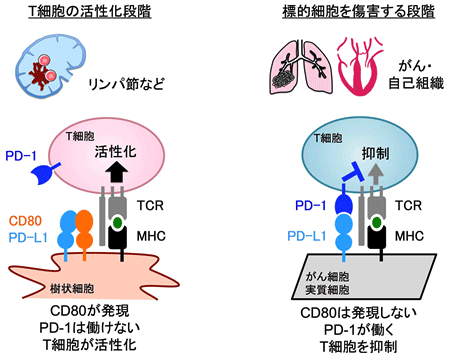
図5:今回の発見の模式図
用語解説
- [1]免疫補助受容体
- T細胞やB細胞の細胞表面に発現し、抗原受容体が抗原を認識することで活性化されるシグナルを増強あるいは抑制する分子のこと。興奮性免疫補助受容体の代表例にCD28やICOS、抑制性免疫補助受容体の代表例にPD-1やCTLA-4がある。抑制性免疫補助受容体を免疫チェックポイント分子と呼ぶことがある。
- [2]リガンド
- 特定の受容体の特定の結合部位に特異的に結合する物質のこと。一般的に、リガンドが受容体に結合すると細胞へシグナルが伝達され、細胞機能の発動、細胞増殖、遺伝子発現などの応答が起こる。
- [3]抗原提示細胞
- T細胞は抗原受容体(T cell receptor、TCR)を用いて、細胞表面にある主要適合組織遺伝子複合体(major histocompatibility complex、MHC)が提示する抗原ペプチドを認識する。T細胞に抗原を提示し、T細胞を活性化する能力を有する細胞を総称して、抗原提示細胞と呼ぶ。抗原提示細胞の代表例に樹状細胞、ランゲルハンス細胞、B細胞、マクロファージなどがある。
- [4]ゲノム編集
- ゲノムDNAの塩基配列を人為的に改変する方法。
- [5]ノックインマウス
- 標的遺伝子に目的とする遺伝子変異を導入したマウス
発表論文
- 論文名:
- “Restriction of PD-1 function by cis-PD-L1/CD80 interactions is required for optimal T cell responses”
- 著者名:
- Daisuke Sugiura1, Takumi Maruhashi1, Il-mi Okazaki1, Kenji Shimizu1, Takeo K. Maeda1, Tatsuya Takemoto2, Taku Okazaki1*(*責任著者)
- 所属:
- 1徳島大学先端酵素学研究所免疫制御学分野
- 2徳島大学先端酵素学研究所発生生物学分野
- 雑誌名:
- Science
特記事項
本研究は、革新的バイオ医薬品創出基盤技術開発事業「多機能複合分子標的物質の作製による細胞運命操作技術の開発」(文部科学省(2014年度)、日本医療研究開発機構(AMED)(2015年度以降))、戦略的創造研究推進事業CREST(科学技術振興機構)、新学術領域研究「シンギュラリティ生物学」などの支援を受けて行われました。
お問い合わせ先
研究に関すること
岡崎 拓(おかざき たく)
徳島大学 先端酵素学研究所 免疫制御学分野 教授
報道に関すること
徳島大学総務部総務係
革新的バイオ医薬品創出基盤技術開発事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課