2019-04-25 理化学研究所,科学技術振興機構
理化学研究所(理研)環境資源科学研究センターバイオ高分子研究チームのモニルル・イスラム特別研究員(研究当時)、小田原真樹研究員、沼田圭司チームリーダーらの共同研究チーム※は、機能性ペプチドを用いることによって、巨大プラスミドDNA[1]を高効率かつ低ダメージ、そして従来法より簡便に大腸菌細胞内に導入できることを確認しました。
本研究成果は、微生物における物質生産に向けた遺伝子クラスターの導入や、人工細胞の創製に向けた染色体DNAの細胞内への導入に貢献すると期待できます。
従来のエレクトロポレーション法は、電気パルスで細胞膜に孔を開けることで、巨大なDNAを細胞内に導入する方法です。しかし電気パルスが強すぎると細胞へのダメージが大きいため、細胞種に応じた条件の最適化が必要といった欠点があります。
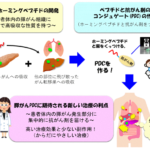
今回、共同研究チームは、細胞膜透過性ペプチド[2]とポリカチオン性ペプチド[3]を融合した機能性ペプチドを用いて、細胞内導入に通常用いられるプラスミドDNA(10kb程度)よりはるかに巨大な205kbのプラスミドDNAの大腸菌細胞内への導入を試みました。その結果、巨大プラスミドDNAをエレクトロポレーション法に匹敵する効率で細胞に導入することに成功し、導入したプラスミドDNAの損傷や分解も少ないことが明らかになりました。また、導入したプラスミドDNA上のレポーター遺伝子[4]からタンパク質が産生されていることも確認され、大腸菌細胞内で機能していることが証明されました。
本研究は、米国の科学雑誌『ACS Synthetic Biology』のオンライン版(4月22日付け:日本時間4月23日)に掲載されました。

図 機能性ペプチドによる巨大プラスミドDNAの大腸菌細胞内への導入
※共同研究チーム
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム
チームリーダー 沼田 圭司(ぬまた けいじ)
特別研究員(研究当時) モニルル・イスラム(Md Monirul Islam)
研究員 小田原 真樹(おだはら まさき)
上級研究員(研究当時) 吉積 毅(よしづみ たけし)
研究員 及川 和聡(おいかわ かずさと)
研究員(研究当時) 木村 光宏(きむら みつひろ)
立教大学 理学部
准教授 末次 正幸(すえつぐ まさゆき)
※研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による支援を受けて行われました。
背景
遺伝子改変や合成生物学は、生物における有用物質の生産など、応用のさまざまな場面において重要な貢献をしています。その最初のステップは、外来遺伝子の効率的かつ安定的な細胞への導入です。しかし、細菌から哺乳動物細胞にわたる幅広い細胞種に、遺伝子を効率的に導入できる手法はまだ開発されていません。
近年、DNA改変技術の進歩に伴い、巨大なDNAの構築が可能になってきており、細胞への多数遺伝子の導入やゲノムをまるごと改変する合成生物学的手法への応用が期待されています。しかし、巨大DNAは実験操作によって切断しやすく、その大きさから細胞内への導入効率も極端に低いことから、安定した導入が困難でした。
電気パルスで細胞膜に孔を開けて物質を導入するエレクトロポレーション法は、細菌から哺乳動物細胞まで広く使われています。しかし、同法は巨大なDNAを細胞に導入することが可能である一方、細胞種に応じて電気パルスの強度や時間を最適化しなければ細胞が損傷してしまうといった欠点があります。同法のほか、細菌では熱ショック法[5]による遺伝子導入が簡便で一般的ですが、サイズが大きいDNAの導入には不向きです。また、これらの方法はいずれも細胞の事前処理が必要です。
沼田チームリーダーらは、これまで細胞膜透過性ペプチドを用いた遺伝子導入法の開発を進めてきました。この方法は細菌から動植物細胞に至るまで広く適用できることが明らかになっており注1~3)、DNAの損傷や分解も少ない注4)ことから、損傷しやすい巨大DNAの導入に有利であると考えられます。
注1)2015年1月15日「植物ミトコンドリアへ選択的に遺伝子導入する手法を開発」
注2)2018年7月20日プレスリリース「多様な植物に侵入するペプチドの探索」
注3)2019年1月22日プレスリリース「ペプチドによる遺伝子送達には植物の構造的脆弱性が重要」
注4)Numata, K., Kaplan, D. L., Biomacromolecules 2010, 11 (11), 3189-3195
研究手法と成果
共同研究チームはまず、細胞膜透過性ペプチドとDNAとの相互作用が期待されるポリカチオン性ペプチドを融合させた機能性ペプチド(KH)9-BP100を、通常(10kb程度)よりはるかに大きい巨大プラスミドDNA(205kb(キロ塩基対))と混合することにより、ペプチド-DNA複合体形成を行いました(図1)。ペプチドのアミノ基(-NH2)とDNAのリン酸基(H2PO4-)の比率を変化させた結果、約250~500ナノメートル(nm、1nmは10億分の1メートル)のさまざまな大きさの複合体が形成されました。
これらの複合体を用いて、巨大プラスミドDNAを大腸菌細胞内へ導入することに成功しました(図1)。そして、ペプチドとDNAの混合比率を調整することで、この方法によって平均約7CFU[6]の導入効率が達成されました。これは熱ショック法を用いた巨大DNAの導入(約1CFU)よりも有意に高く、エレクトロポレーション法(約9CFU)にも匹敵します。さらに、この方法ではエレクトロポレーション法で必要な電気パルスの強度・時間の最適化といった手順や細胞の事前処理が不要であることから、より簡便に巨大DNAを導入することができます。
また、パルスフィールドゲル電気泳動法[7]で解析した結果、大腸菌に導入された巨大プラスミドDNAに損傷や分解は見られませんでした。
次に、導入した巨大プラスミドDNAが大腸菌細胞内で機能していることを確認するため、共焦点レーザー顕微鏡[8]を用いて、巨大プラスミドDNAにコードされているレポーター蛍光タンパク質mCherryを観察しました。その結果、巨大プラスミドDNAを導入した大腸菌からはmCherryタンパク質に由来する強い蛍光が観察され、導入した巨大プラスミドDNAから遺伝子が発現していることが証明されました(図2)。
今後の期待
本研究で、機能性ペプチドを用いることにより、巨大なDNAを損傷や分解が少なく大腸菌内に効率的に導入できることが明らかになりました。
今回明らかにした導入法によって、さまざまな細菌に巨大なDNAを導入することが可能となり、微生物を使った物質生産に向けた遺伝子クラスターの導入や、人工細胞の創製に向けた染色体DNAの細胞内への導入など、合成生物学や応用生物学の研究が加速すると期待できます。
原論文情報
- Md Monirul Islam, Masaki Odahara, Takeshi Yoshizumi, Kazusato Oikawa, Mitsuhiro Kimura, Masayuki Su’etsugu, Keiji Numata, “Cell-penetrating peptide-mediated transformation of large plasmid DNA into Escherichia coli”, ACS Synthetic Biology, 10.1021/acssynbio.9b00055
発表者
理化学研究所
環境資源科学研究センター バイオ高分子研究チーム
特別研究員(研究当時) モニルル・イスラム(Md Monirul Islam)
研究員 小田原 真樹(おだはら まさき)
チームリーダー 沼田 圭司(ぬまた けいじ)
報道担当
理化学研究所 広報室 報道担当
科学技術振興機構 広報課
JST事業に関すること
科学技術振興機構 研究プロジェクト推進部
内田 信裕(うちだ のぶひろ)
補足説明
-
- プラスミドDNA
- 細菌や酵母の細胞質中に存在し、染色体DNAからは独立して自律的に複製されるDNA分子の総称。環状の構造を持ち、単独では細胞内に移行しにくい。
-
- 細胞膜透過性ペプチド
- 細胞膜を透過して細胞内へ移行することができるペプチドの総称。10~100個ほどのアミノ酸からなる。
-
- ポリカチオン性ペプチド
- 正に帯電したアミノ酸であるリジンなどが10~20残基程度つながったペプチド。
-
- レポーター遺伝子
- 解析したい遺伝子の発現を簡便に検出、定量する目的で利用される遺伝子のこと。
-
- 熱ショック法
- 2価陽イオンで前処理した大腸菌に42℃程度の熱を加えることで、細胞内にDNAを導入する方法。
-
- CFU
- 1マイクログラム(μg、1μgは100万分の1グラム)のDNAを導入した際に得られるコロニー(1細菌に由来する細胞集団)の数。CFUはColony Forming Unitの略。
-
- パルスフィールドゲル電気泳動法
- アガロースゲル電気泳動(電場をかけてアガロースゲル内を移動させることにより、DNAを長さに応じて分離する方法)の電場を変化させることにより、通常のアガロースゲル電気泳動では分離できない巨大なDNAを分離する方法。
-
- 共焦点レーザー顕微鏡
- 高解像度の蛍光画像を取得できる顕微鏡。光軸方向と二次元走査型の情報を組み合わせることで、立体イメージも構築できる。

図1 大腸菌に導入された巨大プラスミドDNAの評価
大腸菌に導入された205kbの巨大プラスミドDNAを抽出し、未処理(上)と制限酵素処理したもの(下)をそれぞれパルスフィールドゲル電気泳動法にて分離した。機能性ペプチドによって導入された巨大プラスミドDNA(N/P ratio 0から1)は、元の巨大プラスミド(PC)やエレクトロポレーション法によって導入されたもの(E)と同様のバンドパターンを示す。

図2 蛍光タンパク質mCherryの観察
巨大プラスミドDNAを導入した大腸菌(a)と導入していない大腸菌(b)における、レポーター蛍光タンパク質mCherryに由来する赤い蛍光を共焦点レーザー顕微鏡によって観察した。これにより、導入した巨大プラスミドDNAが大腸菌細胞内で機能していることが確認された。