タウタンパク質の凝集と脳の萎縮を加速する
2019-06-04 理化学研究所
理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの橋本翔子基礎科学特別研究員、斉藤貴志副チームリーダー、西道隆臣チームリーダーらの研究チームは、「CAPON」というタンパク質がアルツハイマー病の悪性化に関わることを発見しました。
本研究成果により、今後、新たなCAPONの機能を阻害するような薬剤(手法)[1]が開発されれば、アルツハイマー病の進行を抑制できると期待できます。
アルツハイマー病の病理形成機構としては、アミロイドβペプチド(Aβ)[2]の沈着(アミロイド病理)が引き金となって、タウタンパク質[3]が凝集する神経原線維変化[3](タウ病理)の形成、神経細胞死に至るという「アミロイドカスケード仮説」が支持されています。しかし、アミロイド病理からタウ病理、神経細胞死への遷移機構は不明でした。
今回、研究チームはインタラクト―ム解析[4]により、CAPONがタウタンパク質と結合することを見いだしました。そして、ヒトのアミロイド病理を再現するモデルマウスの脳でCAPONを強制発現させると、タウ病理と神経細胞死に伴う脳の萎縮が促進されること、逆に、タウ病理と神経細胞死を再現するモデルマウスでCAPON遺伝子を欠損させると、脳の萎縮が抑制されることが明らかになりました。このことから、CAPONはアミロイド病理下において、タウ病理、神経細胞死を誘導する重要な因子であると考えられます。
本研究は、英国のオンライン科学雑誌『Nature Communications』(6月3日付け)に掲載されました。
※研究支援
本研究は、アステラス製薬株式会社との共同研究、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」などによる支援を受けて行われました。
背景
日本では高齢化に伴って認知症患者数が急増しており、厚生労働省の推計によると、2026年には65歳以上の5人に1人が認知症に罹患すると算定されています注1)。なかでも、アルツハイマー型認知症(アルツハイマー病、AD)は、認知症患者のうち半数以上を占めるため、早急な治療・予防法の確立が求められています。
ADの病理形成機構としては、脳内の神経細胞外でアミロイドβペプチド(Aβ)が凝集・沈着する老人斑(アミロイド病理)が引き金となって、微小管結合タンパク質の一つであるタウタンパク質がリン酸化されて、細胞質中で線維化・凝集する神経原線維変化(タウ病理)の形成、神経細胞死に至るという「アミロイドカスケード仮説」が支持されています。しかし、アミロイド病理からタウ病理形成、神経細胞死への遷移機構は不明でした。
西道チームリーダーらは、2014年にノックイン技法[5]を用いて、アミロイド病理を再現する「AppNL-G-Fノックインマウス[6]」という新しいADモデルマウスを作製していました注2)。そこで、研究チームはこのマウスを用いて、タウ病理形成、神経細胞死への遷移機構の解明を試みました。
注1)厚生労働省 認知症施策推進総合戦略(新オレンジプラン)~認知症高齢者等にやさしい地域づくりに向けて~
注2)2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
研究手法と成果
研究チームはまず、タウ病理形成に関わるタンパク質を調べるために、インタラクトーム解析を行った結果、CAPON(C-terminal PDZ ligand of nNOS[7])というタンパク質がタウタンパク質に結合することを見いだしました。CAPONはnNOS(神経型一酸化窒素合成酵素)と結合し、NMDA受容体[8]を介した興奮毒性などに関わることなどが知られていましたが、ADにおける機能は不明でした。
そこで、アミロイド病理を再現するAppNL-G-Fノックイン(KI)マウスの脳において、CAPONの発現を解析したところ、海馬[9]の錐体細胞層にCAPONが蓄積していることが分かりました。AD患者の脳でも同様であることが報告されている注3)ことから、アミロイド病理下におけるCAPONの海馬での蓄積がその後のAD病理に影響を及ぼすと考えられます。
次に、マウスでヒトの脳と同じ様式でタウタンパク質を発現するMAPT KIマウス(ヒト型タウKIマウス)を作製しました。そして、AppNL-G-F KIマウスとMAPT KIマウスを掛け合わせたダブルKIマウスにおいて、アデノ随伴ウイルスベクター[10]を用いてCAPONを過剰発現させました。すると、タウ病理および神経細胞死が誘導され、海馬が萎縮することが分かりました(図1)。
さらに、どのような機構で神経細胞死が誘発されるのか調べたところ、プログラムされた細胞死のアポトーシス[11]マーカーだけではなく、炎症性細胞死のパイロトーシス[12]マーカーの上昇も認められました。このことから、単一の経路ではなく、複雑なメカニズムを経て神経細胞死が誘発されると考えられます。
また、タウ病理と神経細胞死を再現するP301S-タウトランスジェニックマウス[13](P301S-Tau-Tg)において、CAPON遺伝子をノックアウト(欠損)すると、脳の萎縮が抑制されることが分かりました(図2)。
以上の結果から、CAPONはアミロイド病理下において、タウ病理、神経細胞死を誘導する重要な因子であると考えられます。
注3)Masakazu Hashimoto et al, “Analysis of microdissected neurons by 18O mass spectrometry reveals altered protein expression in Alzheimer’s disease” J. Cell. Mol. Med. Vol 16, No 8, 2012 pp. 1686-1700
今後の期待
本研究において、CAPONがADにおけるタウ病理形成・神経細胞死の促進に重要な役割を果たすことが明らかになりました。今後、CAPON機能を阻害する方法を開発できれば、ADの新しい治療法となると期待できます。
また今回、新たに発表したMAPT KIマウスは、ヒトの脳と同じ様式でタウタンパク質を発現することから、今後のAD研究において有用なツールとなると期待できます。
原論文情報
Shoko Hashimoto, Yukio Matsuba, Naoko Kamano, Naomi Mihira, Naruhiko Sahara, Jiro Takano, Shin-ichi Muramatsu, Takaomi C. Saido, and Takashi Saito, “Tau binding protein CAPON induces tau aggregation and neurodegeneration”, Nature Communications, 10.1038/s41467-019-10278-x
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
基礎科学特別研究員 橋本 翔子(はしもと しょうこ)
副チームリーダー 斉藤 貴志(さいとう たかし)
チームリーダー 西道 隆臣(さいどう たかおみ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- CAPONの機能を阻害するような薬剤(手法)
- これまでに、shRNAやアンチセンスオリゴヌクレオチドにより遺伝子発現を抑制する治療、遺伝子を破壊する遺伝子治療、CAPONとnNOSなどのタンパク質との相互作用(protein-protein interaction: PPI)を阻害する治療などが開発されている。
-
- アミロイドβペプチド(Aβ)
- アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。アルツハイマー病で見られるアミロイド斑(老人斑)の構成成分として発見されたことから、Aβの過剰な蓄積がアルツハイマー病発症の引き金と考えられている。
-
- タウタンパク質、神経原線維変化
- タウタンパク質は、MAPT遺伝子から発現する微小管結合タンパク質。アルツハイマー病においては、リン酸化されたタウタンパク質が、神経細胞内に蓄積して神経原線維変化を形成する。タウタンパク質の蓄積は、神経細胞死と深く関係していると考えられている。
-
- インタラクト―ム解析
- 特定のタンパク質と相互作用するタンパク質を、免疫沈降法などにより抽出し、質量分析によって網羅的に同定する解析方法。
-
- ノックイン技法
- 遺伝子組換え法の一つで、標的遺伝子の目的とする塩基のみを置換する方法。トランスジェニックのように過剰発現を行わず、また、ノックアウトのように遺伝子を欠損させることもない。
-
- AppNL-G-Fノックインマウス
- 家族性アルツハイマー病変異を含むアミロイド前駆体タンパク質(App)遺伝子のノックインマウス。アミロイド病理を再現する。
-
- nNOS
- 神経型一酸化窒素合成酵素。神経細胞において一酸化窒素(NO)を合成する酵素。NOの合成を介して、神経細胞の機能維持や神経細胞死を制御する。
-
- NMDA受容体
- 神経伝達物質グルタミン酸の受容体の一種。グルタミン酸が結合すると、ナトリウムイオン(Na+)やカルシウムイオン(Ca2+)を細胞外から取り込み、神経細胞を興奮させる。カルシウムイオン透過性の特徴により、神経細胞間の情報伝達の効率が変化するシナプス可塑性に関わるとされる。
-
- 海馬
- 脳の中で、記憶をつかさどる領域。解剖学的には大脳新皮質の内側に位置し、タツノオトシゴに似た形をしていることから「海馬」(タツノオトシゴの別名)と呼ばれる。
-
- アデノ随伴ウイルスベクター
- 動物個体への遺伝子導入に適したウイルスベクター。とくに神経細胞などの非分裂細胞において長期間安定な目的遺伝子発現を可能にする。
-
- アポトーシス
- プログラムされた細胞死を指し、生理的には個体の正常な発生に必要であり、またがん化した細胞などの除去の目的でも積極的に引き起こされる。
-
- パイロトーシス
- 炎症誘導性のプログラム細胞死。カスパーゼ1を介した炎症性サイトカインの分泌によって細胞死を引き起こす。
-
- トランスジェニックマウス
- 特定の遺伝子の機能や発現パターンを解析することを目的として、種々の遺伝子操作を行い、外来性遺伝子を導入したマウス。DNA断片を受精卵にマイクロインジェクションで導入して作製する。
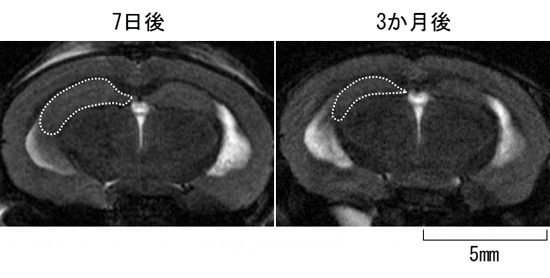
図1 CAPON過剰発現マウス脳のMRI画像
AppNL-G-F KIとMAPT KIのダブルノックインマウスに、アデノ随伴ウイルスを用いてCAPON遺伝子を過剰発現させ、7日後と3カ月後にMRIの撮像を行った。CAPONを過剰発現させて3カ月経つと、有意に海馬が萎縮していることが認められた。
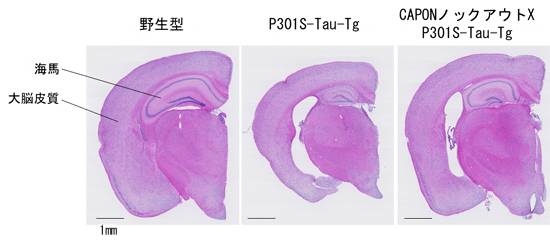
図2 CAPONノックアウトX P301S-Tau-Tgマウスの脳
右の画像は、CAPONノックアウトマウスとP301S-Tau-Tgマウスを掛け合わせたマウスの脳切片(H&E染色画像)。P301S-Tau-Tgマウス(中央の画像)で見られる脳の萎縮が、CAPONの欠損によって有意に抑制されていることが分かる。また右画像では、神経細胞死が起きて白く見える部分が減少し、かつ海馬や大脳皮質の大きさや厚みが中央画像ほど縮小していないことが分かる。


