2019-07-04 京都大学iPS研究所
ポイント
- iPS細胞を用いて、免疫細胞の一つであるNatural killer(NK)細胞注1を無血清条件で誘導する分化系を構築した。
- 誘導したNK細胞は、形態並びに表面マーカーにおいて末梢血NK細胞と相違ない表現型を示した。
- 試験管内でも生体内でも、白血病細胞株に対して殺傷害能を示した。
- iPS細胞を用いたNK細胞療法への応用が期待される。
1. 要旨
松原弘幸大学院生(京都大学CiRA臨床応用研究部門、大学院医学研究科)、齋藤潤教授(京都大学CiRA同部門)らの研究グループは、iPS細胞から他動物由来成分を含まない臨床応用可能な方法で免疫細胞の一つであるNatural killer細胞の誘導に成功しました。
この研究成果は2019年4月2日に米国科学誌『Biochemical and Biophysical Research communications』に掲載されました。
2. 研究の背景
NK細胞やT細胞を含む免疫細胞を用いた養子免疫療法が次世代の治療法として期待されています。中でも、自然免疫系に属するNatural Killer (NK)細胞は、主要組織適合抗原 (Major histocompatiblity complex; MHC)による拘束下でのみ活性を持つT細胞と異なりMHC非依存的に傷害活性を発揮することから、先行するT細胞療法を補完する手段として期待されています。
治療用のNK細胞を準備する手段として、これまでは末梢血からNK細胞を単離し、K562白血病細胞株との共培養や、膜型IL-15、IL-21、坑腫瘍抗体ダサチニブによる刺激などにより増幅する方法が用いられてきました。しかしこれらの方法では、NK細胞の細胞傷害活性が体外増幅中に低下するなどの理由により、機能的なNK細胞を十分量まで増幅することが困難という弱点も指摘されていました。
近年、そうした課題への解決策として、無限の増殖能と多能性を有するヒト多能性幹細胞 (human pluripotent stem cell: hPSC)からNK細胞(hPSC-NK細胞)を分化誘導する方法が注目を浴びるようになりました。しかし、これまでの報告にある手法ではやはり白血病由来細胞株や他動物由来の血清含有培地を使用しており、培養の安定性や未知の感染源汚染の危険性などの観点から克服すべき課題もありました。そこで本研究では、それらの課題を克服し異種動物成分を含まない臨床応用可能な条件で、hPSC-NK細胞を高効率に誘導することを試みました。
3. 研究結果
1) ヒト多能性幹細胞からNK細胞への誘導
複数のhPSC株を二次元培養し、造血発生に働く数種類のサイトカインの組み合わせを順次変更しながら投与することにより、NK (hPSC-NK) 細胞へ段階的に分化誘導を試みました。その際、従来法である血清入り培地(DMEM+AB-Serum; DM+S)と、臨床にも応用可能な無血清培地(Stem Line II; ST)の2通りでNK細胞への分化効率および機能を比較検討しました。まず先行研究と同様のサイトカインを用いてhPSC-NK細胞を誘導したところ、いずれの基礎培地を用いてもNK細胞マーカーであるCD56陽性の細胞を誘導できることが確認できましたが、陽性率が低く(7.12±1.20%; DM+S, 26.40±6.28%; ST) (図1A)、ギムザ染色を用いて細胞形態を観察するとNK細胞以外の骨髄球系細胞が多数混在していました(図1B)。
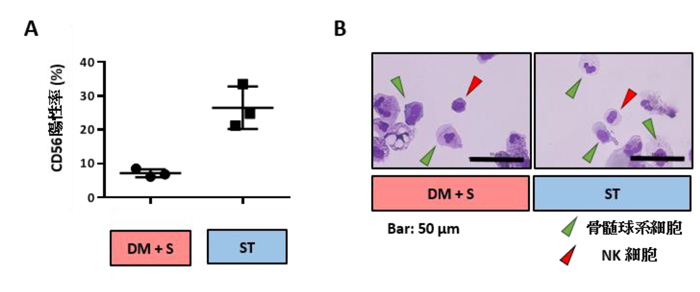
図1: ヒト多能性幹細胞から誘導した血液細胞
A. ヒト多能性幹細胞から分化誘導した血液細胞のフローサイトメトリー解析。
NK細胞マーカーであるCD56陽性の細胞への分化効率を確認した。
B. メイギムザ染色像による誘導した血液細胞の形態評価
2) IL-3はNK細胞への分化効率を阻害する
そこで、NK細胞への選択的誘導効率を高めるため、骨髄球系譜への分化を促進する作用が知られるIL-3を除去して分化効率を検討してみました。すると、基礎培地の血清の有無にかかわらず、CD56陽性率を著明に向上させることが出来ました(87.27±4.52%; DM+S, 87.40±0.61%; ST)。このことは、iPS細胞を用いた今回の分化系においてIL-3はNK細胞の誘導に必須でなく、むしろ選択的分化の効率を下げる方向へ働くことを示唆しています。
この、IL-3を含まない新たな条件で誘導されたNK細胞の表面には、NKG2A(抑制性受容体)やNKG2DやNKp44(活性受容体)などNK細胞の機能に関わる重要な蛋白質が発現していることも確認できました。形態的にも直径10-20μmで核 / 細胞質比が小さく、クロマチン網工は粗荒で細胞内顆粒を有するなど、NK細胞の特徴をよく示していました。
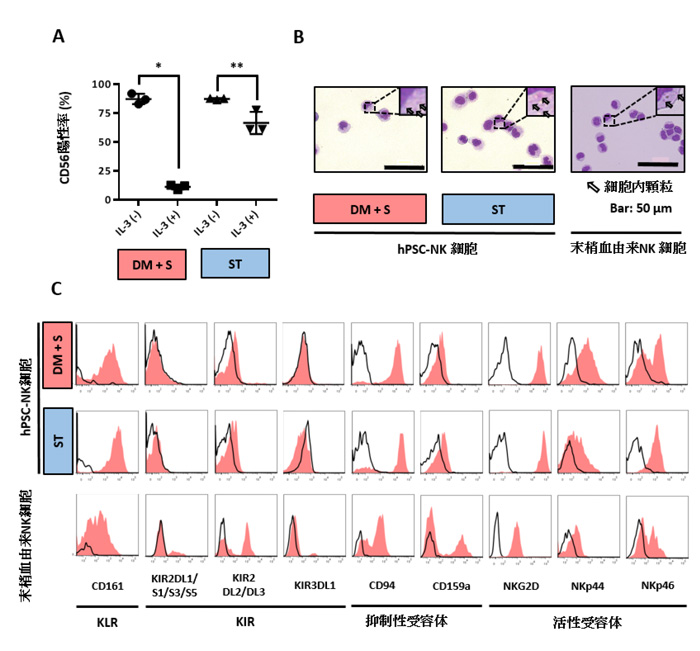
図2: hPSC-NK細胞の形態・表面マーカー解析
A. ヒト多能性幹細胞から分化誘導した血液細胞のフローサイトメトリー解析。NK細胞マーカーであるCD56陽性の細胞への分化効率を確認した。
B. メイギムザ染色像によるNK細胞の成熟評価。左:hPSC-NK細胞(血清入り条件) 中央:hPSC-NK細胞(臨床応用可能条件) 右:末梢血由来NK細胞。いずれの細胞も腫瘍細胞を攻撃する酵素(グランザイム・パーフォリン)を含むアズール顆粒が存在している。
C. NK細胞特異的表面マーカーの発現プロファイル
3) 無血清条件で誘導したhPSC-NK細胞の細胞傷害活性
最後に、hPSC-NK 細胞の機能を評価しました。まず、51Crで標識した白血病細胞株K562細胞とhPSC-NK細胞を試験管内で混合し、37℃で培養しました。4時間後、K562細胞からの51Cr放出を指標にPSC-NK細胞の細胞溶解活性を測定したところ、分化誘導に用いた基礎培地の血清の有無にかかわらず、同程度(25.4%; DM+S, 23.3%; ST)の活性を示しました (図3A)。またK562細胞とhPSC-NK細胞を免疫不全マウス(NOGマウス)に移植(図3B)したところ、hPSC-NK細胞はK562の生体内での腫瘍増殖を抑制し(図3C)、治療によるマウス寿命の延長も観察できました(図3D)。
これらの結果から、本研究により無血清条件下に誘導したhPSC-NK細胞は試験管内でも生体内でも白血病細胞株に対する細胞障害能を発揮することがわかりました。
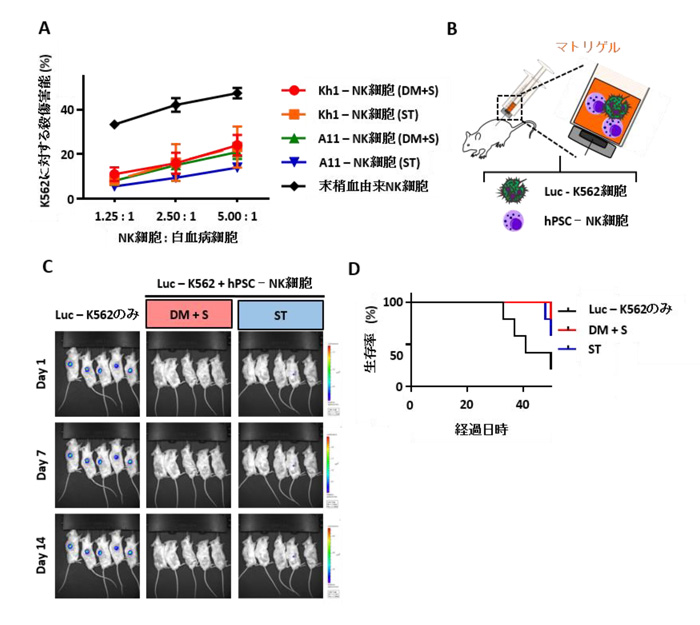
図3: hPSC-NK細胞の機能解析
A. hPSC-NK細胞の白血病細胞株に対する殺傷害能。
B. 移植実験の概略図
C. 移植後マウス体内のK562白血病細胞(Luciferaseによる発光反応の観測)。
D. hPSC-NK細胞を移植した条件では、マウス寿命が延長している。
4. まとめ
本研究では、異種動物成分を含まない臨床応用可能な培地を用い、hPSCからNK細胞を誘導することに成功しました。作製したhPSC-NK細胞は、形態・表面マーカーいずれも末梢血NK細胞に同様で、白血病細胞株に対する細胞傷害活性も確認できました。本法は今後、NK細胞を用いた将来の免疫療法の確立、およびNK細胞の関与する疾患のモデル構築に応用可能であると考えられます。
5. 論文名と著者
- 論文名
“Induction of Human Pluripotent Stem Cell-Derived Natural Killer Cells for Immunotherapy under chemically defined conditions” - ジャーナル名
Biochemical and Biophysical Research Communications - 著者
Hiroyuki Matsubara1,2*, Akira Niwa1**, Tatsutoshi Nakahata1, and Megumu K. Saito1**
*筆頭著者
**責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所
- 京都大学総合医療開発リーダー育成プログラム(LIMS)
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED再生医療実現拠点ネットワークプログラムiPS細胞研究中核拠点
- AMED再生医療実現拠点ネットワークプログラム・疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
- 京都大学総合医療開発リーダー育成プログラム(LIMS)
7. 用語説明
注1)Natural killer (NK)細胞
ナチュラルキラー(Natural Killer; NK)細胞は自然免疫細胞の一つで、事前の抗原特異的刺激または主要組織適合抗原(MHC)に制限された細胞傷害なしに、Fasリガンド経路およびパーフォリン・グランザイム分泌によって腫瘍細胞に対する細胞傷害性を示すことが知られている。


