2019-07-23 国立病院機構鈴鹿病院,横浜市立大学,名古屋大学,愛知医科大学,日本医療研究開発機構
国立病院機構鈴鹿病院 脳神経内科 曽根 淳第二脳神経内科医長、横浜市立大学 学術院医学群遺伝学 松本直通教授、名古屋大学医学系研究科 祖父江元 特任教授(愛知医科大学理事長)らの研究グループは、近年、皮膚生検による診断が可能となったことで症例数が急激に増加している、神経核内封入体病(Neuronal intranuclear inclusion disease : NIID)の原因遺伝子を明らかにしました。
研究成果のポイント
- 神経核内封入体病(NIID)の原因がヒト特異的遺伝子NOTCH2NLCのGGCリピート伸長であることを発見
- 遺伝病の原因遺伝子解明におけるロングリード・シークエンサーの有用性を実証
- 同定されたリピート伸長の簡便な検出法も開発、診断への活用に期待
概要
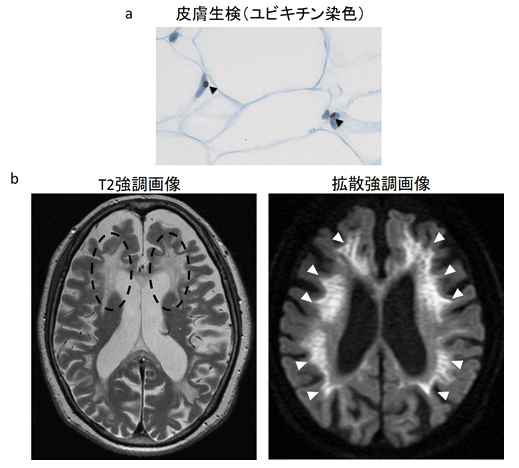
神経核内封入体病(以下NIID)は、大脳や脊髄、末梢神経といった神経組織や一般臓器の細胞核に広く「封入体*1」と呼ばれる異物の存在が認められる難病で、症状としては、四肢の筋力低下あるいは認知症などの高次脳機能障害がみられ、常染色体優性遺伝性*2が疑われる疾患です。NIIDは、長い間、死後の病理解剖でのみ診断が可能で、病態など不明な点が多い疾患でしたが、2011年に曽根医師らが皮膚生検による診断が可能であることを発見、報告したのちに患者数が顕著に増加しています。特に、高齢で認知症を発症する例の報告が多いことから、認知症患者の一定の割合をNIIDの患者が占めているものと推察されています。
本研究グループは、NIIDの原因遺伝子探索研究を2005年に開始しました。四肢筋力低下で発症したNIID大家系*3においてマイクロサテライトマーカーを用いた連鎖解析*4を行った結果、すぐに責任領域(原因遺伝子が存在する領域)を1番染色体1p22.1-q21.3領域にまで絞り込むことに成功しました。この領域をさらに検討するため、ショートリード型次世代シークエンサーを用いた全エクソーム解析および全ゲノム解析を行いましたが、原因となる遺伝子変異は同定できませんでした。しかし、この全ゲノム解析で得られた一塩基多型(SNV)(標準的な塩基配列と比較して塩基が一つ入れ替わる変化のことで多様性の一つ)情報を用いて連鎖解析を再検討したところ、マイクロサテライトマーカーを用いた連鎖解析とほぼ同じ結果が得られたことから、NIIDの原因遺伝子が、1番染色体1p22.1-q21.3領域に存在することは間違いないが、ショートリード型次世代シークエンサーでは解析が困難な遺伝子変異、たとえば繰り返し配列(リピート)の延長や、大規模な遺伝子の欠失あるいは挿入が原因となっていると推察されていました(図1)。
その後、ロングリード・シークエンサー*5が登場しました。このシークエンサーは、1万塩基以上の長いDNA塩基配列*6を読むことができる新しい技術であり、リピートの判別や、従来の方法が苦手とするG(グアニン)および C(シトシン)の比率の多い配列の解読にも力を発揮します。このロングリード・シークエンサーを用いた全ゲノム解析を行ったところ、マイクロサテライトマーカーでの解析を行った大家系を含む9家系24人の患者さんおよび孤発例40人全員で、他の生物には存在しないヒト特異的遺伝子であるNOTCH2NLCのDNA塩基配列GGCのリピートが異常に伸長していることを認めました。本研究は、ロングリード・シークエンサーを用いることで、症例の全ゲノムを直接解読して原因解明に至ることができることを実証した重要な成果で、依然数多く残されている原因不明の遺伝病の解決に向けた大きな一歩となることが期待されます。
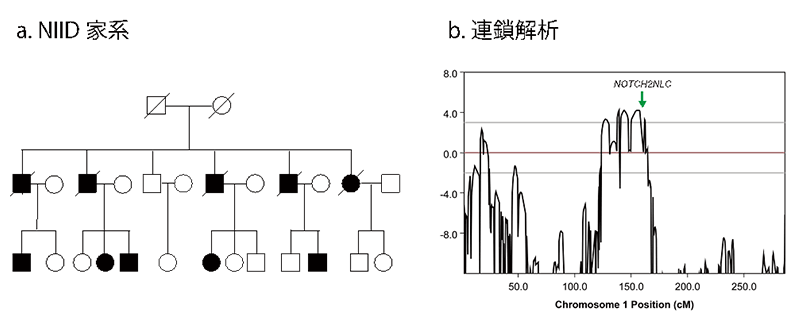
図1.NIID大家系(a) においてマイクロサテライトマーカーを用いた連鎖解析により、原因遺伝子は1番染色体にあることは確認していたが、従来型のゲノム解析技術では、原因となる変異までは特定できなかった(b)。
研究の内容
本研究グループは、8家系13人の患者さんからご提供いただいたゲノムDNAを用いて、ロングリード・シークエンサーによる全ゲノム解析を行ったところ、全例にNOTCH2NLCという、ヒトに特有の遺伝子内のGGC(グアニン、グアニン、シトシン)のリピートが伸長していることがわかりました(図2)。このリピートは、4人の非発症家族構成員と29人のコントロールでは伸長していませんでした。NOTCH2NLC遺伝子は、セグメント重複という機序により、ヒトゲノム内に似た遺伝子が複数存在し、従来の技術では解析が難しいゲノム領域にあったことから、発見が困難だったと考えられます。
さらに本研究グループは、PCR*7を用いてNOTCH2NLCのGGCリピート伸長を簡便に検出する方法を開発し(図2c)、ロングリード・シークエンサーで解析されていた患者さんを含む9家系24人および40人の孤発性のNIIDの患者さんを調べたところ、全例にこのGGCの伸長が見られました。このリピートの伸長は、496人のコントロールには見られませんでした。このことは、NOTCH2NLCのGGCリピート伸長がNIIDの原因であることを強く示唆しており、今後、NIIDの診断に有用であると考えられます。
さらに、CRISPR/Cas9*8という方法でゲノムDNA中のNOTCH2NLCのGGCリピートを切り出して濃縮し、ロングリード・シークエンサーであるナノポアシークエンサー*9「MinION」を用いて詳細に解析したところ、認知症が主症状の患者さんにはGGCのみの繰り返しがみられるのに対して、末梢神経症状を主症状とする患者さんには、GGCの繰り返しに加えてGGA配列が含まれていました。これは、リピート配列の違いが症状の違いを引き起こしている可能性が示唆される結果です。また、患者さんの線維芽細胞を用いたRNAシークエンス*10により、このリピートに関連して異常な転写産物が発現していることを確認しました。これらの現象は、今後、病気の発症メカニズムを考える上で非常に重要であると考えられます。

図2.ロングリード・シークエンサーにより、患者ではNOTCH2NLC遺伝子内のGGC繰り返し配列(リピート)が伸長していることが明らかになった(a)。
CRISPR/Cas9を用いた方法により、伸長しているGGCリピートの領域のみをナノポアシークエンサーで解析することにより、リピートの構造が明らかになった(b)。
本研究グループが開発したPCRを用いて、簡便にリピート伸長を診断することが可能になった(c)。赤四角:伸長したリピートを持つ場合に見られるパターン。
今後の展開
本研究により、NIIDの遺伝的な病因を世界に先駆けて明らかにしました。本発見が、病態の解明および治療法開発へ繋がることが期待されます。また、本研究は新技術であるロングリード・シークエンサーを活用して患者さんの全ゲノムを直接解析し、病気の原因遺伝子を同定できることを実証した成果であり、今後この技術が未解決の遺伝病の遺伝的な原因解明への突破口を開く可能性が期待されます。
用語説明
- *1 封入体:
- 細胞の核内にタンパク質が集まって形成された凝集体。NIIDでは、中枢神経系の神経細胞やグリア細胞、末梢神経や一般臓器の細胞などにも、封入体が広く出現する。
- *2 常染色体優性遺伝性:
- 二組ある常染色体の一方の遺伝子に変異を持つことで疾患が発症する遺伝形式。
- *3 大家系:
- 1つの原因遺伝子により、規模の大きな家系の中に複数の罹患者が観察される家系。
- *4 マイクロサテライトマーカーを用いた連鎖解析:
- 疾患とともに受け継がれるゲノム上の特定の領域を多型情報から特定する方法。
- *5 ロングリード・シークエンサー:
- 1万以上の塩基配列を一続きにして読むことができる装置。Oxford Nanopore Technologies やPacific Biosciences社の装置が使われている。
- *6 DNA塩基配列:
- DNA塩基配列はグアニン(G)、シトシン(C)、アデニン(A)、チミン(T)の4種類より構成される。
- *7 PCR:
- DNAを増幅して感度高く検出する方法。
- *8 CRISPR/Cas9:
- ターゲットにしたDNA塩基配列の部分を選択的に切り出すことができる方法。
- *9 ナノポアシークエンサー:
- 一分子のゲノムDNA配列を解析することができるロングリード・シークエンサー。ナノポアとよばれるタンパク質の穴を、DNA分子が通り抜けるときにナノポアが埋め込まれた人工膜を流れる電流の変化によって、DNAの配列を解析することができる。
- *10 RNAシークエンス:
- 遺伝子産物であるメッセンジャーRNAを相補的なDNAに変換して網羅的に配列を解析する手法。
※本研究は、『Nature Genetics』に掲載されます。(日本時間7月23日午前0時付オンライン)
※本研究は、日本学術振興会 科学研究費補助金「エオジン好性核内封入体(NIHID)の原因遺伝子の探索・同定」(萌芽研究:19659225:研究代表者 田中章景)、「NIIDの次世代シークエンサーを用いた病因遺伝子の同定」(基盤研究C:24591257:研究代表者 曽根淳)および「NIID(エオジン好性核内封入体病)の病態の解明および原因遺伝子探索」(基盤研究C:15K09312:研究代表者 曽根淳)、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業「希少難病の高精度診断と病態解明のためのオミックス拠点の構築」(課題管理番号:19ek0109280h0003、研究代表者 松本直通)、文部科学省新学術領域「(生物系)脳タンパク質老化と認知症制御」(領域番号:3608,領域代表者 祖父江元)、新学術領域研究「脳タンパク質老化と神経回路破綻の可視化」(課題番号:26117002, 研究代表者 祖父江元)、厚生労働省、科学技術振興機構、武田科学振興財団、大和証券ヘルス財団、テルモ生命科学振興財団の研究の一環として実施されました。
掲載論文
- 論文タイトル:
- Long-read sequencing identifies GGC repeat expansions in NOTCH2NLC associated with neuronal intranuclear inclusion disease
- 神経核内封入体病(NIID)の原因はNOTCH2NLC遺伝子のGGCリピート伸長である
- 著者:
- Jun Sone#, Satomi Mitsuhashi#, Atsushi Fujita# (#: first co-authors), Takeshi Mizuguchi, Kohei Hamanaka, Keiko Mori, Haruki Koike, Akihiro Hashiguchi, Hiroshi Takashima, Hiroshi Sugiyama, Yutaka Kohno, Yoshihisa Takiyama, Kengo Maeda, Hiroshi Doi, Shigeru Koyano, Hideyuki Takeuchi, Michi Kawamoto, Nobuo Kohara, Tetsuo Ando, Toshiaki Ieda, Yasushi Kita, Norito Kokubun, Yoshio Tsuboi, Kazutaka Katoh, Yoshihiro Kino, Masahisa Katsuno, Yasushi Iwasaki, Mari Yoshida, Fumiaki Tanaka, Ikuo K. Suzuki, Martin C. Frith, Naomichi Matsumoto*, Gen Sobue* (*: co-corresponding authors)
お問い合わせ先
本資料の内容に関するお問い合わせ
国立病院機構鈴鹿病院 脳神経内科
第二脳神経内科医長 曽根 淳
横浜市立大学 学術院医学群 遺伝学
教授 松本 直通
名古屋大学大学院医学系研究科 特任教授
学校法人愛知医科大学 理事長 祖父江 元
取材対応窓口、詳細の資料請求など
国立病院機構鈴鹿病院 企画課
業務班長 南谷 崇明
横浜市立大学
研究企画・産学連携推進課長 渡邊 誠
名古屋大学 医学部・医学系研究科
総務課総務係
AMEDの事業について
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課