トリプトファン代謝産物セロトニンは卵巣誘導因子として働く
2019-07-24 弘前大学,基礎生物学研究所,慶應義塾大学
【本研究成果のポイント】
- 分裂・再生による無性生殖と生殖細胞を形成する有性生殖の2つの生殖様式を使いわけるプラナリア「リュウキュウナミウズムシ#1」の遺伝子カタログを作成した。
- 生殖様式に応じて発現量が異なる遺伝子を網羅的に調べた結果、アミノ酸代謝に違いがあることを見出し、さらに、トリプトファン代謝産物であるセロトニンが卵巣誘導因子として働くことを発見した。
- 分化多能性幹細胞#2をもつプラナリアが胚発生によらず、成体で新たに生殖細胞を作る過程の一端を解明した。今後、多様な生物で分化多能性幹細胞の制御や生殖細胞の分化機構を理解する基盤となる。
【研究の概要】
扁形動物プラナリアには、分裂・再生による無性生殖と、精子や卵子といった生殖細胞を形成して他個体と交配する有性生殖の2つの生殖様式を使い分けるものがいます。無性個体は分裂後、ほぼすべての器官を再生しますが、生殖細胞・生殖器官だけは作らず、無性状態を維持し続けます。一方、有性個体では分裂による再生はストップし、今までもっていなかった生殖細胞を新たにつくります。この生殖様式の転換を可能にしているのが、プラナリアが全身にもつ分化多能性幹細胞であり、ここから生殖細胞を含めたすべての組織を形成することができます。多くの生物が胚発生(受精卵から体を形づくっていく過程)で生殖細胞をつくることを考えると、成体になってからでも生殖細胞を新たに形成できるプラナリアは珍しい生き物だといえます。このように、プラナリアにおける無性と有性の状態の切り替えは、興味深い現象であり、幹細胞をどのように制御するかが鍵となっていると考えられます。
弘前大学の小林一也准教授らを中心とした研究グループは、この生殖様式の転換のしくみを解明するための第一歩として、実験的に有性個体への転換をうながすことができるリュウキュウナミウズムシ(図1)を用いて、発現遺伝子を網羅的に解析できるRNAシーケンシング#3を行いました。その結果、181,393個からなる遺伝子カタログを作成することができました。またコンピューターによる網羅的な解析によって、無性個体と有性個体ではアミノ酸の代謝に関わる遺伝子群の発現が異なることを発見しました。これらの遺伝子に着目してさらに解析を進めた結果、トリプトファンの代謝産物であるセロトニンが卵巣誘導因子として機能することを実験的に証明しました。多能性幹細胞や生殖細胞では分化した細胞に比べ、アミノ酸代謝や解糖系などの代謝が異なることや、セロトニンと生殖細胞の関連性は他の生物でも示唆されていたため、これらはプラナリアにのみ特異的な現象ではなさそうです。プラナリアと近縁な生物には、同じく無性生殖と有性生殖を用いる吸虫や条虫などの寄生性の扁形動物が知られており、今回プラナリアにおいて発見した特徴が他の扁形動物にも共通しているのか関心が持たれます。本研究の成果は今後、扁形動物の生殖戦略のみならず、多様な生物の幹細胞制御や生殖細胞形成の機構の解明に貢献することが期待されます。
本研究成果は、2019年4月16日に国際科学誌「Scientific Reports」に掲載されました。
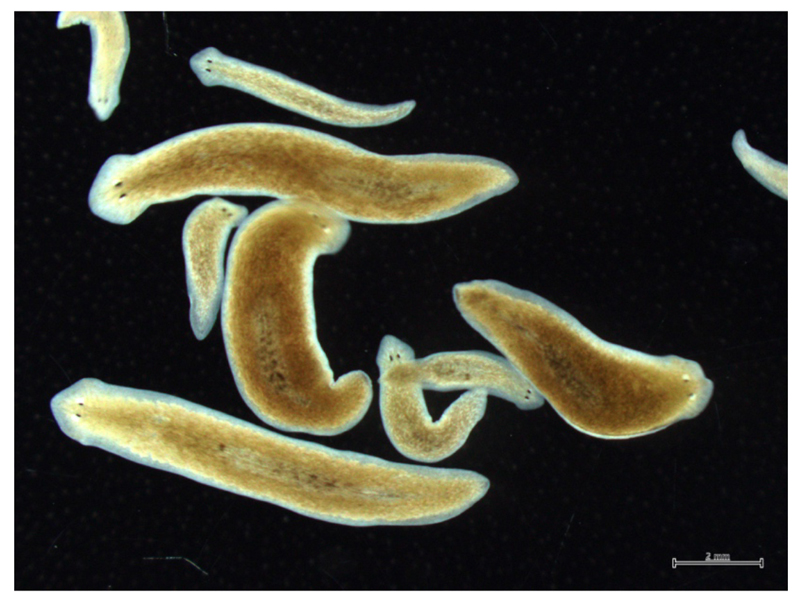 図1. リュウキュウナミウズムシの無性個体と有性個体。
図1. リュウキュウナミウズムシの無性個体と有性個体。
同じ遺伝子情報をもつクローン集団であるが、生殖器官をもたず分裂・再生を繰り返し増殖する無性状態(小型の個体)と生殖器官をもち交尾・産卵をすることのできる有性状態(大型の個体)がある。
【研究の背景】
「性(sex)」には男や女、♂♀、性別という意味がありますが、「同種の二個体間で遺伝子を混ぜ合わせる」という意味もあります。私たちヒトを含めた哺乳類は必ず精子と卵子が受精することで新たな生命がつくられます。一方で、「新たな生命がつくられる」ことを「生殖」といいます。これらのことをあわせて「有性生殖」といいます。哺乳類の生殖様式が有性生殖に限定されているために見過ごされがちですが、性を伴わないで生殖が起こる「無性生殖」を行なう動物も多く知られています。無性生殖を行なう動物は分化多能性幹細胞をもっているものがいて、生活史にプログラムされた自切現象ののち組織や器官を再生して新たな個体をかたちづくることができます。
有性生殖と無性生殖にはそれぞれメリットとデメリットがあります。有性生殖は無性生殖に比べて遺伝的多様性をつくりやすいのですが、無性生殖に比べて繁殖スピードが遅い上に生殖コストがかかると考えられています。一方、無性生殖では繁殖相手を必要とせず自身のみで個体の数を増やせますが、遺伝的には同じなため、環境の変化に適応できなければ一気に死んでしまう可能性があります。実は、多くの動物が無性生殖と有性生殖とを転換することができます。この生殖様式転換は、2つの生殖様式の「いいところ取り」をした生殖戦略ともいえますが、その転換のメカニズムはほとんど明らかとなっていません。
ある種の扁形動物プラナリアは水温の変化が重要な要因となって季節的に生殖様式を転換します。無性状態から有性状態への転換は特に「有性化現象」とよばれ、プラナリアの分化多能性幹細胞(ネオブラスト)から生殖器官が分化してくることから、生殖生物学的だけでなく発生生物学的にも興味深い現象として注目されてきました。50年程前に、無性個体に有性個体を餌として与えることによって有性化が引き起こせることが報告されました。この研究によって、無性個体に生殖器官を誘導する有性個体中の化合物「有性化因子」の存在が示唆されました。有性化因子が明らかとなれば、有性化機構を解明する手がかりになると考えられますが、その実体はまだ完全に明らかになっていません。そこで小林准教授らの研究グループは、リュウキュウナミウズムシ無性クローン集団であるOH株に有性個体をエサとして与えることによる有性化の実験系を確立し(図2)、有性化因子の単離や有性化機構の解明をめざす研究を行ってきました。
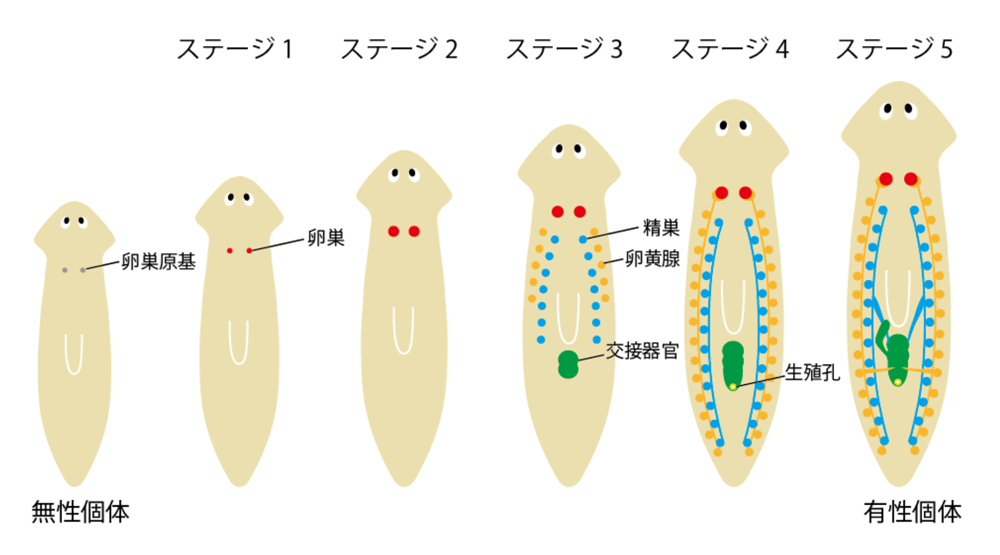 図2. リュウキュウナミウズムシの有性化過程
図2. リュウキュウナミウズムシの有性化過程
リュウキュウナミウズムシ無性クローン集団であるOH株に有性個体をエサとして毎日少しずつ与えることで、実験的に有性化ができる。はじめに卵巣が発達し、その後精巣や卵黄腺などの生殖器官が発達してくる。
【研究の成果】
今回、弘前大学農学生命科学部の小林一也准教授のグループ(関井清乃、頼本隼汰(現 基礎生物学研究所)ら)、基礎生物学研究所の重信秀治教授ら、慶應義塾大学自然科学研究教育センターの古川亮平助教、ほか東北大学、津山工業高等専門学校の研究者から構成される研究チームは、リュウキュウナミウズムシの無性個体と有性個体(図1)からRNAを抽出し、次世代シークエンシング技術#4を用いたRNAシークエンシング法により遺伝子情報の大量解読を行うことで、181,393個の遺伝子モデルからなる遺伝子カタログを構築しました。次に、この遺伝子カタログに基づいて、無性個体と有性個体で発現量の異なる遺伝子がどれくらいあるかを調べたところ、11,795個の遺伝子が見つかり、そのうち1,191個の遺伝子は無性個体の方で高く、一方、10,604個は有性個体の方で高く発現していることがわかりました。さらに、無性個体と有性個体の間で遺伝子発現に差のある遺伝子の種類を詳細に調べたところ、アミノ酸の代謝に関わる遺伝子が多く含まれていました。つまり、無性と有性個体の間では、アミノ酸代謝の活性に違いがある可能性を示しています。
なかでも、研究グループは今回、トリプトファン代謝に関わる遺伝子に着目しました。小林准教授らは、これまでにl-トリプトファンとd-トリプトファンを卵巣誘導因子のひとつとして同定していたからです。qRT-PCR法によって、このトリプトファン代謝経路上に存在し、無性個体と有性個体で発現量の異なる遺伝子を調べたところ、トリプトファンの代謝産物5-ヒドロキシトリプトファンからさらにセロトニンをつくる酵素DDC (3,4-dihydroxyphenylalanine decarboxylase)(図3A)が、有性個体で有意に高く発現している証拠が得られました(図3B)。つまり、有性個体ではセロトニン合成が活性化されている(あるいは無性個体では抑えられている)ことを意味します。
そこで、研究グループはリュウキュウナミウズムシの無性個体にセロトニンを給餌してみました。驚いたことに、セロトニンの投与によって、無性個体に通常は存在しないはずの卵巣が誘導されました(図3C,D)。リュウキュウナミウズムシの有性化過程は厳密に決まっており、はじめに卵巣が形成されたのちに精巣やその他の生殖器官が発達します(図2)。今回の実験結果は、セロトニンが、有性化のきっかけとなる重要なステップの卵巣誘導に関与していることを示しています。先行研究ではl-トリプトファンも大量に与えれば卵巣が誘導されることが示されており、l-トリプトファンのさらなる代謝産物が効いているのではないかと推測されていました。今回の、トリプトファンの代謝産物であるセロトニンが卵巣誘導能を有するという実験結果はそれを裏付けたことになり、実際セロトニンはトリプトファンよりもずっと少ない量で効果がありました。
 図3セロトニンはプラナリアの卵巣誘導因子
図3セロトニンはプラナリアの卵巣誘導因子
A:セロトニンはトリプトファンから2つの酵素反応を経て作り出される。B:トランスクリプトーム解析でセロトニン合成に関わる酵素DDC遺伝子が有性個体で高発現していることがわかった。C, D:無性個体にセロトニンを投与すると卵巣が誘導された。
【今後の展開】
近年、多能性幹細胞や生殖細胞が分化した細胞とは異なる代謝プログラムを持つという報告が様々な生物で増えてきており、多能性幹細胞のユニークな代謝は、発生生物学および再生生物学の新たなパラダイムとなっています。今回、リュウキュウナミウズムシのクローン集団を用いた研究から、多能性幹細胞を制御しながら分裂・再生を行う無性状態と、生殖細胞を形成するようになった有性状態では、アミノ酸代謝が異なり、その結果もたらされる代謝産物のひとつセロトニンが卵巣誘導に関与しているということが明らかになりました。今後、代謝制御の違いを詳細に解析していくことで、それらが多能性幹細胞の制御や生殖細胞形成にどのように関与するかを明らかにできると期待されます。
また今回解析したトリプトファンやその他のアミノ酸の代謝以外にも、有性個体で高い発現を示す遺伝子には様々な経路に関わる遺伝子が多数含まれていました。有性個体は生殖細胞や生殖器官など無性個体には存在しない細胞・器官をつくるため、多様な経路が活性化しているのだと考えられます。そしてプラナリアは有性の状態を維持するために有性化因子と呼ばれる化学物質を自分で産生していることがわかっています。有性化因子は新たに生殖細胞をつくらせるきっかけにもなり、その維持のためにも機能しているのです。有性化因子は複数の化合物から構成されていると考えられており、今回発見されたセロトニンはそのうちのひとつになります。しかしセロトニンによって誘導されるのは卵巣のみであり、精巣やその他の生殖器官を誘導する因子が他にもあるようです。有性化因子は種を超えて保存されていて、扁形動物の生殖戦略に重要な役割を果たしていると考えられますが、まだすべての物質の解明にはいたっていません。今回の研究で得られた有性個体で高く発現する遺伝子の中には有性化因子の産生に関与しているものが含まれていると考えられ、今後、有性化因子の物質同定の大きな手がかりになると期待されます。
【語句説明】
#1 リュウキュウナミウズムシ(Dugesia ryukyuensis)
プラナリアは和名をウズムシと呼ぶ。本研究では、1984年に沖縄で採集されたリュウキュウナミウズムシ(Dugesia ryukyuensis)1個体に由来する無性クローン集団、OH株(沖縄[Okinawa]で採集して弘前[Hirosaki]で株化したことに由来する)が用いられた。
#2 分化多能性幹細胞
すべての細胞になりうる未分化な細胞。細胞分裂後に生じる2つの娘細胞のひとつは分化過程に入るが、もうひとつは未分化な状態のままにある幹細胞の性質をもつ。
#3 RNAシーケンシング
次世代シーケンシング技術(#4参照)によって網羅的に転写産物を解読する手法。得られた配列情報から遺伝子の同定やカタログ化ができるだけでなく、遺伝子発現量の定量も可能である。
#4 次世代シーケンシング
2000年代後半から発展してきた新規の塩基配列解読技術。超並列にシーケンス反応を行うことで、数億断片を一度に読むことができる画期的なDNAシークエンス技術である。従来の方法に比べて安価でより大規模な塩基配列が解読できる。
#5 セロトニン
トリプトファンから代謝されてできる神経伝達物質。
【論文情報】
タイトル:
“Transcriptomic analysis reveals differences in the regulation of amino acid metabolism in asexual and sexual planarians”
著者名:
Kiyono Sekii1†, Shunta Yorimoto1†, Hikaru Okamoto1, Nanna Nagao1, Takanobu Maezawa2, Yasuhisa Matsui3, Katsushi Yamaguchi4, Ryohei Furukawa5,6*, Shuji Shigenobu4,7*, and Kazuya Kobayashi1*
所属:1. 弘前大学農学生命科学部生物学科、2. 津山工業高等専門学校総合理工学科、3. 東北大学加齢医学研究所医用細胞資源センター、4. 基礎生物学研究所、5. 岩手医科大学いわて東北メディカル・メガバンク機構、6. 慶應義塾大学自然科学研究教育センター、7. 総合研究大学院大学生命科学研究科、*: 責任著者 †: 筆頭著者
掲載誌:
国際科学誌Scientific Reports
DOI:
10.1038/s41598-019-42025-z
【研究サポート】
本研究は科学研究費補助事業、新学術領域研究「配偶子幹細胞制御機構」(課題番号20116007)と科学研究費補助事業、新学術領域研究「動物における配偶子産生システムの制御」(課題番号26114501、16H01249)によって支援されました。
また、本研究は自然科学研究機構基礎生物学研究所共同利用研究(2015年度研究課題15-801、2016年度研究課題16-401、2017年度研究課題17-402)の一環として実施されました。
【お問い合わせ先】
弘前大学 農学生命科学科 生物学科
准教授 小林 一也(こばやし かずや)
基礎生物学研究所 生物機能解析センター・新規モデル生物開発センター
教授 重信 秀治(しげのぶ しゅうじ)
慶應義塾大学 自然科学研究教育センター
助教 古川 亮平(ふるかわ りょうへい)
【報道担当】
弘前大学農学生命科学部 総務グループ
基礎生物学研究所 広報室
慶應義塾大学 広報室