特定の病原菌を狙い撃ち、耐性菌の出にくい薬の開発へ
2018-02-15 理化学研究所,日本医療研究開発機構
要旨
理化学研究所(理研)横山構造生物学研究室の仙石徹研究員、柳沢達男研究員、横山茂之上席研究員らの共同研究グループ※は、髄膜炎菌[1]の正常な増殖に必要なタンパク質「EarP」が、タンパク質「EF-P[2]」に糖を付加する新たな仕組みを明らかにしました。
天然のタンパク質はアミノ酸がつながってできています。そして、多くのタンパク質は、さまざまな種類の化学修飾を受けることで働きが制御されています。2016年に横山上席研究員らは、髄膜炎菌において、EarPがEF-Pタンパク質の特定のアルギニン(アミノ酸の一種)残基[3]にラムノース[4]という糖を付加(ラムノシル化)し、このラムノシル化が細菌の正常な増殖に不可欠であることを明らかにしました注1)。しかし、このアルギニンのラムノシル化という独特な化学修飾がどのように行われるのかは分かっていませんでした。
今回、共同研究グループはX線結晶構造解析[5]により、EarPがEF-Pにどのように働くかを詳しく調べました。その結果、EF-Pのラムノシル化されるアルギニンを含むドメイン[6]部分がEarPに結合し、幅広い相互作用面積を作ることでEF-Pのアミノ酸残基と相互作用をしていることが分かりました。さらに、モデリングと分子動力学シミュレーション[7]を用いて、ラムノシル化反応が起こる際、ラムノースの形が反転することで反応が促進されることを明らかにしました。これらの特徴は、これまでに知られていた糖転移酵素[8]にはみられないものです。
今回の研究で、EarPの特徴的な働き方が詳しく明らかになったことで、EarPの働きを抑える化合物の合理的なデザインが可能になります。EarPは、髄膜炎菌のほかに淋菌・緑膿菌・百日咳菌などの臨床上重要な病原菌に存在していますが、ヒトにはありません。そのため、これらの病原菌にのみ効き、耐性菌[9]が出にくく、かつ副作用を生じるリスクが低い新しい抗菌剤の開発につながると期待できます。
本研究は、米国の科学雑誌『Nature Chemical Biology』オンライン版(2月13日付け)に掲載されました。
本研究は、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業、日本学術振興会 科学研究費助成事業の支援により行われました。
※共同研究グループ
- 理化学研究所
- 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
研究員 柳沢 達男(やなぎさわ たつお)
研究員 仙石 徹(せんごく とおる)
特別研究員 疋田 泰士(ひきだ やすし) - 環境資源科学研究センター
- 生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
専任技師 鈴木 健裕(すずき たけひろ) - ライフサイエンス技術基盤研究センター
- 生命分子制御研究グループ 制御分子設計研究チーム
チームリーダー 本間 光貴(ほんま てるき) - 創薬分子設計基盤ユニット
研究員 渡邉 千鶴(わたなべ ちづる) - グローバル研究クラスタ システム糖鎖生物学研究グループ
- 糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹(やまぐち よしき) - 国立感染症研究所 細菌第一部
- 主任研究員 高橋 英之(たかはし ひでゆき)
背景
天然のタンパク質は、20種類のアミノ酸がつながってできています。そして多くのタンパク質は、さまざまな化学修飾を受けることで働きが制御されます。なかでも、さまざまな種類の糖がタンパク質に付加することが知られています。
2016年に横山上席研究員らは、髄膜炎菌において、EF-Pタンパク質の32番目のアルギニン残基(Arg32)にラムノースという糖が付加されている(ラムノシル化)こと、このラムノシル化を行うEarPタンパク質は髄膜炎菌の正常な増殖に不可欠であることを明らかにしました。EF-Pにはタンパク質のスムーズな合成を促す働きがあり、それにはArg32のラムノシル化が必要です。
ラムノシル化されたアルギニンはヒトで見つかっておらず、ラムノシル化を抑える化合物が合成できれば、髄膜炎菌感染症の治療に有効であると期待されます。そのような化合物をデザインするためには、EarPがどのようにラムノースをEF-Pに付加するかを詳しく調べる必要がありました。
研究手法と成果
共同研究グループは、EarPがどのように働くかを詳しく調べるために、大型放射光施設「SPring-8」[10]と放射光科学研究施設「Photon Factory」[11]のX線を用いて、X線結晶構造解析を行いました。まず、EarPにdTDP-ラムノース(ラムノース供与体)が結合した状態の立体構造を調べたところ、ラムノース供与体はEarPが持っている二つのドメインの間の溝にあるポケットに結合していました(図1左)。
また、EarPにEF-Pが結合した状態の立体構造を調べたところ、EF-Pの中でArg32を含むドメイン(ドメインI)がEarPと主に結合していることが分かりました(図1右)。EF-Pに特徴的なアミノ酸残基がEarPのアミノ酸残基と、水素結合をはじめとした数多くの相互作用を形成しており、これらの相互作用によってEarPは多くのタンパク質の中からEF-Pだけを見分けてラムノシル化することが分かりました。
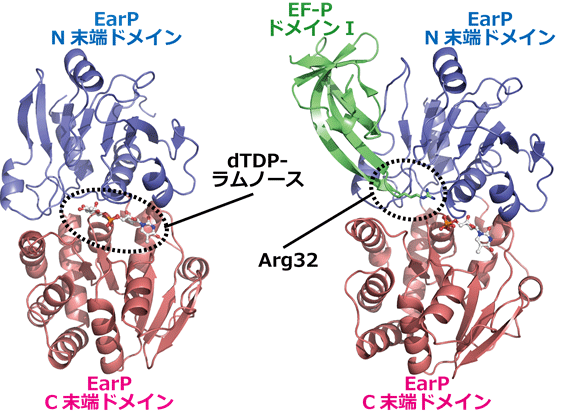
図1 結晶構造解析で明らかになった髄膜炎菌のEarPの立体構造
左: EarPにdTDP-ラムノース(ラムノース供与体)が結合した構造。dTDP-ラムノースはN末端ドメイン(青)とC末端ドメイン(ピンク)の溝にあるポケットに結合している。
右: EarPにEF-PのArg32を持つドメインI(緑)が結合した構造。
共同研究グループは次に、ラムノシル化反応の仕組みを詳しく調べました。EarPにdTDP-ラムノースが結合した状態において、ラムノースはラムノシル化反応を起こしにくい「いす型」構造をとっていました(図2左)。ところが、そこにEF-Pが結合しようとすると、EF-PのArg32が結合するべき位置にラムノースが存在するために、そのままだと両者がぶつかってしまいます(図2中)。そこで、分子動力学シミュレーションによる解析を行った結果、EF-Pの結合に伴ってdTDP-ラムノースを結合するポケットの形が変わり、「いす型」のラムノースから反転した「ねじれ舟型」の構造になり、反応が起こりやすくなることが分かりました(図2右)。
これらの観察から、EF-Pの結合がラムノースの反転を引き起こし、それによりラムノシル化反応が促進されることが明らかになりました。このような糖の反転を伴う反応の仕組みはこれまでの糖転移酵素では知られておらず、EarPに独特なものといえます。
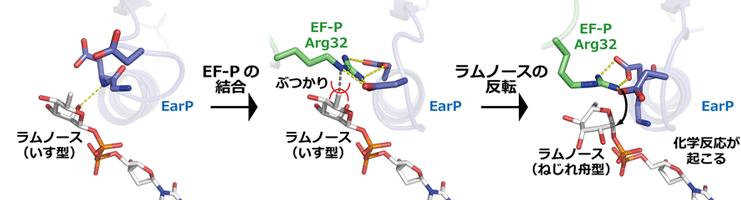
図2 髄膜炎菌EarPタンパク質へのラムノシル化の詳しい仕組み
左: EarPにdTDP-ラムノース(ラムノース供与体)が結合した構造。ラムノースは「いす型」構造をとっている。
中: EarPのArg32が結合する部分とラムノースが結合する部分は重なっており、ラムノースがいす型のままでは両者はぶつかってしまう。
右:ラムノースが反転し、反応が起こりやすい状態になった「ねじれ舟型」構造のモデル図。
今後の期待
今回の研究で、EarPが作り出す化学修飾のみならず、EarPの働き方そのものも独特であることが分かりました。EarPの働く仕組みが詳しく明らかになったことで、その働きを抑える化合物の合理的なデザインが可能になります。
EarPは、髄膜炎菌のほかに淋菌・緑膿菌・百日咳菌などの臨床上重要な病原菌に存在していますが、ヒトにはありません。本成果は、これらの病原菌にのみ効き、耐性菌が出にくく、かつ副作用を生じるリスクが低い新しい抗菌剤の開発につながると期待できます。
論文情報
- タイトル
- Structural basis of protein arginine rhamnosylation by glycosyltransferase EarP
- 著者名
- Toru Sengoku, Takehiro Suzuki, Naoshi Dohmae, Chiduru Watanabe, Teruki Honma, Yasushi Hikida, Yoshiki Yamaguchi, Hideyuki Takahashi, Shigeyuki Yokoyama, and Tatsuo Yanagisawa
- 雑誌
- Nature Chemical Biology
- DOI
- 10.1038/s41589-018-0002-y
補足説明
- [1] 髄膜炎菌
- 淋菌などと同じナイセリア属のグラム陰性双球菌で、大きさは0.6~0.8マイクロメートル(μm、1μmは1,000分の1 mm)。ヒトのみを宿主とし、患者のみならず健常者の鼻咽頭からも分離される。くしゃみなどによる飛沫によりヒトからヒトへ伝播して、ときに大規模な流行を起こすことがある。気道粘膜上皮から侵入して血中に入り敗血症を起こし、さらには血管脳関門を通過して髄液にまで侵入することにより髄膜炎を起こす。
- [2] EF-P
- 様々なタンパク質のスムーズな合成を促す働きを持つタンパク質。タンパク質中でアミノ酸「プロリン」が連続する配列は合成が滞りやすいことが知られており、EF-Pはそのような配列に働く。
- [3] 残基
- タンパク質を構成する繰り返し単位である一つ一つのアミノ酸部分。
- [4] ラムノース
- 天然に存在するデオキシ糖の1種である(単糖)。L-マンノースの 6位のヒドロキシ基が水素原子に置き換わった構造を持ち、メチルペントース、あるいはデオキシヘキソースに分類される。D体、L体のエナンチオマー、α体、β体のアノマーが知られ、天然には L体がみられる。
- [5] X線結晶構造解析
- 物質の結晶を作り、それにX線を照射して回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の構造を原子レベルの分解能で詳細に解明するための最も有力な方法の一つである。
- [6] ドメイン
- タンパク質の立体構造において、一つにまとまって折り畳まれ働く領域。多くのタンパク質は一つ以上のドメインがつながった構造をとり、それぞれのドメインが協同してタンパク質全体の機能を発揮している。
- [7] 分子動力学シミュレーション
- 分子の立体構造をもとに、原子間に働く力を計算して運動方程式を繰り返し解くことにより、どのように分子が動くかを調べる方法。
- [8] 糖転移酵素
- 糖をその供与体から化合物やタンパク質に転移させる一群の酵素の総称。転移される糖やそれを受け取る化合物とタンパク質の種類はさまざまであり、それに応じて多くの糖転移酵素が存在する。
- [9] 耐性菌
- 多くの抗菌剤が効かなくなった細菌。近年、抗菌剤の乱用による耐性菌の出現が社会的問題になっている。耐性菌の出現を防ぐには、できるだけ感染菌のみを狙い撃って他の細菌に影響を与えない抗菌剤を使うのが好ましい。
- [10] 大型放射光施設「SPring-8」
- 理研が所有する、兵庫県の播磨科学公園都市にある第三世代放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
- [11] 放射光科学研究施設「Photon Factory」
- 大学共同利用機関法人高エネルギー加速器研究機構(KEK)のつくばキャンパスにある放射光施設。電子加速器から生まれる放射光で、物質・生命の構造から機能発現の仕組みを明らかにする研究を推進している。PFリング(2.5 GeV)、アドバンストリング(PF-AR, 6.5 GeV)という、特徴ある二つの放射光専用の光源加速器を有し、KEKで培ってきた放射光技術・加速器技術により世界最先端の研究の場を提供している。
発表者・機関窓口
発表者
理化学研究所 横山構造生物学研究室
研究員 仙石 徹(せんごく とおる)
上席研究員 横山 茂之(よこやま しげゆき)
研究員 柳沢 達男(やなぎさわ たつお)
機関窓口
理化学研究所 広報室 報道担当
日本医療研究開発機構(AMED)創薬戦略部 医薬品研究課