2019-09-19 名古屋大学,日本医療研究開発機構
名古屋大学大学院医学系研究科神経内科学の 勝野 雅央 教授、同大学大学院医学系研究科神経内科学、日本学術振興会特別研究員(RPD)の 飯田 円 研究員(筆頭著者)、同大学(愛知医科大学理事長)の 祖父江 元 特任教授らの研究グループは、神経変性疾患※1のひとつである球脊髄性筋萎縮症※2(SBMA)において脊髄と骨格筋のSrc※3シグナル※4が活性化していることを見出し、Srcの活性化を抑える化合物がSBMAの症状を改善する可能性があることを明らかにしました。
SBMAは成人男性に発症し、全身の筋力低下や食べ物の飲み込みにくさを主症状とする進行性の神経筋疾患※5です。健常者の体内にも存在するアンドロゲン受容体(AR)※6タンパク質が、細胞の核内に蓄積し細胞死を起こすことが知られています。勝野教授らの研究チームはSBMAマウスモデルの脊髄と骨格筋を用いた網羅的なシグナル解析を行い、運動機能障害の症状が現れる以前から脊髄と骨格筋においてSrcというタンパク質のリン酸化が上昇していること(Srcが活性化していること)を明らかにしました。またSBMA患者より作成したiPS細胞由来運動ニューロン※7、SBMA患者の脊髄と骨格筋においても、Srcのリン酸化は上昇していました。SBMAの細胞モデル(AR-97Q:SBMA患者と同様の遺伝子の異常をもつ細胞)においても、コントロール(対照)の細胞モデル(AR-24Q:健常者と同様の遺伝子をもつ細胞)と比較するとSrcが活性化していました。そこでSBMA細胞モデルにSrcの活性化を抑える化合物を投与すると、SBMA細胞モデルのviability※8が改善しました。同様にSBMAマウスモデルに対してSrcの活性化を抑える化合物を投与するとSBMAマウスモデルの病態の悪化を抑止することができました。またSrcが活性化された結果p130Cas※9がリン酸化され、そのことがSBMAの病態に関与していることを明らかにしました。さらにSBMAにおいてSrcが活性化される仕組みとして、ARとSrcの結合が重要であることも解明しました。
本研究ではSBMAの病態にSrcの異常な活性化が関与していることを明らかにし、Srcの活性化を抑える化合物がSBMAの新規治療薬として有望であることを示しました。Srcは種々の癌で活性化していることが知られており、癌の進行や転移に関連する分子として注目されています。今回の研究において、神経筋疾患と癌の共通項を見出すとともに、Srcの活性化を抑える化合物が神経難病や癌の治療薬となり得る新たな可能性が示唆されました。
本研究成果は、2019年9月19日付け(日本時間18時)米国科学雑誌「Nature Communications」電子版に掲載されます。
本研究は、科学研究費、日本医療研究開発機構(AMED)、内藤記念科学振興財団、堀科学芸術振興財団、名古屋大学医学部附属病院先端医療開発経費の支援により行われました。
ポイント
- 球脊髄性筋萎縮症(SBMA)は、筋力低下・筋萎縮が徐々に進行する神経筋疾患です。症状を改善する根本的な治療法はありません。
- 本研究では、SBMAマウスモデルの脊髄と骨格筋において、発症前からSrcが活性化していることを見出しました。さらにSBMA患者の脊髄と骨格筋においても、Srcが活性化していることを明らかにしました。
- Srcの活性化を抑える化合物はSBMAマウスモデルにおける病態の進行を抑止しました。
- Srcの活性化を抑える化合物はSBMAの新規治療薬として有望であると考えられました。この化合物は癌治療の領域でも開発が進んでいます。
背景
球脊髄性筋萎縮症(SBMA)は、運動ニューロンと骨格筋の変性・脱落により筋力低下や筋萎縮が進行する遺伝性の難病です。アンドロゲン受容体(AR)遺伝子の変異により、神経細胞や筋細胞の核内にポリグルタミンタンパク質※10が異常に蓄積して転写因子※11等の機能を阻害することで、細胞の機能低下を引き起こすと考えられています。症状が進行すると呼吸不全等により致命的になりますが、症状を改善する根本的な治療法は見出されていません。2017年に治療薬としてリュープロレリン酢酸塩※12が承認されましたが、性機能抑制や骨格筋のタンパク同化作用※13抑制などの副作用があるため、新たな治療薬の開発が望まれています。
研究チームでは、SBMAの病態の根幹に寄与する分子メカニズムを明らかにすることにより、根本的な治療法を見出すことを目標とし、SBMAマウスモデルにおける脊髄と骨格筋のシグナル変化を、運動機能障害の症状が現れる前の状態から網羅的に解析しました。
研究成果
Bio-Plexマルチプレックスシステム※14を用いて、SBMAマウスモデルの脊髄と骨格筋の経時的かつ網羅的なシグナル解析を行ったところ、野生型マウス(正常なマウス)と比較して、SBMAモデルマウスの脊髄においてSrcのリン酸化が発症前(6週齢)から発症後期(13週齢)まで一貫して上昇し、さらにSrcが活性化された結果、Stat3のリン酸化が発症前に脊髄と骨格筋で上昇していました(図1)。
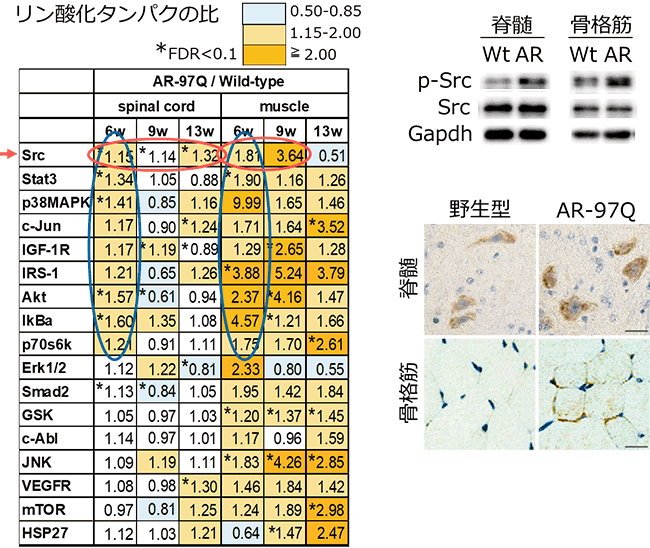
図1 Bio-Plexマルチプレックスシステムの結果(左表)及び6週齢のマウスにおけるリン酸化Src(p-Src)の量の比較(右図2つ)
SBMAマウスモデル(AR-97QあるいはAR)では野生型マウス(Wt)と比較してリン酸化Srcが上昇していました。左表中のspinal cordは脊髄、muscleは骨格筋、一番左の列のアルファベットはリン酸化検出対象としたタンパク質群を示す。GADPHは、比較対照。右上はマウスの脊髄と骨格筋からタンパク質を用いたウエスタンブロット、右下はリン酸化Srcに対する抗体を用いた免疫染色の結果を示す。
またSBMA患者より作成したiPS細胞由来運動ニューロン、SBMA患者の生検筋、剖検組織(脊髄と骨格筋)においてもSrcのリン酸化は上昇していました(図2)。これらの結果からSrcの異常活性化がSBMAの病態に強く関連している可能性が考えられました。
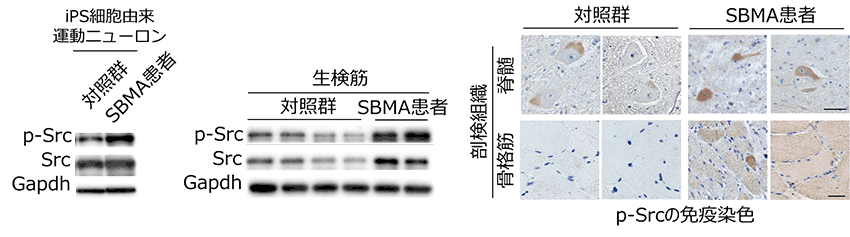
図2 SBMA患者におけるSrcの異常活性化
SBMA患者より樹立したiPS細胞由来運動ニューロン、SBMA患者の生検筋、剖検組織(脊髄と骨格筋)においてリン酸化Srcが上昇していました(GADPHは比較対照)。
マウスの神経細胞であるNSC34と、マウスの筋細胞であるC2C12を用いて作成したSBMA細胞モデルにおいてもSrcが活性化し、Srcの活性化を抑える化合物(A419259)を添加することによりSBMA細胞モデルの生存率が改善しました(図3)。一方、SBMA細胞モデルにSrcを過剰に発現させると細胞の活性が低下したため、SrcがSBMAの病態に重要な役割を果たしていることが示唆されました。また、SBMAマウスモデルにSrcの活性化を抑える化合物(A419259)を投与すると病態を抑止する効果があることが判明しました(図4)。
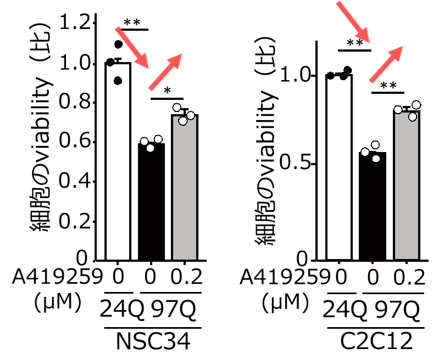
図3 SBMA細胞モデルに対するSrcの活性化を抑える化合物(A419259)の効果
SBMA細胞モデル(97Q)にA419259を添加するとviabilityが改善しました(24Qは、比較対照とした健常者と同じ遺伝子を持つ細胞)。
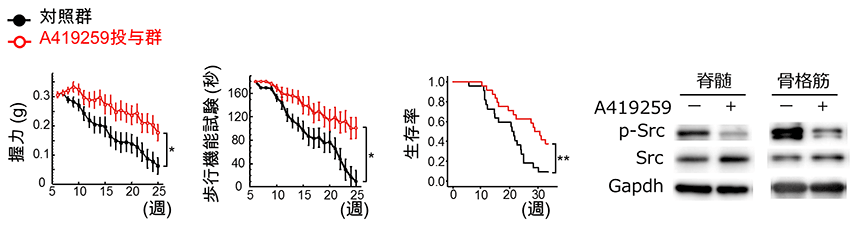
図4 SBMAマウスモデルに対するSrcの活性化を抑える化合物(A419259)の効果
A419259の投与により、SBMAマウスモデルの表現型※15が改善しました。またA419259の投与により、SBMAマウスモデルの脊髄と骨格筋のSrcのリン酸化が抑制されました。
Srcシグナルは、様々な分子の活性を制御しています。今回Srcの活性化を抑える化合物を投与したSBMA細胞モデルとSBMAマウスモデルを解析したところ、Srcが活性化された結果p130Casがリン酸化され、そのことがSBMAの病態に関与していることが明らかになりました。
さらに、本研究ではSBMAにおいてSrcが活性化する仕組みも解明しました。ARとSrcの両者の結合部位を欠損させた遺伝子を作成し細胞に強制的に発現させると、両者の結合部位を欠損させていない遺伝子を発現させている細胞と比較して、Srcの活性化が低下しました。これは、Srcの活性化にはARとSrcの直接的な結合が重要であることを示唆する結果であるといえます。
今後の展開
本研究ではSrcの活性化を抑える化合物がSBMAの新規治療薬として有望であることが示唆されました(図5)。Srcの活性化を抑える化合物の中には、癌の治療薬として臨床応用されている薬剤もしくは治験中の薬剤が複数存在します。今後、それらの薬剤を対象に、SBMAに係る病態改善の有効性について解析を進める予定です。
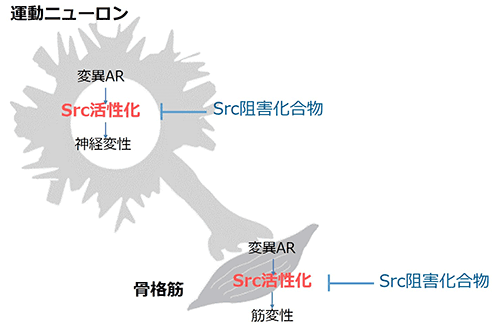
図5 SBMAにおけるSrcの異常活性化
SBMAでは神経と骨格筋においてSrcが活性化しており、Srcの活性化を抑える化合物の投与により神経変性と筋変性が改善しました。
用語説明
- ※1 神経変性疾患:
- 特定の種類の神経細胞の進行性に障害が起きる病気の総称。神経細胞の中や周囲に異常なタンパク質が蓄積しており、それにより細胞が弱って死んでいきます。
- ※2 球脊髄性筋萎縮症(SBMA):
- 成人に発症する遺伝性の神経変性疾患で、男性のみが発症し、全身の筋力低下や食べ物の飲み込みにくさ、しゃべりにくさ等の症状が現れ、徐々に進行します。ポリグルタミンという異常な構造をもったアンドロゲン受容体タンパク質が男性ホルモンと結合することにより、細胞の核内に蓄積して神経や骨格筋の細胞が死んでいきます。
- ※3 Src:
- 非受容体型チロシンキナーゼタンパク質(細胞内にチロシンキナーゼドメインをもつタンパク質)の1つであり、ヒトの多くの癌においてSrcが活性化しており、癌の進行や転移に関連しています。
- ※4 シグナル:
- 細胞の情報を伝える流れ、道すじ。
- ※5 神経筋疾患:
- 神経や骨格筋の細胞に障害が起きる疾患。
- ※6 アンドロゲン受容体(AR):
- アンドロゲンホルモンであるテストステロンなどと細胞質で結合し、活性化されて核内に移行します。転写因子として働き、遺伝子の発現を制御します。
- ※7 iPS細胞由来運動ニューロン:
- SBMA患者から得たiPS細胞に化合物を添加して、運動神経へと分化を誘導させた細胞。
- ※8 細胞モデルのviability:
- 細胞の元気の良さを意味しており、細胞の生存率などを指標にして測定します。
- ※9 p130Cas:
- 細胞接着(細胞同士もしくは細胞外組織への付着)に関与する分子。多くの癌においてp130Casの活性化が報告されています。
- ※10 ポリグルタミンタンパク質:
- CAG繰り返し塩基配列の異常伸長によって、過剰に産生されるタンパク質。
- ※11 転写因子:
- DNA上の転写を制御する領域に結合するタンパクで、DNAの遺伝情報をRNAに転写する過程を促進もしくは抑制します。
- ※12 リュープロレリン酢酸塩:
- 黄体形成ホルモン刺激ホルモンアナログ。テストステロンの分泌を抑制します。
- ※13 骨格筋のタンパク同化作用:
- タンパク質の吸収を促進して、筋肉の成長を促すこと。
- ※14 Bio-Plexマルチプレックスシステム:
- Bio-Rad社が販売している、最大500種類のタンパク質、ペプチド、核酸を同時に測定することが可能な解析手法。
- ※15 表現型:
- 生物の形態、性質、行動など。
発表雑誌
- 掲載紙:
- Nature Communications
- 論文名:
- Src inhibition attenuates polyglutamine-mediated neuromuscular degeneration in spinal and bulbar muscular atrophy
- 著者:
- Madoka Iida1,2, Kentaro Sahashi1, Naohide Kondo1, Hideaki Nakatsuji1, Genki Tohnai1, Yutaka Tsutsumi1, Seiya Noda1,3, Ayuka Murakami1,3, Kazunari Onodera1,4, Yohei Okada1,4,5, Masahiro Nakatochi6, Yuka Tsukagoshi Okabe7, Shinobu Shimizu7, Masaaki Mizuno7, Hiroaki Adachi8, Hideyuki Okano5, Gen Sobue9, Masahisa Katsuno1*
- 所属:
-
- Department of Neurology, Nagoya University Graduate School of Medicine, 65 Tsurumai-cho, Showa-ku, Nagoya city, Aichi 466-8550, Japan
- Japan Society for the Promotion of Science, 5-3-1, Kojimachi, Chiyoda-ku, Tokyo 102-0083, Japan
- Department of Neurology, National Hospital Organization Suzuka National Hospital, 3-2-1, Kasado, Suzuka city, Mie 513-8501, Japan
- Department of Neurology, Aichi Medical University School of Medicine, 1, Yazakokarimata, Nagakute-city, Aichi 480-1195, Japan
- Department of Physiology, Keio University School of Medicine, 35, Shinanomachi, Shinjuku-ku, Tokyo 160-8582, Japan
- Department of Nursing, Nagoya University Graduate School of Medicine, 1-1-20 Daiko-Minami, Higashi-ku, Nagoya city, Aichi 461-8673, Japan
- Department of Advanced Medicine, Nagoya University Hospital, 65 Tsurumai-cho, Showa-ku, Nagoya city, Aichi, 466-8560, Japan
- Department of Neurology, University of Occupational and Environmental Health School of Medicine, 1-1, Iseigaoka, Yahatanichi-ku, Kitakyushu-city, Fukuoka 807-0804, Japan
- Brain and Mind Research Center, Nagoya University, 65 Tsurumai-cho, Showa-ku, Nagoya city, Aichi 466-8550, Japan
- * Corresponding author
- DOI:
- 10.1038/s41467-019-12282-7
お問い合わせ先
研究内容
名古屋大学医学部・医学系研究科 神経内科学
教授 勝野 雅央
広報担当
名古屋大学医学部・医学系研究科総務課総務係
AMED事業に関すること
日本医療研究開発機構 戦略推進部 難病研究課