マイクロチップ技術が実現する「膜たんぱく質機能解析」の新展開
2018-03-06 科学技術振興機構(JST),東京大学,日本医療研究開発機構(AMED)
ポイント
- 膜たんぱく質による脂質の輸送はさまざまな生理機能に関与しており、その活性を計測する方法の高感度化と定量化が求められていたが、技術的な障壁があった。
- 新たなマイクロチップ技術の開発により、計測感度が従来法の約100倍に向上した。
- 創薬候補および薬剤標的を効率的に探索する基盤技術とした応用研究が期待できる。
膜たんぱく質は細胞膜上にあり、情報伝達やエネルギー合成などの重要な役割を担っているたんぱく質です。膜たんぱく質は医薬品の標的として知られており、中でも物質を輸送する膜たんぱく質は、近年特に注目されている薬剤標的です。従来、物質を輸送する膜たんぱく質を創薬の標的とするため、イオンなどの親水性分子の輸送に関して、高感度に計測する手法が多数開発されてきました。しかし、細胞膜を構成するリン脂質分子そのものの輸送を計測するには技術的な障壁があり、これまで計測の高感度化と定量化を実現することは極めて困難でした。
本研究グループは検出感度や定量性の向上のため、①リン脂質分子の輸送を検出するための微小な人工生体膜注2)を高度に集積化したマイクロチップ、②生体膜上のリン脂質組成を非対称化する光操作技術、③これらを組み合わせた脂質輸送の超高感度計測技術を確立しました。現在までに、哺乳類由来の脂質輸送たんぱく質であるTMEM16F注3)の働きを1分子単位で計測できるほどの高感度化を実現することに世界で初めて成功し、従来のリポソーム法の約100倍の超高感度でリン脂質分子の輸送を計測することを可能にしました。
今回開発されたマイクロチップ技術は、リン脂質分子を輸送する膜たんぱく質を標的とした創薬候補を効率的に探索する上で最適な基盤技術になることが期待されます。
なお、本研究の一部は、東京大学の野地 博行 教授、大阪大学の櫻木 嵩晴 大学院生と共同で行ったものです。
本研究成果は、2018年3月5日の週(米国東部時間)に「米国科学アカデミー紀要(PNAS)」のオンライン版で公開されます。
JST 戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 | 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」 (研究総括:若槻 壮市 米国SLAC国立加速器研究所 光科学部門 教授/スタンフォード大学 医学部 構造生物学 教授) |
|---|---|
| 研究課題名 | 膜タンパク質の構造変化と物質輸送の1分子同時計測技術の開発 |
| 研究者 | 渡邉 力也(東京大学 大学院工学系研究科応用化学専攻 講師) |
| 研究期間 | 平成25年10月~平成29年3月 |
JST 戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 | 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」 (研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長) |
|---|---|
| 研究課題名 | 「細胞膜におけるリン脂質の非対称分布とその崩壊」 |
| 研究者 | 長田 重一(大坂大学 免疫学フロンティア研究センター 栄誉教授) |
| 研究期間 | 平成26年10月~平成32年3月 |
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライフサイエンスの革新につながる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題において、渡邉 力也 講師はナノ反応容器を利用して、膜たんぱく質の物質輸送と構造変化を1分子単位で同時に計測できる技術を新規開発し、構造機能相関の直接的な解明から、それらの作動原理の理解を目的としています。長田 重一チームは、世界に先駆けて同定した、細胞膜の非対称性の維持、崩壊に関与する3個の膜たんぱく質の分子の構造、作用機構を明らかにすることを目的としています。
細胞の表面には、膜たんぱく質と呼ばれるたんぱく質が存在しており、情報伝達やエネルギー合成など生理的に重要な役割を担っています。その中でも、物質を輸送する膜たんぱく質は近年特に注目されている薬剤標的であり、その輸送活性を高感度かつ定量的に計測することで、薬剤の効果を評価する試みがなされています。これまで、イオンなどの親水性分子の輸送については、1分子単位で高感度に計測する手法が多数開発されてきました。しかし、薬剤や脂質などの疎水性分子の輸送を計測するには、標的分子の取り扱いの難しさなどの技術的な障壁があり、高感度化と定量化を実現することは極めて困難でした。
膜たんぱく質が輸送する疎水性分子の代表として「リン脂質」が挙げられます。リン脂質は生体膜の主成分で、生体膜を構成する2層構造に異なる組成で存在すること(非対称性)が知られています。この脂質組成の非対称性の維持と崩壊は、膜たんぱく質が脂質を輸送することで実現しており、さまざまな生理機能に関与しています。例えば、リン脂質の一種であるフォスファチジルセリン(PS)は、通常、生体膜中で非対称に存在していますが、外部のシグナルに応答して膜たんぱく質が活性化すると、その輸送により脂質組成の非対称性は崩壊します。このPSの非対称性の崩壊に伴い、アポトーシス注4)を起こした細胞は、自らが死んでいるというシグナルを外部に発信し、血小板で血液の凝固を促進します。これらの生理機能に関わる脂質輸送たんぱく質にも薬剤標的を拡張するためには、疎水性分子の輸送を高感度かつ定量的に計測し、現状の技術障壁を打破できる新規技術の開発が急務とされていました。
本研究グループは、脂質輸送の活性計測を高感度化するため、超高密度な人工生体膜チップの新規開発と、これを用いた脂質輸送の超高感度計測技術の確立を目指しました。具体的には、超高密度人工生体膜チップを開発し、独自の光操作技術を用いることで、チップ上の人工生体膜に対して、細胞環境と同様の「脂質組成の非対称性」を再現することに成功しました。そして、膜たんぱく質の脂質輸送によって、脂質組成の非対称性が崩壊する過程を1分子単位の超高感度で検出することを可能としました。
1.超高密度人工生体膜チップの新規開発
これまでに作製した表面積が10平方マイクロメートル(マイクロは100万分の1)程度の均一な人工生体膜を約10万個集積した超高密度人工生体膜チップ(大きさ:24ミリメートル×32ミリメートル)を改良し、リン脂質分子の輸送を検出するための工夫をしました(図1)。このチップでは、直径3~8マイクロメートルの円筒形上のくぼみが集積化されていますが、その開口部にリン脂質の2重層で構成される生体膜を形成しました。また、開口部以外の表面はリン脂質の1重層で覆いました。さらに、独自の光操作技術を用いることで、蛍光標識したリン脂質(蛍光脂質)が外層にのみ存在する非対称な生体膜を形成することに今回成功しました(図2)。従来のリポソーム法では、非対称性を形成する手法が複雑で、また、脂質組成の非対称性が自発的に崩壊することから、脂質輸送の定量的な計測が困難でしたが、このマイクロチップでは、2時間以上にわたり脂質組成の非対称性を維持することに成功しています。すなわち、膜たんぱく質による脂質輸送を高感度、高効率、定量的に計測する上で最適な基盤技術といえます。
2.脂質輸送の高感度計測技術の確立
新たに開発した超高密度人工生体膜チップを用いて、膜たんぱく質による脂質輸送の高感度計測技術を確立しました(図3)。まず、脂質輸送の計測のため、くぼみの開口部に形成された人工生体膜へ脂質輸送たんぱく質を組み込み、蛍光標識した脂質を生体膜の内層へ輸送させます。輸送された蛍光脂質は、微小な人工生体膜の内層に濃縮されるため、たんぱく質の働きが弱くても、蛍光脂質の濃度変化は顕著に増大します。そのため、輸送された蛍光脂質に由来する蛍光強度の上昇から、脂質輸送たんぱく質の脂質輸送を高感度かつ定量的に検出できるようになります。現在までに、哺乳類由来の脂質輸送たんぱく質であるTMEM16Fが生体膜に1分子しか存在しなくとも、その脂質輸送活性を検出できるほどの高感度化に成功しており、これは、従来法のリポソーム法が100分子以上の膜たんぱく質を必要とすることを考えると、100倍以上の計測感度の向上を達成したといえます。このように、当該技術の開発により、膜たんぱく質による疎水性分子の輸送に関して、超高感度機能解析の第一歩を確立しました。
膜たんぱく質による脂質の輸送は多くの生理機能に関与しているにも関わらず、その作動メカニズムには不明な点が多く残されています。今後、本研究で開発されたマイクロチップ技術を応用することで、さまざまな脂質輸送たんぱく質の機能や作動メカニズムだけでなく、それらに関連する疾患への理解が大幅に促進されると考えられます。また、本研究で開発したマイクロチップには、非対称な人工生体膜が高度に集積化されているため、それらを並列利用することができれば、脂質輸送に関わる膜たんぱく質を標的とした創薬候補の高速スクリーニング、および、薬剤標的となる膜たんぱく質の大規模な探索に最適な基盤技術となることが強く期待されます。
本成果は、渡邉講師らが近年開発した人工生体膜チップ群(特許第6281834号、WO2016/199741、特願2017-040664、特願2017-131882)の汎用性を高める技術であり、今後は実用化を希望する企業との研究開発を進めていく予定です。
本研究は日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山 信治)における研究開発課題「脂質輸送タンパク質の高感度機能解析にむけた生体膜マイクロチップの開発と創薬への応用」(研究開発代表者:渡邉 力也)の一環として行われました。
![]()
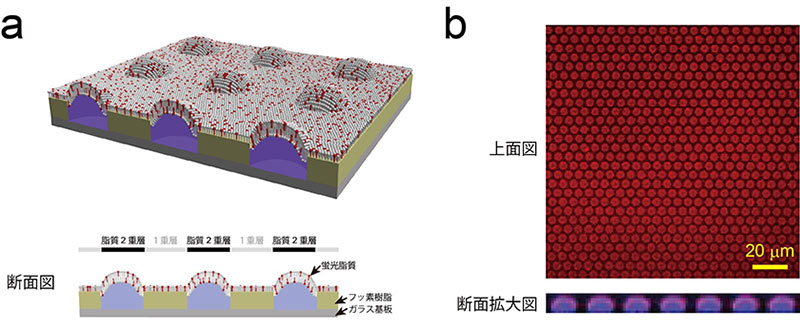
図1 超高密度人工生体膜チップ模式図および蛍光画像
(a)超高密度人工生体膜チップの模式図。直径4マイクロメートル、高さ500ナノメートルの微小なくぼみの開口部に脂質2重層が形成される。また、開口部以外の表面は脂質1重層で覆われている。
(b)蛍光標識したリン脂質(赤色)を配置したときのチップの蛍光画像。くぼみには、蛍光色素(紫色)を含む水溶液が封入されている。
![]()
図2 光操作による脂質組成の非対称化技術
(a)脂質組成の非対称化手法の模式図。マイクロチップには蛍光脂質を含有する人工生体膜が形成されている。くぼみの開口部に存在する脂質2重層に対して、強力なレーザー光を照射することで、外層にのみ蛍光脂質が局在する非対称な脂質組成を持つ生体膜を形成できる。
(b)光照射前および照射後の蛍光標識したリン脂質(赤色)を配置したときのチップの蛍光画像。光照射前、くぼみに形成されている生体膜(脂質2重層)の蛍光強度は、周囲を覆っている脂質1重層と比較して約2倍の強度を持つ。光照射後、外層にしか蛍光脂質は存在しないため、蛍光強度は周囲の脂質1重層と同等となる。
![]()
図3 膜たんぱく質による脂質輸送の1分子単位での超高感度計測例
異なる分子数の膜たんぱく質(TMEM16F)を人工生体膜に組み込み、その蛍光強度の変化を蛍光顕微鏡で観察した。本計測系では、生体膜の蛍光強度の変化を計測することで、膜たんぱく質の脂質輸送速度が分かる。
(a)膜たんぱく質による脂質輸送の高感度検出系の模式図。膜たんぱく質の働きにより、生体膜の外層から内層へ蛍光脂質が輸送されるため、生体膜の蛍光強度が周囲の脂質1重膜よりも上昇する。
(b)蛍光標識したリン脂質(赤色)を配置したときのチップの蛍光画像(左図)と蛍光強度の経時変化(右図)。膜たんぱく質の活性化剤である塩化カルシウム(CaCl2)を添加すると、その働きにより生体膜の外層から内層へ蛍光脂質が輸送され、蛍光強度が上昇している様子が観察された。
- 注1) リポソーム法
- 脂質組成の非対称な脂質2重層でできた直径100ナノメートル程度のマイクロカプセルを作成し、膜たんぱく質による脂質の輸送を蛍光分光器で検出する方法。
- 注2) 人工生体膜
- リン脂質を利用して人工的に形成される脂質2重膜の総称。
- 注3) TMEM16F
- 脂質輸送を行う膜たんぱく質。血小板に発現するTMEM16Fの遺伝子変異が血友病の一種であるスコット症候群を引き起こすことが知られている。
- 注4) アポトーシス
- 生体の必要に応じて細胞が自殺する現象で、あらかじめプログラムされた細胞死である。
“Single molecule analysis of phospholipid scrambling by TMEM16F”
(TMEM16Fによる脂質輸送の1分子解析)
doi: 10.1073/pnas.1717956115
渡邉 力也(ワタナベ リキヤ)
東京大学 大学院工学系研究科 応用化学専攻 講師
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
日本医療研究開発機構(AMED) 基盤研究事業部 研究企画課
科学技術振興機構 広報課
東京大学 大学院工学系研究科 広報室
日本医療研究開発機構 経営企画部 企画・広報グループ