2018-03-15 理化学研究所,日本医療研究開発機構
要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センタートランスクリプトーム研究チームの高橋葉月リサーチアソシエイトとピエロ・カルニンチ チームリーダーらの研究チームは、メッセンジャーRNA(mRNA)[1]と結合してタンパク質の合成を促進するアンチセンスRNA[1]「SINEUP(サインアップ)[2]」の機能解析を行い、標的となるmRNAに最適なSINEUP配列を設計する手法を開発しました。
SINEUPは、マウスの脳で発現するアンチセンスRNAとして発見され、ゲノムに散在する短い反復配列(SINE B2因子[3])を持ち、標的mRNAのタンパク質合成を翻訳の段階で促進(UP)する機能からこの名が付けられました。SINEUPの翻訳促進機能は、mRNAと相補的な配列を含む「結合領域」と、翻訳を促進する鍵であるSINE B2配列を含む「機能領域」の二つが担います。結合領域を改変し、任意のmRNAを標的とするように合成されたアンチセンスRNAは「SINEUPs」と呼ばれ、タンパク質の合成を促進する遺伝子実験のツールとして臨床応用も視野に入れた研究開発が進められています。しかし、結合領域や機能領域はどのような配列が最適であり、必須となる配列要素はどの部分かといった情報はありませんでした。
今回、研究チームは、蛍光タンパク質EGFP[4]のmRNAをSINEUPsの標的モデルとし、培養細胞に導入した際のEGFPタンパク質の量や蛍光の強さを指標にすることで、結合領域と機能領域のさまざまな変異体の翻訳促進効果を評価しました。その結果、最適な結合領域は開始コドン[5]周辺のKozak配列[6]を含むことや、機能領域の2次構造にはステムループ[7]が必須であることを解明しました。また、SINEUPsが標的mRNAと結合すると2本鎖RNAが形成されますが、2本鎖RNAがしばしば引き起こす細胞のストレス反応は、SINEUPsを導入した細胞では観察されませんでした。
本成果は、タンパク質の合成を促進する技術としてSINEUPsを用いる際に、最適な結合配列のデザインや、細胞へのストレスを考慮するための重要な情報となります。特に2本鎖RNA特有の細胞ストレス反応が誘導されなかったことから、副作用の少ない核酸医薬[8]としてSINEUPsの医療応用が期待できます。
本研究は、米国のオンライン科学雑誌『PLOS ONE』(2月7日付け)に掲載されました。
本研究の一部は、日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業「タンパク質翻訳を促進する新規ノンコーディングRNAを用いた革新的創薬プラットフォームの構築」の支援によって行われました。
背景
アンチセンスRNAは、タンパク質をコードしないノンコーディングRNA(ncRNA)の一種であり、配列の一部あるいは全部がタンパク質をコードするメッセンジャーRNA(mRNA)と相補的なものを指します。アンチセンスRNAは、標的mRNAと結合すると部分的に2本鎖RNAを形成し、その結果mRNAの分解を介してタンパク質合成量を低下させる例が多く知られています。しかし、2012年にカルニンチ チームリーダーらは、mRNA量には影響を与えず(mRNAの量を増やさず)、翻訳段階でタンパク質の合成を促進するユニークな機能を持つアンチセンスRNAを発見し、「SINEUP(サインアップ)」と名付けました注1)。
マウスで見つかったSINEUPは、5’末端[9]側に標的mRNAの5’末端側と相補的な配列(結合領域、Binding Domain:BD)があります。また3’末端[9]側には短い反復配列(SINE B2)があり、この領域がタンパク質の翻訳促進に重要な役割を果たしています(機能領域、Effector Domain:ED)(図1)。
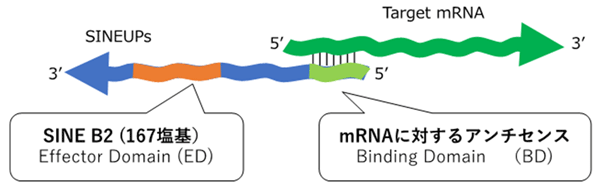
図1 SINEUPの主な構成要素
標的となるmRNA(上)に対応するSINEUP(下)は、mRNAの5’末端側領域と相補的な配列(結合領域:BD)を持つ。加えて3’末端側にSINE B2配列(機能領域:ED)を持つ。
SINE B2は、ゲノム中に大量に存在するレトロトランスポゾン[10]の一種であり、ヒトにおいても、マウスのSINE B2とは異なるSINE因子(FRAM)が翻訳促進機構を持つことが報告されています注2)。マウスのSINE B2とヒトのFRAMは、配列の類似性は低いものの、1本鎖RNAが折り畳まれて生じる立体構造(2次構造)には共通性があることが示されています。
SINEUPの結合領域を改変し、任意のmRNAに対する標的配列を組み込んだ合成アンチセンスRNAは「SINEUPs」と呼ばれ、タンパク質合成を促進する技術として生命科学実験に用いられています。しかしこれまで、結合配列を設計する上で標的mRNAのどの範囲まで結合させると最も効果的かなど詳細な条件は分かっておらず、機能領域についても、SINE B2配列のどこまでが機能に必須かは不明でした。
本研究ではSINEUPs配列の最適化を目指し、結合領域と機能領域の中で翻訳促進に必須な配列や構造を詳細に解析しました。さらに、SINEUPsの導入により形成される2本鎖RNAが翻訳促進以外の副作用(細胞のストレス応答)を起こす可能性について解析を行いました。
注1)2012年10月25日プレスリリース「タンパク質合成を促進するアンチセンスRNAを初めて発見」 (理研のページ)
注2)2016年10月28日プレスリリース「タンパク質合成を促進する『ジャンク』と呼ばれていたRNA」 (理研のページ)
研究手法と成果
研究チームは、蛍光タンパク質EGFPを標的とするSINEUP-GFPをSINEUPsの評価モデルとし、培養細胞に導入した際のEGFPタンパク質量や蛍光の強さを指標にすることで、結合領域と機能領域のさまざまな変異体の翻訳促進効果を調べました。特に今回開発した蛍光強度を測定する方法は、短時間で多数の変異体を解析できる優れたスクリーニング法です(図2)。
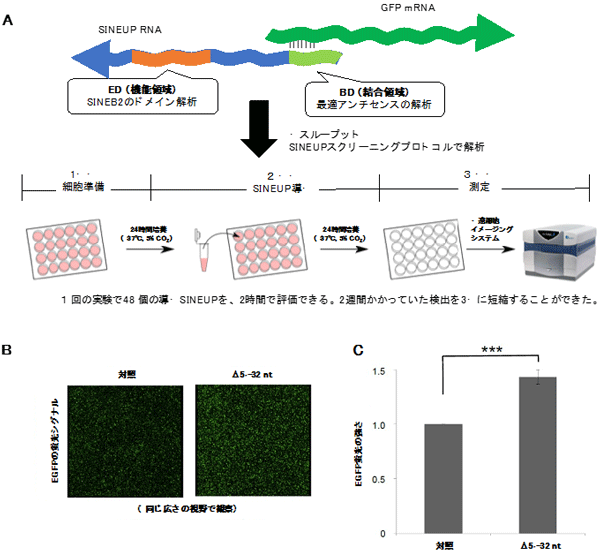
図2 蛍光強度測定を用いたSINEUPsスクリーニング方法の確立
- 蛍光強度を用いたSINEUPsのスクリーニング方法の概要。
- SINEUP-GFPのBD変異体Δ5′-32ntを用い高速細胞イメージングシステムで蛍光シグナルを抽出した結果、SINEUPを入れていないControl(左)に比べΔ5′-32nt(右)のEGFPシグナル強度が上がった。
- Bのイメージを用い、全細胞数から換算したEGFPシグナルの積分強度を比で表した結果。
まず、結合配列に最適な領域を決定するため、EGFPの転写開始点である開始コドン(AUG)の28塩基上流から、下流側32塩基にわたる60塩基に対応するさまざまな長さの結合配列を設計しました(図3A)。EGFPを発現する培養細胞にこれらのSINEUP-GFPを導入し、EGFPタンパク質の合成量を測定した結果、開始コドンの28塩基上流から下流側4塩基の合計32塩基に対応するアンチセンス鎖を持つ「SINEUP-GFP(Δ5′-32nt)」が、最も翻訳を促進することが分かりました(図3B)。この領域は、真核生物mRNAのリボソーム[11]認識部位であるKozak配列を含んでおり、Kozak配列との結合配列を削除した変異体は翻訳促進活性を失いました。
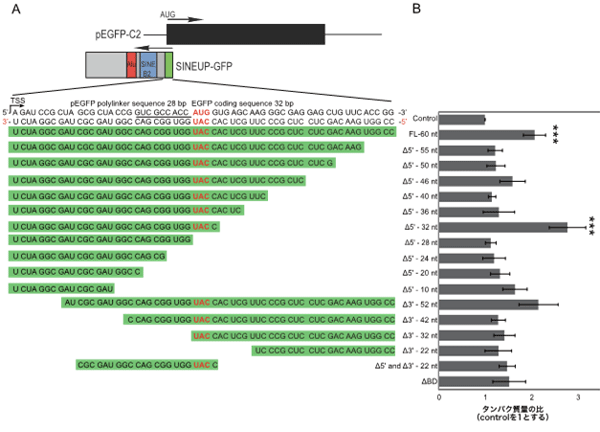
図3 SINEUP-GFPの結合領域の最適化
- GFPおよびSINEUP-GFPの遺伝子構造の模式図と、EGFPの翻訳開始コドン(AUG)周辺の配列。SINEUP-GFPの配列はEGFPの相補鎖となっている。本実験で使用した結合配列のシリーズを緑色の背景で示した。
- ヒト培養細胞(HEK293T/17)にEGFP発現ベクターとSINEUP-GFPのBD変異体を導入し、SINEUP-GFPのタンパク質量をウェスタンブロットで確認した。SINEUP-GFPのKozak配列であるACCAUGGと相補的な配列を持つ最も短い32塩基の結合領域変異体SINEUP-GFP(Δ5′-32nt)が、最も高い翻訳促進活性を示した。
次に、機能領域の翻訳促進に必須な構造や配列を確認するため、RNAの2次構造を予測するプログラムの解析結果をもとにSINE B2を五つのサブドメインに分け、それぞれに欠失や変異を持つ機能領域の翻訳促進活性を調べました。その結果、サブドメインの配列を欠失させるといずれも活性は失われました(図4A)。さらに、2次構造と機能の関係を調べるため、最も強固なステムループを形成すると予測されたサブドメインについて、ステムループを壊さない1塩基欠損・1塩基付加と、ステムループを壊す2塩基置換の効果を調べました。ステムループを壊すと翻訳促進の機能が失われたことから、SINE B2の翻訳促進にはステムループ構造が必須であることが示されました(図4B)。これらの結果から、Kozak配列に結合したSINEUP-GFPは、ステムループを含む2次構造を介してmRNAのリボソームへの結合を高めている可能性が示されました。
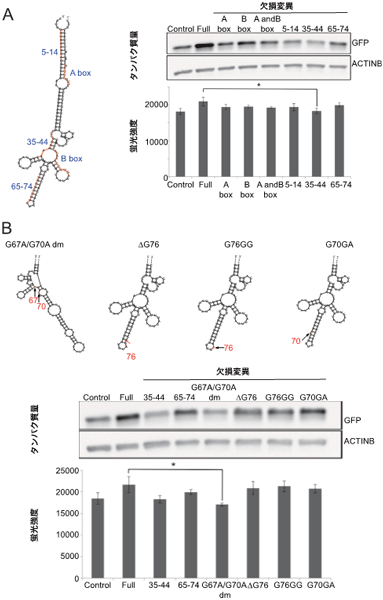
図4 SINEUP-GFPの活性に必要なSINE B2サブドメインの解析
- SINE B2の2次構造予測と、それぞれのサブドメインの欠失変異の翻訳活性をウェスタンブロットによるタンパク質量のバンドの濃さと、蛍光強度で解析した結果。ほぼ全ての欠失変異で、翻訳促進機能が減衰または喪失した。
- ステムループドメインの変異体、およびその翻訳活性を解析した結果。ステムループ構造が破壊されたG67A/G70A変異体は翻訳促進機能が喪失した。
またSINE因子には、2本鎖RNA依存性プロテインキナーゼ(PKR)[12]を活性化し、翻訳開始を担うEIF-2a[13]をリン酸化し細胞のストレス応答を引き起こすものが知られています。SINEUPsの結合領域とmRNAの結合により2本鎖RNAが形成されますが、SINEUP-GFPを導入した細胞ではPKRやEIF-2aに変化はみられませんでした。このことから、SINEUPsによって生じる2本鎖RNAは、細胞のストレス応答を引き起こさないことが示唆されました。
今後の期待
DNAやRNAの相補性を利用した核酸医薬や遺伝子機能制御ツールは、標的以外の配列に結合して意図しない遺伝子に作用を及ぼす可能性を、できる限り除去する必要があります。アンチセンス鎖の配列は短すぎても長すぎても問題となるため、今回の解析で結合配列を32塩基まで絞り込めたことは、SINEUPsの臨床応用を検討する上で重要な情報となります。特に2本鎖RNA特有の細胞ストレス反応が誘導されなかったことから、ハプロ不全[14]などタンパク質の発現が低下する疾患に対する副作用の少ない核酸医薬として、SINEUPsの医療応用が期待できます。
今後、本研究で開発した蛍光強度から翻訳促進活性を評価する手法を用い、SINEUPsの機能に関わる配列をさらに詳細に同定し、SINEUPsの改良を進めます。
論文情報
- タイトル
- Identification of functional features of synthetic SINEUPs, antisense lncRNAs that specifically enhance protein translation
- 著者名
- Hazuki Takahashi, Ana Kozhuharova, Harshita Sharma, Masakazu Hirose, Takako Ohyama, Francesca Fasolo, Toshio Yamazaki, Diego Cotella, Claudio Santoro, Silvia Zucchelli, Stefano Gustincich, Piero Carninci
- 雑誌
- PLOS ONE
- DOI
- 10.1371/journal.pone.0183229
補足説明
- [1] メッセンジャーRNA(mRNA)、アンチセンスRNA
- DNAの配列として書かれた遺伝情報はRNAに転写される。タンパク質をコードするメッセンジャーRNA(mRNA)のように、意味を持つ配列として転写されたRNAをセンスRNAと呼ぶのに対し、その相補的な配列を持つRNAをアンチセンスRNAと呼ぶ。
- [2] SINEUP(サインアップ)
- マウスのUchl1遺伝子のアンチセンスRNAがUchl1タンパク質の合成を促進する現象の発見をきっかけに見いだされた、新しいタイプのノンコーディングRNA。SINE因子の配列を持ちタンパク質翻訳を促進する機能領域(ED:Effector Domain)と、標的mRNAと相補的な配列を持つ結合領域(BD:Binding Domain)の二つのドメインで構成される。任意の標的mRNAからのタンパク質翻訳を促進するツールとして使うことができるため、研究用試薬やタンパク質製造ツールから核酸医薬まで、幅広い応用が進んでいる。SINE element-containing translation UP-regulatorの略。
- [3] SINE B2因子
- マウスに特有の短鎖散在反復配列(SINE)の一種。ゲノムの特定の塩基配列がコピーされ、これが再びゲノムに挿入されたもの。生物進化の過程において、ある生物のゲノムの特定の場所にSINEが挿入されると、これが子孫に受け継がれる。このことから、多数の生物のSINEを分析すると系統関係が分かる。「ジャンクDNA」とも呼ばれている。SINE は、short interspersed nuclear elementの略。
- [4] EGFP
- 発光クラゲに由来する緑色蛍光タンパク質GFPを改良し、蛍光を強くした変種。Enhanced Green Fluorescent Proteinの略。
- [5] 開始コドン
- mRNAの翻訳開始配列となるAUGコドン。通常は、タンパク質の読み枠に登場する最初のメチオニンをコードするAUGが開始コドンとなる。
- [6] Kozak配列
- コザック配列。真核生物のmRNAに共通して見られる開始コドン周辺の配列で、リボソームの翻訳開始点の認識に関与していると考えられている。
- [7] ステムループ
- 1本鎖のRNAは、分子内で塩基同士(AとU、CとG)が水素結合することで局所的に2本鎖を形成する。2本鎖の部分をステムと呼び、ステムを構成するRNAが折れ曲がって環状の1本鎖となっている構造をステムループと呼ぶ。トランスファーRNA(tRNA)などでみられるRNAの2次構造。
- [8] 核酸医薬
- DNAやRNAを用いた医薬品。塩基の相補性を利用して特定の配列を持つDNAやRNAに作用させたり、2本鎖DNAや折り畳まれた核酸がとる立体構造を利用して特定のタンパク質と結合させるなど、核酸の持つ性質を応用したもの。
- [9] 5’末端、3’末端
- RNAはヌクレオシドの2′-リボースの5’位のヒドロキシ基と3’位のヒドロキシ基がリン酸ジエステル結合によって連結されてできている。RNAの5’位のヒドロキシ基側を5’末端と呼び、3’位のヒドロキシ基側を3’末端と呼ぶ。RNAの5’末端はDNA上の転写開始点に相当する。
- [10] レトロトランスポゾン
- HIVなどのレトロウィルスのように、DNA→RNAへの転写と、RNA→DNAへの逆転写によって増殖する性質を持つ遺伝因子。ゲノム上のレトロトランスポゾンが転写されてRNAになり、さらに逆転写酵素によりDNAに戻ることでゲノム中を移動しコピー数を増やす。ヒトゲノムの進化の過程で、ほとんどのレトロトランスポゾンは不活性化され、その残骸は機能しない「ジャンク」配列と長らく考えられていた。
- [11] リボソーム
- タンパク質を合成する細胞小器官。アミノ酸を結合したtRNAを呼び込み、mRNAにコードされた順番通りにアミノ酸を連結する。
- [12] 2本鎖RNA依存性プロテインキナーゼ(PKR)
- 2本鎖RNAによって活性化されるタンパク質リン酸化酵素(Protein Kinase R)。ウイルス感染や栄養飢餓、放射線、機械刺激など、さまざまなストレスを受けた細胞のストレス応答に関与する。
- [13] EIF-2a
- 真核生物の翻訳開始因子の一つ。細胞ストレス下でリン酸化を受け、翻訳調節を介したストレス応答に関わると考えられている。
- [14] ハプロ不全
- 2倍体の生物であるヒトは、二つある対立遺伝子のうち一つが正常であれば十分量のタンパク質が作られ、多くの場合は表現型として影響が現れない。これに対し、正常な遺伝子が一つだけでは十分なタンパク質量が生産できず、機能を維持できない現象をハプロ不全と呼ぶ。このとき、正常な遺伝子から転写されるmRNAを標的とするSINEUPを細胞に導入すれば、タンパク質の合成量が増加し機能を回復させることができると期待される。
発表者・機関窓口
発表者
理化学研究所 ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門
LSA要素技術研究グループ トランスクリプトーム研究チーム
リサーチアソシエイト 高橋 葉月 (たかはし はづき)
チームリーダー ピエロ・カルニンチ (Piero Carninci)
機関窓口
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
理化学研究所 広報室 報道担当
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課