2018-03-27 東京大学,日本医療研究開発機構
発表者
小幡 史明(東京大学大学院薬学系研究科 薬科学専攻 助教)
津田(櫻井) 香代子(東京大学大学院薬学系研究科 薬科学専攻 特任研究員)
三浦 正幸(東京大学大学院薬学系研究科 薬科学専攻 教授)
発表のポイント
- 栄養分に含まれる必須アミノ酸の一つメチオニンが、腸幹細胞の分裂に重要であることを明らかにしました。また、メチオニンそのものではなく、その代謝物であるS-アデノシルメチオニン(SAM)が、腸幹細胞の活性を調節していることを明らかにしました。
- SAMはタンパク質翻訳因子のメチル化を介して、翻訳活性化と幹細胞分裂を制御していることを見出しました。
- SAMは腸上皮細胞においては、腸幹細胞の分裂を促すサイトカインの発現を制御し、腸細胞間の相互作用による腸組織の定足数制御及び恒常性維持にも働くことが分かりました。
発表概要
食物由来の栄養因子とその代謝産物は生体組織の恒常性(注1)を保ち、健康維持に欠かせないものです。組織の恒常性維持は組織幹細胞(注2)の増殖と分化によって保たれています。しかし、栄養因子がどのように組織幹細胞の分裂と分化に関わっているかについては理解が進んでいませんでした。
東京大学大学院薬学系研究科の小幡史明助教、津田(櫻井)香代子特任研究員、三浦正幸教授らは、ショウジョウバエをモデルとして、摂取栄養分に含まれるメチオニンの一次代謝産物であるS-アデノシルメチオニン(SAM)が、腸幹細胞の分裂を制御していることを明らかにしました。これまでの研究により、栄養飢餓状態に置かれた腸幹細胞は分裂活性が低下することが報告されていますが、メチオニンやSAMを欠乏させた腸幹細胞も、分裂頻度が低下することを発見しました。SAMはメチル基転移酵素(注3)の基質となり、細胞内において様々な標的分子のメチル化に使われることで、標的分子の機能を制御することが知られています。本研究において、遺伝学的手法により、タンパク質翻訳因子のメチル化と翻訳活性亢進が腸幹細胞の分裂を制御していることが示されました。
これとは対照的に、分裂を起こさない栄養吸収性の細胞である腸上皮細胞においてSAMが欠乏した場合は、サイトカイン(注4)の一種であるUpd3の産生が誘導されることが分かりました。このUpd3は、飢餓状態からの再摂食時に起きる腸幹細胞の分裂活性化に必要であることも分かりました。今回の研究により、腸組織ではSAMが指令分子となって、異なる細胞(幹細胞・栄養吸収細胞)で異なる機能を発揮することで、栄養依存的に組織の恒常性が維持されていることが明らかになりました。
本研究は、国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域(※)における研究開発課題「個体における組織細胞定足数制御による恒常性維持機構の解明」(研究開発代表者:三浦正幸)、老化メカニズムの解明・制御プロジェクト、文部科学省科学研究費補助金基盤研究(S)及び挑戦的萌芽研究、の一環で行われました。
(※)当該開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
発表内容
➀研究背景
組織の恒常性は体性幹細胞の自己増殖と分化によって保たれています。腸組織もその一つであり、腸幹細胞の活発な分裂と分化によって、組織中の細胞数が一定に保たれている非常に可塑性の高い組織です。腸組織は摂取した栄養分を吸収する組織で、飢餓時には腸上皮細胞が失われたりすることで腸が萎縮する一方、再摂食時には腸幹細胞の分裂が活性化し、萎縮した腸を元に戻すことが知られています。しかしながら、栄養分がどのように腸幹細胞に作用して分裂を制御しているのか、詳細な分子メカニズムについては不明な点が多く残されていました。その理由の一つとして、腸幹細胞や上皮細胞、分泌細胞など、細胞によって飢餓応答システムが違うことが挙げられます。したがって細胞特異的に遺伝子操作が可能な解析システムが必要でした。
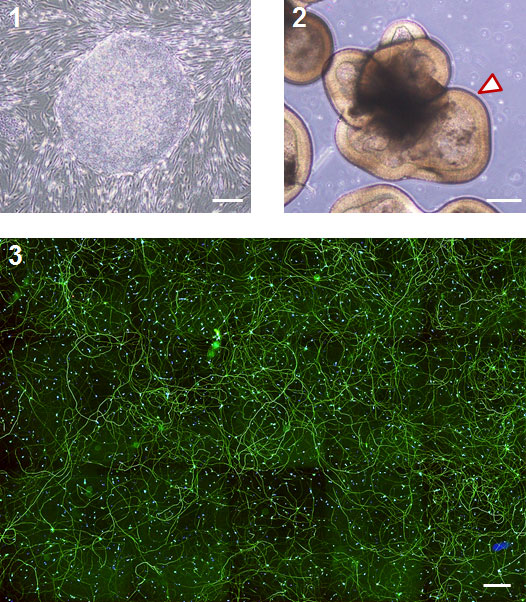
モデル生物として用いられるショウジョウバエの腸組織にも、哺乳類同様に幹細胞が存在し、飢餓時の腸萎縮と再摂食時の幹細胞分裂活性化が観察されます(図1)。また、ショウジョウバエは遺伝学を用いた解析手法に優れており、細胞特異的に遺伝子操作を行うことが可能です。研究グループではこのショウジョウバエを利用することで、細胞特異的な飢餓応答を解析しました。
メチオニンは多くの動物にとっての必須アミノ酸であり、その一次代謝産物であるSAMはタンパク質、核酸、脂質などのメチル化に使われます。ヒトiPS及びES細胞を用いたこれまでの研究で、このSAMが多能性幹細胞(注2)の生存と自己複製に必須であることが示されています。そこで、本研究では腸幹細胞における栄養依存的な組織恒常性維持にSAMが関わっているのかを検討しました。
②研究内容
本研究ではまず、腸幹細胞分裂を観察しやすくするため、ブレオマイシン摂食(注5)による代償性増殖を誘導する実験系におけるメチオニンの効果を観察しました。ブレオマイシンは腸上皮細胞にダメージを与え、腸幹細胞の分裂を促進することが知られています(図1.代償性増殖)。メチオニン除去餌を与えられた個体の腸では、完全組成餌(コントロール)を与えた場合に比べ、ブレオマイシンによる代償性増殖が抑制されました(図2A)。老化個体の腸では腸幹細胞分裂が過剰になることが知られていますが、この過増殖もメチオニン除去餌で抑えられました。また、飢餓後の再摂食時には腸幹細胞の分裂が活性化します(図1)。再摂食の際にメチオニン除去餌を与えられた個体の腸では、腸幹細胞分裂活性化が抑制されたことから、摂取した餌に含まれるメチオニンが腸幹細胞の分裂に必要であることがわかりました(図2B)。 研究グループは、次に、メチオニンからSAMを合成する酵素であるSamS遺伝子の発現を腸幹細胞特異的に阻害しました。その結果、ブレオマイシンによる代償性増殖、再摂食時の幹細胞分裂活性化のいずれも著しく阻害されたことから、(メチオニンではなく)SAMが腸幹細胞の分裂や腸組織の恒常性維持に必要であることがわかりました(図2C)。
SAMはメチル基転移酵素の基質であることから、遺伝学的手法を用いてショウジョウバエゲノム中に存在するメチル基転移酵素の網羅的スクリーニングを行いました。腸幹細胞特異的に発現を阻害した時に幹細胞増殖が抑制されるメチル基転移酵素を探したところ、Dph5、HemK1およびHemK2の3つのメチル基転移酵素遺伝子が同定されました(図2D)。これらはいずれもタンパク質の翻訳に関わる因子のメチル化に必要な遺伝子で、HemK1および HemK2は翻訳終結因子(eRF1:eukaryotic release factor 1)のメチル化、Dph5は翻訳伸長因子(eEF2:eukaryotic elongation factor 2)のジフタミド修飾(注6)を介し翻訳因子を活性化します。SAMは腸幹細胞において翻訳活性を制御していると考え、腸幹細胞における翻訳活性を測定しました。その結果、腸幹細胞で恒常的に高い翻訳活性が検出され、また飢餓状態の腸やSamSまたはDph5遺伝子発現を低下させた腸幹細胞では、この翻訳活性が低下することもわかりました(図2E)。
一方で、栄養吸収性の腸上皮細胞は、その性質から、栄養分に含まれるメチオニンを初めに感知する細胞であると考えられます。腸上皮細胞におけるSAMの機能を調べるため、腸上皮細胞特異的にSamS遺伝子発現を抑制したところ、サイトカインの一つであるUpd3の発現が有意に上昇することを見出しました。この現象はメチオニン除去食を与えた個体の腸でも観察されました。Upd3はJAK-STAT経路を活性化して腸幹細胞の分裂を促進することが知られています。そこで再摂食時の腸幹細胞分裂活性を測定したところ、upd3変異体では有意に分裂が抑制されたことから、メチオニン飢餓によって誘導されるUpd3が再摂食時の分裂活性化に必要であることがわかりました(図2F)。これらの結果から、SAMが細胞によって異なる飢餓応答を制御することで、腸組織の定足数制御及び恒常性維持に寄与していることが明らかになりました(図3)。
③今後の展望
近年、アミノ酸の代謝が体性幹細胞の分裂やがん細胞の増殖制御に重要な働きを示す例が複数報告されています。例えば、マウスの造血幹細胞の分裂や増殖には、食餌中のバリンが必須であることがわかっています。また、幹細胞の他に活発な増殖を示す細胞としてがん細胞が挙げられます。乳がんではアスパラギン代謝が、白血病においては分岐鎖アミノ酸の代謝変化が、がんの悪性化と密接に関与していることが示されています。このように細胞の種類によって異なるアミノ酸が必要とされることから、今後は生体組織の生理機能や病態機構を探る上で、アミノ酸代謝の解析の重要性が更に高まることが予想されます。また、アミノ酸代謝の細胞特異性を利用した、将来的な新規治療の開発につながることが期待されます。
発表雑誌
- 雑誌名:
- Developmental Cell, Volume 44, Issue 6, March 26, 2018
- doi:
- 10.1016/j.devcel.2018.02.017
- 論文タイトル:
- Nutritional control of stem cell division through S-adenosylmethionine in Drosophila intestine.
- 著者名:
- Fumiaki Obata, Kayoko Tsuda-Sakurai, Takahiro Yamazaki, Ryo Nishio, Kei Nishimura, Masaki Kimura, Masabumi Funakoshi, and Masayuki Miura.
用語解説
- (注1)恒常性:
- 外部環境の変化に対して、内部環境を一定の状態に保つ生物の仕組み。
- (注2)組織幹細胞、多能性幹細胞:
- 自己複製能と分化能を持った細胞のことを幹細胞という。個体組織内に存在し、ある程度分化経路が決まっている幹細胞は組織(体性)幹細胞、iPSやES(胚性幹細胞)などの様々な組織の細胞に分化可能な幹細胞は多能性幹細胞という。
- (注3)メチル基転移酵素:
- SAMを基質として、SAM中のメチル基を標的分子へ転移させメチル化する活性を持つ。メチル基転移酵素が触媒する反応にはDNA、RNAやタンパク質、脂質のメチル化が知られており、遺伝子発現や分子の活性制御に関わっている。
- (注4)サイトカイン:
- 細胞から分泌されるタンパク質で、標的細胞の増殖・分化・細胞死などを誘導する生理活性物質の総称。
- (注5)ブレオマイシン:
- 抗がん剤の一つ。DNAの二本鎖を切断し細胞ダメージを誘導する。
- (注6)ジフタミド修飾:
- SAMを基質として、Dph1から7までの酵素の働きによりeEF2タンパク質が受ける特異的な修飾。真核生物で広く保存されており、eEF2の機能調節に関わる。
添付資料
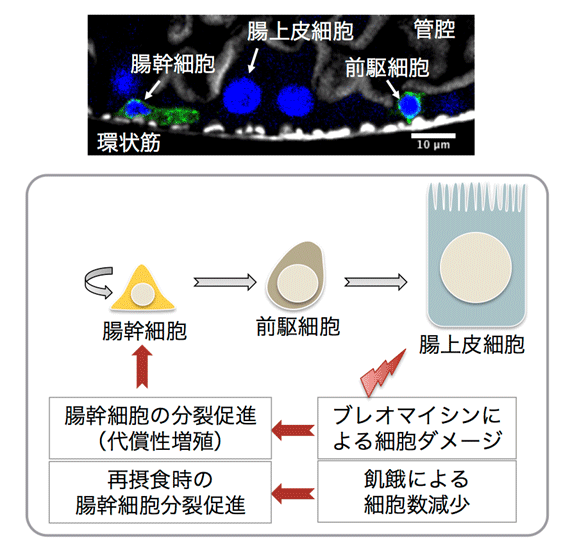
図1. ショウジョウバエの腸の構造と幹細胞による代償性増殖。(上)ショウジョウバエ成虫腸の断面図。細胞が一層に並んでいる。 (下)腸細胞の分化様式。腸幹細胞は分裂して、次の腸幹細胞と前駆細胞を生み出す。前駆細胞は分化して栄養吸収性の上皮細胞になる。ブレオマイシンや飢餓ストレスにより腸上皮細胞がダメージを受けると、腸幹細胞へシグナルが伝わり分裂が促進される。
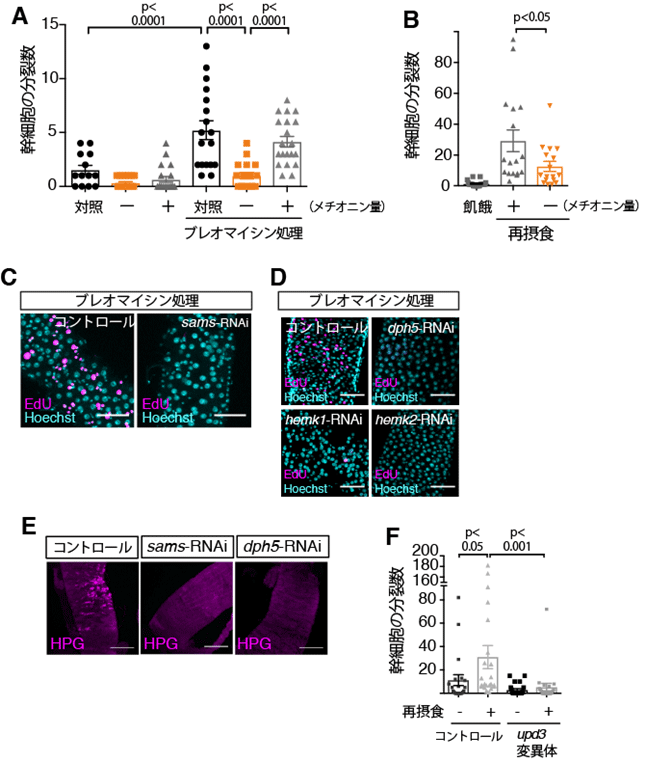
図2.(A)ブレオマイシン処理により、対照群では腸幹細胞の代償性増殖が誘導される。 この時、メチオニン除去食(ー)を与えられた群では、完全合成餌群(+)に比べて分裂が阻害される。対照:通常餌、+:メチオニンを含有する完全合成餌、ー:メチオニンを除去した完全合成餌 。(B) 飢餓後の再摂食時にメチオニン除去食(ー)を与えられた群では腸幹細胞分裂が抑制された。(C)腸幹細胞でSamS遺伝子の発現を抑制すると、ブレオマイシン処理で誘導される腸幹細胞の代償性増殖(核酸の誘導体EdUで標識される(マゼンタ))が減少した。スケールバー:50μm 。(D)メチル基転移酵素Dph5, hemk1/2の発現抑制によって代償性増殖が抑制された。スケールバー:50μm 。(E)SamS, Dph5の発現抑制によって新規タンパク質合成(メチオニンの誘導体HPG(マゼンタ)で標識される)が減少した。 スケールバー:100μm 。(F)再摂食時の腸幹細胞分裂活性化はupd3変異体で抑制されていた。
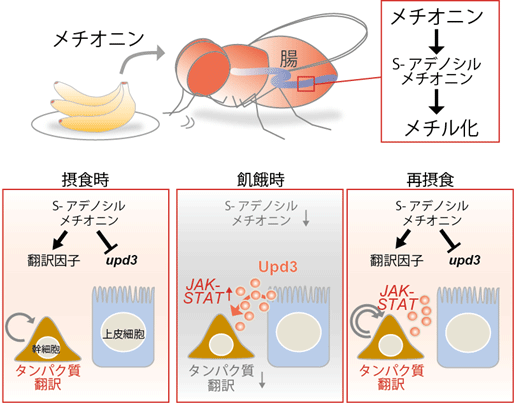
図3. メチオニン代謝による腸組織恒常性維持システムの模式図。通常摂食時、腸に取り込まれたメチオニンはS-アデノシルメチオニン(SAM)に代謝され、腸幹細胞のタンパク質翻訳を活性化する。飢餓時には腸幹細胞における翻訳が低下し、分裂が停止する。SAMは同時に腸上皮細胞からのUpd3分泌を制御する。再摂食時にはこのUpd3によるJAK-STAT経路の活性化と、タンパク質翻訳の亢進によって、腸幹細胞の分裂活性化が起こる。
問い合わせ先
研究に関すること
東京大学大学院薬学系研究科 薬科学専攻
教授 三浦 正幸(みうら まさゆき)
事業に関するお問い合わせ/AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
報道に関するお問い合わせ
東京大学薬学部庶務チーム