腸内フローラの正常化による肝炎悪化・肝がん予防の可能性
2018-05-01 名古屋市立大学,九州大学,国立研究開発法人 日本医療研究開発機構
名古屋市立大学大学院医学研究科の田中靖人教授、井上貴子講師は、九州大学大学院農学研究院の中山二郎准教授、奈良県立医科大学、愛知医科大学との共同研究の成果として、C型肝炎ウイルス(HCV)の持続感染が腸内フローラを変化させ、病状が悪化するにつれて腸内フローラの破綻(dysbiosis)(注1)が進むことを世界で初めて証明しました。これらの結果は、C型肝炎悪化のメカニズムや病態の解明、新薬の開発に道を開く可能性を示しました。本研究は米国科学雑誌「Clinical Infectious Diseases(クリニカル・インフェクシャス・ディジーズ)」の電子版(5月1日付)に公開されます。
本研究成果のポイント
- 肝機能正常HCVキャリア(PNALT)(注2)でも、すでに腸内フローラに変化が現われている。
- PNALT、慢性肝炎、肝硬変、肝がんと病状の悪化に伴って、腸内フローラでの常在菌の占有率が低下し、フローラを構成する細菌の種類が減り、便の水素イオン指数(pH)が高くなっていた。これらの結果は腸内フローラの破綻(dysbiosis)が起きていることを意味している。
- C型肝炎の進行に伴って、腸内フローラにレンサ球菌属のストレプトコッカス・サリバリウスなどが異常に増えていた。これらの菌が腸管で尿素を分解してアンモニアを生産し、便のpHが高くなっている可能性が考えられる。
- こうしたアンモニア生産菌を増殖させないことが、肝硬変などで見られる高アンモニア血症の予防や治療につながる可能性がある。
- より早期からの腸内フローラへの介入[プロバイオティクス(注3)の摂取や投与、適切な抗生剤の投与、口腔ケアなど]がC型肝炎の進行・肝がんの発生を抑える可能性も期待できる。
背景
ヒトの腸内には100兆個を超える腸内細菌が棲みつき、複雑な生態系を形成し「腸内フローラ」と呼ばれています。腸内フローラは私たちの健康の維持や病気の予防などに関与しており、腸内フローラの乱れは健康に悪影響を及ぼすことが示されています。腸内で私たちの腸管や免疫系に重要な働きをする常在菌が減少し、腸内フローラを構成する細菌の種類が減少し(多様性の低下)、その代わりに普段は増加しない菌種が異常に増殖することは、腸内フローラの破綻(dysbiosis)を意味します。
近年、C型肝炎の治療は劇的に進歩し、今まで使用されてきた注射薬(インターフェロン)を使わず、飲み薬(直接作用型抗ウイルス薬)の組み合わせによりほぼ100%ウイルスを排除できるようになりました。しかし肝硬変に至った患者では、ウイルスを駆除しても傷つけられた肝臓を完全に修復することは困難です。腸は血液の循環経路から肝臓とつながりが深く、非代償性肝硬変(注4)の患者では高アンモニア血症の予防・治療のために、抗生剤を用いて腸内フローラの改善が試みられてきました。
本研究では、病期の異なるC型肝炎患者の腸内フローラを解析し、その特徴と体への影響について解明を試みました。
内容
研究グループは、健常人23名、病期の異なるC型肝炎患者166名(肝機能正常HCVキャリア[PNALT] 18名、慢性肝炎 84名、肝硬変 40名、肝がん 24名)の便検体・臨床情報を収集し、次世代シーケンサー(注5)を用いて腸内フローラの特徴を解析しました。その結果、①PNALTでもすでに腸内フローラに変化が現われており、一時的にバクテロイデス属や腸内細菌科の細菌が増加していること、②PNALT、慢性肝炎、肝硬変、肝がんと病期が進むにつれて腸内フローラを構成する菌種が減少(単純化)し、レンサ球菌属のストレプトコッカス・サリバリウスなどが腸管内に増加(図1)して、腸内フローラの破綻(dysbiosis)が見られることを証明しました。
さらに、腸管内で増加しているレンサ球菌属の細菌は、ウレアーゼ(注6)遺伝子を持っていることが分かりました。実際に便の水素イオン指数(pH)を測定したところ、病期が進むにつれて便のpHが上昇し、アルカリ性に傾いていることが分かり、便中アンモニアの増加が予測されました。すなわち、C型肝炎の病期の進行につれて腸内フローラが破綻(dysbiosis)し、腸管内で異常に増殖した細菌がアンモニアの増加を引き起こしている可能性があります。腸管から吸収されたアンモニアが血液中に増加すると高アンモニア血症・肝性脳症(注7)(図2)の原因となることから、ストレプトコッカス・サリバリウスなどのアンモニア生産菌は病期の進行に関与している可能性が示唆されました。
今後の展開
これまでC型肝炎病初期(PNALTや慢性肝炎)の腸内フローラに関する報告はなく、また本研究のように腸内フローラの変化を病期別に解析した研究もありませんでした。この成果により、ストレプトコッカス・サリバリウスなどのアンモニア生産菌を抑え込むことが高アンモニア血症・肝性脳症(図2)の予防や治療につながるとともに、より早期からの腸内フローラへの介入(プロバイオティクス摂取や投与、適切な抗生剤の投与、口腔ケアなど)が病期の進行・肝癌を抑える可能性が期待でき、新規の治療法の開発も期待できます。
用語解説
- (注1)腸内フローラの破綻(dysbiosis):
- フローラを構成する細菌種の異常で、細菌種多様性の減少(単純化)や、少ないはずの細菌種の異常な増加、多いはずの細菌種の減少などを指す。
- (注2)PNALT:
- 肝機能の目安となるALT値が持続的に基準値以下(正常)の状態。
- (注3)プロバイオティクス:
- ビフィズス菌のように、腸内フローラのバランスを改善して有益な作用をもたらす生きた微生物のこと。
- (注4)非代償性肝硬変:
- 重度の肝硬変で必要な肝臓の働きが失われた状態で、様々な合併症(症状)があらわれる。
- (注5)次世代シーケンサー:
- 2000年半ばに登場した、遺伝子の塩基配列を高速に読み出せる装置。
- (注6)ウレアーゼ:
- 尿素を加水分解して、アンモニアと二酸化炭素を作り出す酵素。
- (注7)肝性脳症(図2):
- 肝臓で除去されるはずのアンモニアなどの有害物質が血液中に増加して脳に達し、脳機能が低下した状態。
原著論文
本研究は、Infectious Diseases Society of America(米国感染症学会)の電子版雑誌「Clinical Infectious Diseases(クリニカル・インフェクシャス・ディジーズ)」で2018年5月1日に公開されます。
- 論文タイトル:
- Gut dysbiosis associated with hepatitis C virus infection
(C型肝炎ウイルス感染に伴う腸内細菌叢異常) - 筆者:
- Takako Inoue1, Jiro Nakayama2, Kei Moriya3, Hideto Kawaratani3, Rie Momoda2, Kiyoaki Ito4, Etsuko Iio1, Shunsuke Nojiri1, Kei Fujiwara1, Masashi Yoneda4, Hitoshi Yoshiji3 and Yasuhito Tanaka1
共同研究/協力施設:名古屋市立大学1, 九州大学2,奈良県立医科大学3, 愛知医科大学4
謝辞
本研究はJSPS科学研究費基盤研究C (15K09015)の助成を受け、日本医療研究開発機構(AMED)肝炎等克服実用化研究事業「C型肝炎の新たな治療関連因子及び治癒後の病態進展・改善に関連する宿主因子等の同定を目指したゲノムワイド研究」の支援により行われました。また、本研究にご協力頂きました患者さんのご厚意に深謝いたします。
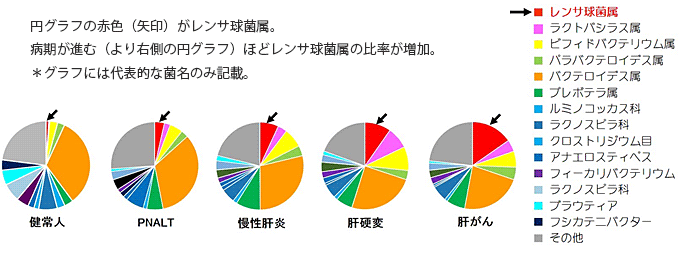
図1 C型肝炎の病期による腸内フローラ中の細菌比率の変化
健常人と比較して、肝機能正常HCVキャリア(PNALT)、慢性肝炎、肝硬変、肝がんと病期が進むにつれて、腸内フローラ中の細菌比率が偏倚し、レンサ球菌属(ストレプトコッカス・サリバリウスなど)の比率が増える。
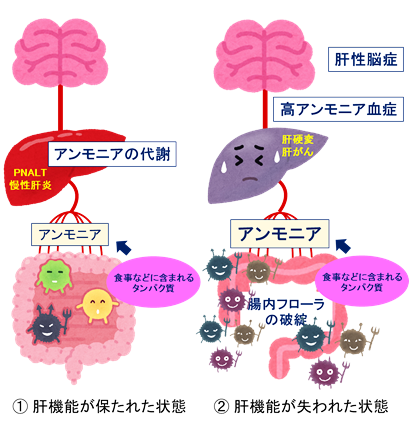
図2 肝性脳症
アンモニアは、食物などに含まれるタンパク質が腸管内で腸内細菌(アンモニア生産菌)によって代謝される際に発生する。腸管から吸収されたアンモニアは門脈から肝臓に入り、通常は無毒化される(①)。 しかし、腸内フローラの破綻(dysbiosis)によるアンモニア生産増加に併せて肝硬変などで肝臓の解毒能が低下した状態では、血液中のアンモニア濃度は上昇し、血流を介して脳に達し、肝性脳症を発症する(②)
お問い合わせ先
研究全般に関するお問い合わせ先
名古屋市立大学大学院医学研究科
教授 田中 靖人
九州大学大学院農学研究院
准教授 中山 二郎
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 感染症研究課
(肝炎等克服実用化研究事業 担当)


